常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-04-21 17:30:00 细胞资源库平台 访问量:387
英文标题:A Frog Skin-Derived Peptide Targeting SCD1 Exerts Radioprotective Effects Against Skin Injury by Inhibiting STING-Mediated Inflammation
中文标题:一种源自青蛙皮肤的肽通过抑制STING介导的炎症,靶向SCD1,对皮肤损伤具有放射防护作用
发表期刊:《ADVANCED SCIENCE》
影响因子:14.3
作者单位:
四川大学华西第二医院的辐射医学实验室;
第四军医大学预防医学研究所放射医学科;
苏州大学放射医学与防护学院国家重点实验室
作者信息:
Fenghao Geng, Li Zhong, Tingyi Yang, Jianhui Chen, Ping Yang, Fengdi Jiang, Tao Yan,Bin Song, Zuxiang Yu, Daojiang Yu, Jie Zhang,* Jianping Cao,* and Shuyu Zhang*
背景:辐射性皮肤损伤缺乏有效防治手段,STING通路激活是关键致病机制。
生物启发:耐辐射生物(如奇球菌、缓步动物、蛙类)通过抗氧化、DNA修复或多肽分泌抵抗辐射损伤。
新发现:蛙源多肽RIFSP-2通过抑制SCD1减少单不饱和脂肪酸生成,阻断STING过度激活。
机制:RIFSP-2调控脂代谢-免疫轴(SCD1-STING-MUFA)维持细胞稳态,减轻辐射皮肤损伤。
意义:提出靶向天然多肽调控代谢-免疫平衡的抗辐射新策略,为临床转化提供候选分子。
细胞来源及类型:HaCaT、WS1、HEKs、RAW 264.7。
培养基及条件:HEKs用D-KSFM,其他用含10% FBS的DMEM,37℃、5% CO₂。
辐射设备与方法:KUBTEC XCELL 320,不同剂量,1.7 Gy/分钟。
动物来源:成年黑斑侧褶蛙,体重20–25 g。
辐射方法: Clinac 2100EX加速器,6-MeV电子束,剂量率1000 cGy/分钟。
伦理审批:苏州大学动物实验伦理委员会。
合成与纯化:上海生工生物工程,HPLC和LCMS验证纯度≥95%。
基因敲除小鼠:TMEM173-KO和杂合,通过CRISPR/Cas9技术构建。
实验模型:全身辐射4 Gy,皮肤损伤模型(直径8 mm创口)。
伦理审批:苏州大学动物实验伦理委员会。
RNA测序:上海欧易生物完成。
多肽互作组分析:杭州景杰生物完成。
脂质组学:苏州帕诺米克生物完成。
细胞裂解:预冷PBS清洗,
裂解液裂解。IP:500 μg裂解液,3 μg STING抗体与Protein G磁珠。
检测:Western blot。
处理:细胞加15 μM生物素标记肽,裂解。
分析:500 μg裂解液与链霉亲和素磁珠结合。
蛋白固定:CM5芯片,胺偶联法。
结合动力学:RIFSP-2浓度梯度,HBS-EP+缓冲液。
参数计算:Biacore T200软件。
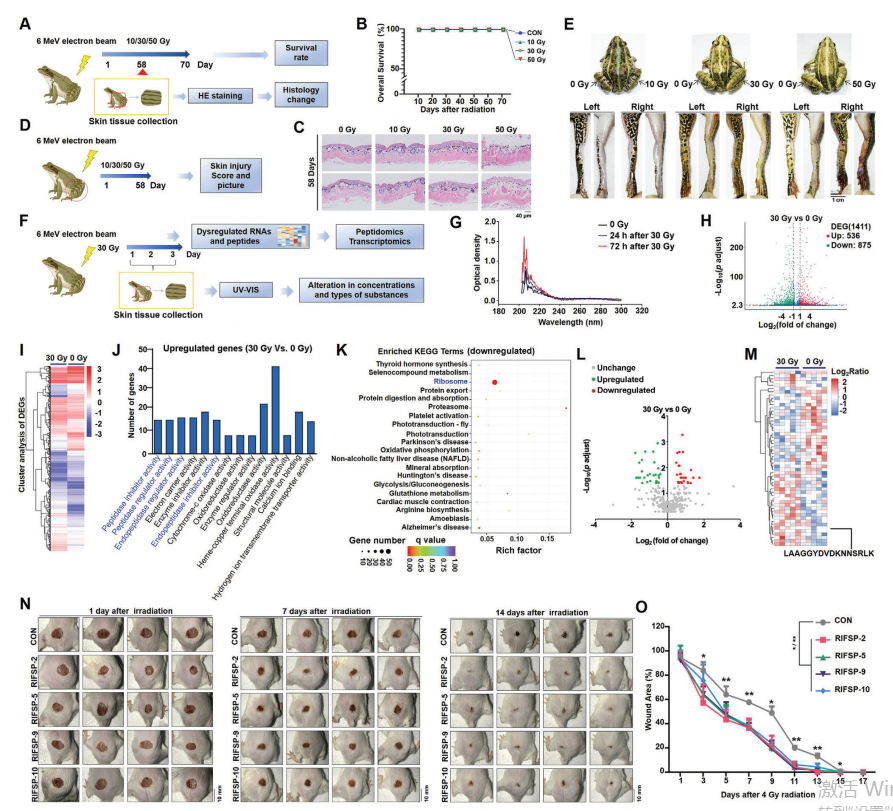
A. 辐射损伤模型建立
示意图展示了在青蛙背部和四肢建立辐射诱导的皮肤损伤模型。
B. 生存曲线分析
绘制了不同剂量辐射暴露在背部青蛙的生存曲线。
C. 皮肤组织形态变化检测
使用H&E染色检测辐射后青蛙背部皮肤组织的形态变化。
D. 四肢皮肤病理表现
观察了不同剂量辐射暴露在四肢皮肤组织中的病理表现。
F. 皮肤组织粗提物研究
示意图展示了使用UV-VIS光谱法对皮肤组织粗提物进行研究,以及进行RNA-Seq和肽组分析的工作流程。
G. 光学密度变化
记录了辐射青蛙皮肤组织粗提物的光学密度变化。
H. 基因表达火山图
显示了辐射后青蛙皮肤组织中不同表达基因的火山图。
I. 基因聚类分析
进行了辐射诱导的不同表达基因的聚类分析。
J. 基因本体论(GO)分析
对辐射诱导的不同表达基因进行了GO分析。
K. 京都基因与基因组百科全书(KEGG)分析
对辐射诱导的不同表达基因进行了KEGG分析。
L. 肽表达火山图
显示了辐射后青蛙皮肤组织中不同表达肽的火山图。
M. 肽聚类分析
进行了不同表达肽的聚类分析。
N. 皮肤损伤后照片
提供了使用不同RIFSPs处理的联合皮肤损伤模型小鼠在皮肤损伤后的照片。
O. 创伤愈合照片
提供了使用不同RIFSPs处理的联合皮肤损伤模型小鼠在创伤愈合过程中的照片。
P. 显著性差异
标记了与对照组相比具有显著性差异的结果,*P < 0.05 和 **P < 0.01。
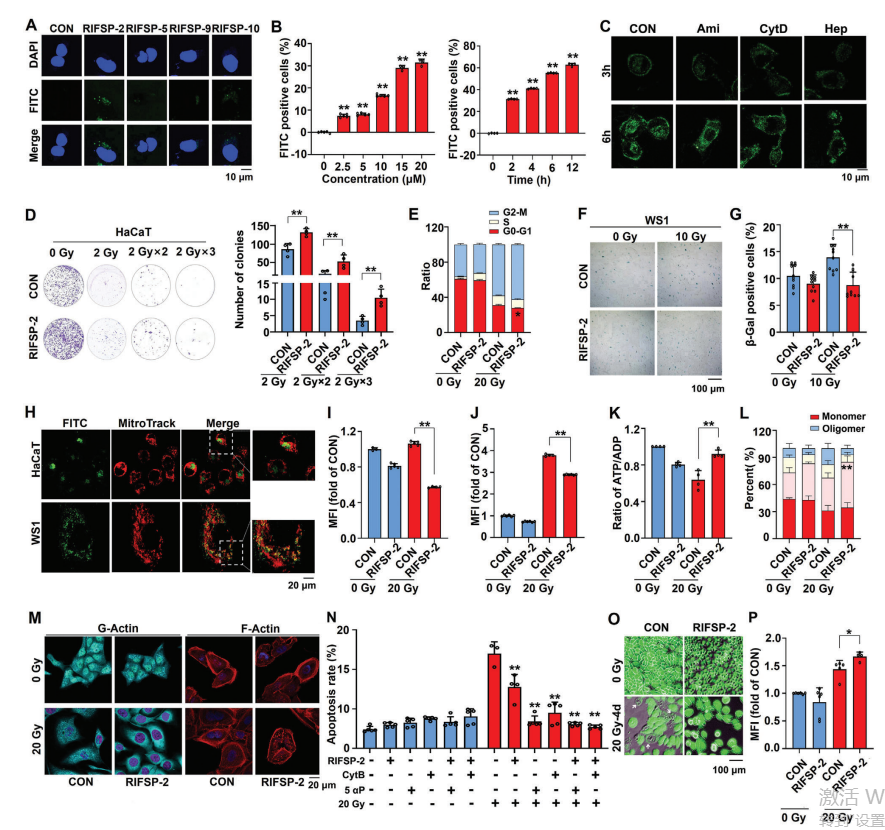
1. RIFSP-2摄取机制
A) FITC标记显示RIFSP-2为膜不通透性,需通过胞吞作用进入HaCaT细胞。
B) 流式细胞术证实细胞对FITC-RIFSP-2的摄取呈时间和剂量依赖性。
C) 肝素(竞争性抑制剂)、阿米洛利(巨胞饮抑制剂)和细胞松弛素D(胞吞阻断剂)显著抑制摄取,提示RIFSP-2通过巨胞饮途径内化。
2. RIFSP-2对细胞增殖与衰老的影响
D) 集落形成试验表明RIFSP-2可促进辐照后皮肤细胞增殖(*P <0.05)。
E) PI染色显示RIFSP-2调控细胞周期,减少辐照诱导的G2/M期阻滞。
F-G) SA-β-Gal染色表明RIFSP-2显著降低辐照导致的细胞衰老(**P <0.01)。
3. 线粒体功能保护作用
H) 共定位分析显示RIFSP-2在辐照细胞中线粒体富集。
I-J) DCFH-DA和MitoSox染色证实RIFSP-2抑制辐照诱导的细胞内及线粒体ROS积累(** P <0.01)。
K-L) ADP探针和JC-1染色表明RIFSP-2维持能量代谢和线粒体膜电位,减轻辐照损伤。
4. 肌动蛋白稳态与细胞死亡调控
M) 罗丹明鬼笔环肽染色显示RIFSP-2保护辐照细胞的肌动蛋白丝完整性。
N) 抑制肌动蛋白聚合(细胞松弛素B)或促进解聚(5αP)会逆转RIFSP-2的抗凋亡效应(AV/PI染色验证)。
O-P) 钙黄绿素AM释放试验表明RIFSP-2减少辐照引起的溶酶体膜透化及细胞坏死(**P <0.01)。
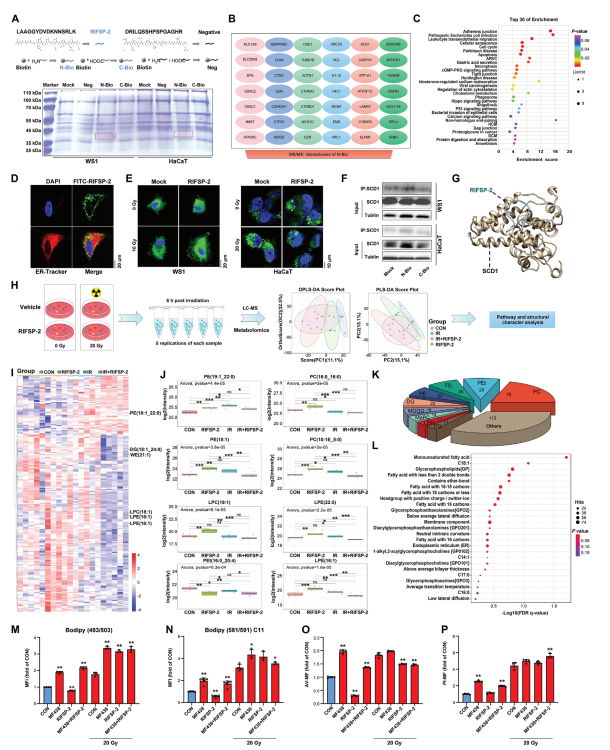
1. RIFSP-2互作组分析
A) 基于生物素-亲和素系统的LC-MS/MS互作组学揭示RIFSP-2在辐射皮肤细胞中的结合蛋白。
B) 韦恩图显示RIFSP-2特异性结合的蛋白质谱,SCD1(硬脂酰辅酶A去饱和酶1)被鉴定为关键互作靶点。
C) GO分子功能富集分析表明RIFSP-2互作组显著参与脂质代谢相关通路(如脂肪酸去饱和酶活性)。
2. RIFSP-2与SCD1的直接作用验证
D) 共定位分析显示FITC-RIFSP-2(绿色)与内质网标记(ER-Tracker,红色)高度重合,提示其靶向脂质代谢关键细胞器。
E) BODIPY 493/503探针染色显示RIFSP-2显著抑制辐射诱导的中性脂滴积累(**P <0.01)。
F) 免疫沉淀实验证实RIFSP-2与SCD1直接结合。
G) 分子模拟揭示RIFSP-2通过特定氨基酸残基(如Arg/Lys)与SCD1活性口袋结合,可能抑制其功能。
3. RIFSP-2对脂质代谢的调控
H) 脂质组学分析示意图显示RIFSP-2预处理逆转辐射引起的脂质代谢紊乱。
I-J) 热图和箱线图表明辐射显著上调单不饱和脂肪酸(如油酸、棕榈油酸),而RIFSP-2抑制这一效应(** P <0.01)。
K) 饼图显示RIFSP-2处理组中单不饱和脂肪酸比例降低,多不饱和脂肪酸比例升高。
L) 功能富集分析证实RIFSP-2选择性抑制SCD1介导的脂肪酸去饱和代谢通路。
4. SCD1介导的辐射损伤机制验证
M-N) SCD1抑制剂MF438消除RIFSP-2对中性脂滴形成的抑制作用,并逆转其对铁死亡(BODIPY 581/591 C11探针染色)和凋亡(AV/PI染色)的保护效应。
O-P) 统计显示MF438处理显著增加铁死亡标志物(脂质过氧化产物)和凋亡细胞比例(**P <0.01),证明SCD1是RIFSP-2发挥保护作用的关键靶点。
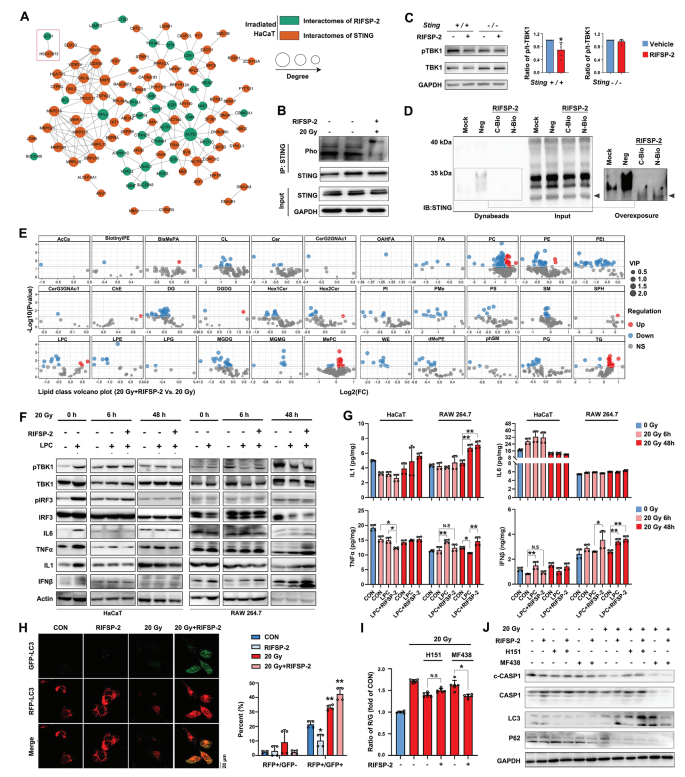
1. RIFSP-2与STING信号通路的互作验证
A) 生物信息学分析显示RIFSP-2(绿色节点)与STING(红色节点)及其相关蛋白存在特异性互作网络。
B) 免疫沉淀实验表明,RIFSP-2显著抑制辐照后HaCaT细胞中STING的磷酸化(**P <0.01)。
C) Western blotting显示,RIFSP-2仅在STING野生型小鼠的原代皮肤细胞中抑制下游TBK1的磷酸化,而在STING敲除细胞中无此效应。
D) 生物素-亲和素系统验证RIFSP-2与STING在辐照细胞中的直接结合。
2. 脂质代谢物对STING激活的调控
E) 火山图分析表明,辐照显著上调中链脂肪酸(如LPC 18:1),而RIFSP-2预处理逆转此趋势(** P <0.01)。
F) Western blotting显示,LPC(18:1)激活辐照细胞中STING下游信号(如p-TBK1、p-IRF3),而RIFSP-2抑制该作用。
G) ELISA检测证实RIFSP-2减少辐照诱导的炎症因子(如IL-6、TNF-α)释放,且此效应在RAW 264.7巨噬细胞中同样显著(**P <0.01)。
3. RIFSP-2对自噬与焦亡的调控
H) 共聚焦显微镜和流式细胞术显示,RIFSP-2处理减少辐照细胞中自噬体(GFP+/RFP+)数量,但增加自噬溶酶体(GFP+/RFP-)形成,提示其缓解自噬流阻滞。
I-J) 联合使用STING抑制剂H151或SCD1抑制剂MF438时,RIFSP-2的抗焦亡效应(通过Gasdermin D裂解检测)被部分逆转(** P <0.01),表明其作用依赖STING/SCD1通路。
4. 机制整合
结论:辐照诱导的中链脂肪酸(如LPC 18:1)通过激活STING-TBK1-IRF3轴驱动炎症反应和自噬失调,而RIFSP-2通过直接结合STING并抑制其磷酸化,阻断下游信号传导,减少炎症因子释放、自噬异常及细胞焦亡(N.S表示部分干预无显著差异)。
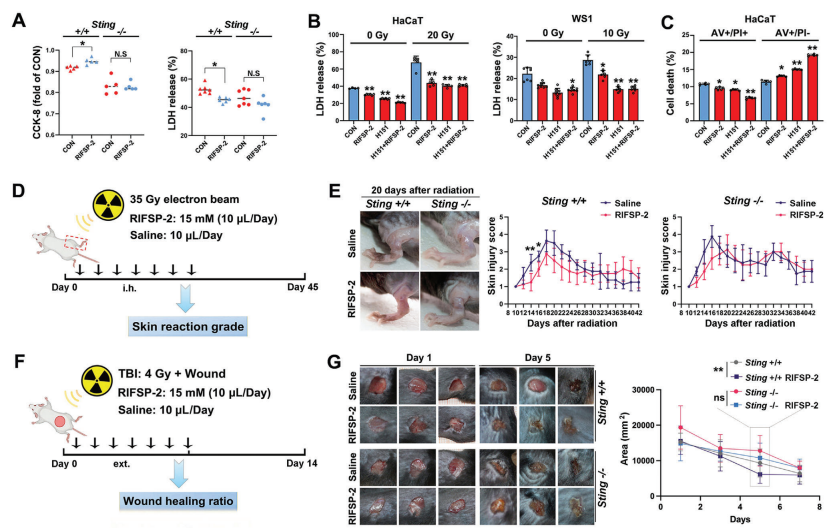
1. STING通路依赖性验证
A) CCK-8和LDH分析显示,RIFSP-2显著促进野生型小鼠原代皮肤细胞增殖并减少辐射诱导的细胞死亡(**P <0.01),但在STING敲除(STING-KO)细胞中无此效应(N.S)。
B) 联合STING抑制剂H151时,RIFSP-2对辐照细胞中LDH释放(细胞毒性标志)的抑制作用被逆转(** P <0.01 vs. 未加H151组)。
C) AV/PI染色和JC-1染色表明,RIFSP-2减轻辐照导致的凋亡和线粒体膜电位崩溃,而H151处理阻断该保护作用(**P <0.01)。
2. 动物模型验证RIFSP-2疗效
D-E) 建立辐射诱导皮肤损伤模型和复合损伤(辐射+创伤)模型,实验组小鼠局部注射15 mg/kg RIFSP-2,对照组给予生理盐水。
F) 皮肤损伤评分显示,RIFSP-2显著缓解辐射导致的红斑、水肿和溃疡(** P <0.01 vs. 盐水组)。
G) 在复合损伤模型中,RIFSP-2治疗组小鼠伤口愈合速率加快(愈合曲线斜率更高,**P <0.01),且炎症反应减轻。
3. 机制整合
结论:RIFSP-2通过靶向STING信号通路,抑制辐射诱导的细胞凋亡、线粒体功能障碍及炎症反应,且其体内外保护作用均依赖于STING功能完整性。动物实验进一步证实其显著缓解辐射皮肤损伤并促进创伤愈合。
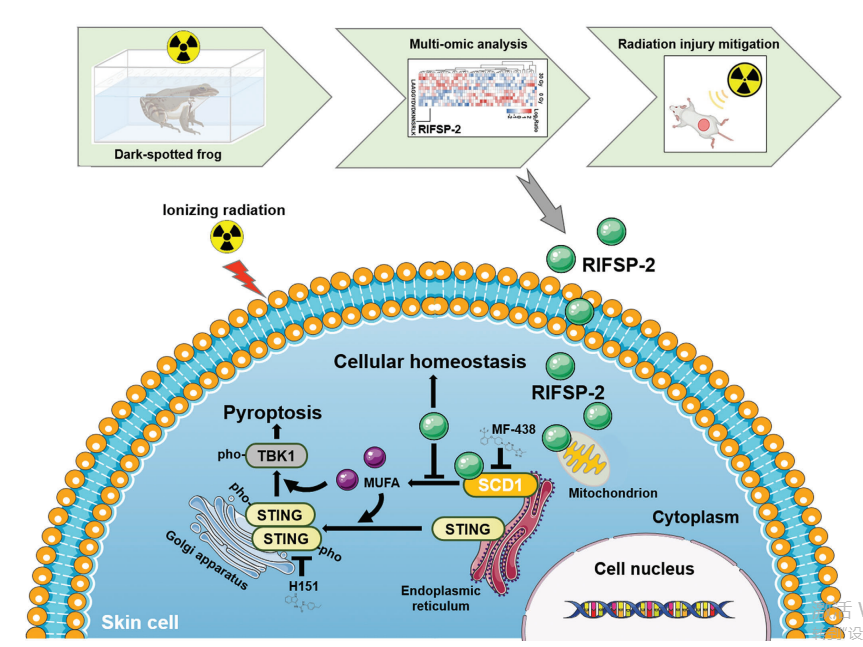
1. RIFSP-2的来源与作用途径
来源于黑斑蛙的RIFSP-2通过巨胞饮作用(图2机制)进入皮肤细胞,靶向脂质代谢关键分子SCD1。
2. 分子机制:抑制MUFA生物合成
RIFSP-2直接结合SCD1(图3验证),抑制其介导的单不饱和脂肪酸(MUFA,如油酸)生物合成。
MUFA减少可降低脂质过氧化产物(如LPC 18:1,图4结果),阻断其对STING通路的激活。
3. STING信号通路调控
MUFA水平下降限制STING磷酸化(图4B-D),抑制下游TBK1磷酸化及炎症因子(如IL-6、TNF-α)释放。
阻断STING-TBK1信号轴进一步减少细胞焦亡(Gasdermin D激活)和自噬异常(图4J)。
4. 细胞稳态保护效应
通过SCD1/STING双靶点作用,RIFSP-2维持线粒体功能(图2I-L)、肌动蛋白稳态(图2M-N)及脂质代谢平衡(图3I-K),从而:
减轻辐射诱导的细胞周期阻滞(图2E)和衰老(图2F-G);
减少凋亡、铁死亡和坏死(图2N-P,图3M-P);
促进皮肤损伤修复(图5F-G)。
5. 机制整合示意图
核心通路:RIFSP-2 → SCD1抑制 → MUFA减少 → STING失活 → TBK1/焦亡/炎症下调 → 细胞稳态恢复。
主要发现
肽类筛选与功能:
在电子束辐照的黑斑蛙(Pelophylax nigromaculatus)皮肤组织中鉴定出26种上调肽,其中4种(包括RIFSP-2)显著促进辐射损伤大鼠的伤口愈合。
RIFSP-2特性:
来源于组蛋白水解产物;
具有膜通透性,可维持细胞稳态;
通过抑制TBK1磷酸化,减少辐射诱导的细胞焦亡。
机制解析
靶点鉴定与作用途径:
直接靶点:利用链霉亲和素-生物素系统,确定SCD1(硬脂酰辅酶A去饱和酶1)为RIFSP-2的直接结合蛋白,SCD1是单不饱和脂肪酸(MUFA)生物合成的关键酶。
脂质代谢调控:脂质组学证实RIFSP-2抑制辐射后MUFAs(如油酸)的生物合成。
炎症与焦亡抑制:
MUFA减少限制辐射诱导的STING通路激活,降低TBK1磷酸化及下游炎症因子释放;
STING基因敲除或药物抑制(如H151)可逆转RIFSP-2对焦亡的抑制作用,延缓组织修复。
实验验证
动物模型验证:
RIFSP-2显著缓解辐射小鼠皮肤损伤(红斑、水肿、溃疡)并加速复合损伤(辐射+创伤)模型的伤口愈合。
核心通路:
RIFSP-2通过抑制“SCD1-MUFA-STING”轴,阻断辐射诱导的脂质代谢紊乱、炎症级联反应及细胞焦亡。
结论与意义
转化价值:应激诱导的两栖动物肽(如RIFSP-2)可作为新型辐射缓解剂的来源,其多靶点机制(SCD1-MUFA-STING)为辐射防护提供了创新策略。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:体外高效,体内乏力?伏立诺他为何对mRNA疗法‘双标’?
下一篇:细胞裂解物中的mRNA展示技术用于鉴定靶向BRD3胞外末端结构域的环肽