常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-06-09 09:18:58 细胞资源库平台 访问量:224
脑胶质瘤是中枢神经系统最常见且极具侵袭性的原发性恶性肿瘤,其中胶质母细胞瘤(GBM)恶性程度最高、预后极差。其特点是高度异质性、浸润性生长、易复发以及对传统放化疗抵抗性强,导致患者中位生存期短,是神经肿瘤领域亟待攻克的重大难题。因此,构建可靠、模拟性强的脑胶质瘤成瘤模型至关重要。这些模型(如基于细胞系、患者来源异种移植、类器官或基因工程动物的模型)是深入探究肿瘤发生发展分子机制、肿瘤微环境相互作用、侵袭转移规律以及治疗抵抗根源的核心工具。它们不仅为高通量筛选潜在有效药物、评估新型疗法(如免疫治疗、靶向治疗)提供了不可或缺的平台,也为实现个体化精准医疗策略的探索和验证奠定了坚实基础,是连接基础研究与临床转化的关键桥梁。
细胞名称:C6-NLUC-Puro大鼠脑胶质瘤细胞(NLUC标记)
种属来源:大鼠
组织来源:胶质瘤、脑
生长特性:贴壁生长
细胞形态:成纤维细胞样
背景介绍:Luciferase C6细胞稳定表达萤火虫荧光素酶。该细胞株性状稳定,培养时不需要添加抗生素维持。可用作萤火虫荧光素酶活性检测中的阳性对照,也可用于活体动物成像实验。该细胞通过慢病毒转染的方式携带Luc基因。其亲本株是神经肿瘤研究领域的经典模型细胞系,由Benda等人于1968年通过化学致癌法建立。该细胞源自Wistar/Furth大鼠,通过反复注射N-亚硝基甲基脲(NMU) 诱导脑内胶质瘤形成,并从中分离培养获得永生化细胞。
puro药筛浓度:C6-NLUC-puro细胞puro药筛浓度为1.0ug/ml,培养过程中建议使用0.5ug/ml puro维持
培养须知:首次复苏或长期未用嘌呤霉素时,建议用含嘌呤霉素的培养基培养24-48小时以清除非抗性细胞。建议定期备份低代次细胞,并记录荧光素酶活性数据以确保实验一致性。如有特殊需求(如无血清培养),需逐步驯化并验证基因稳定性。双标记(NLUC+Puro)确保长期基因稳定性,但需持续筛选压力。
| 特性参数 | 颅内原位接种 | 皮下异位接种 | 尾静脉注射(转移模型) |
| 推荐细胞密度 | 5×10⁴-1×10⁵ cells/μL(注射体积:5-10μL) | 5×10⁶-1×10⁷cells/0.1mL(悬液体积:100-200μL) | 1×10⁶cells/0.1mL(单次注射量) |
| 接种部位 | 脑实质(纹状体/皮层 ) | 背部皮下 | 尾静脉 |
| 操作复杂度 | 需立体定位仪,技术要求高 | 操作简便 | 需熟练静脉注射 |
| 成瘤周期 | 7-14天(快速形成侵袭灶) | 10-21天(形成可触及包块) | 肺转移:21-28天 脑转移:28-35天 21-35天(肺/脑转移灶延迟出现) |
| 病理模拟性 | 保留血脑屏障穿透、脑组织侵袭及微环境互作 | 缺乏脑特异性微环境 | 自发转移模拟晚期病程 |
| 活体成像适用性 | NLuc信号穿透颅骨,可动态监测原位瘤进展 | 浅表位置成像信噪比高 | 转移灶分散,需高灵敏度 |
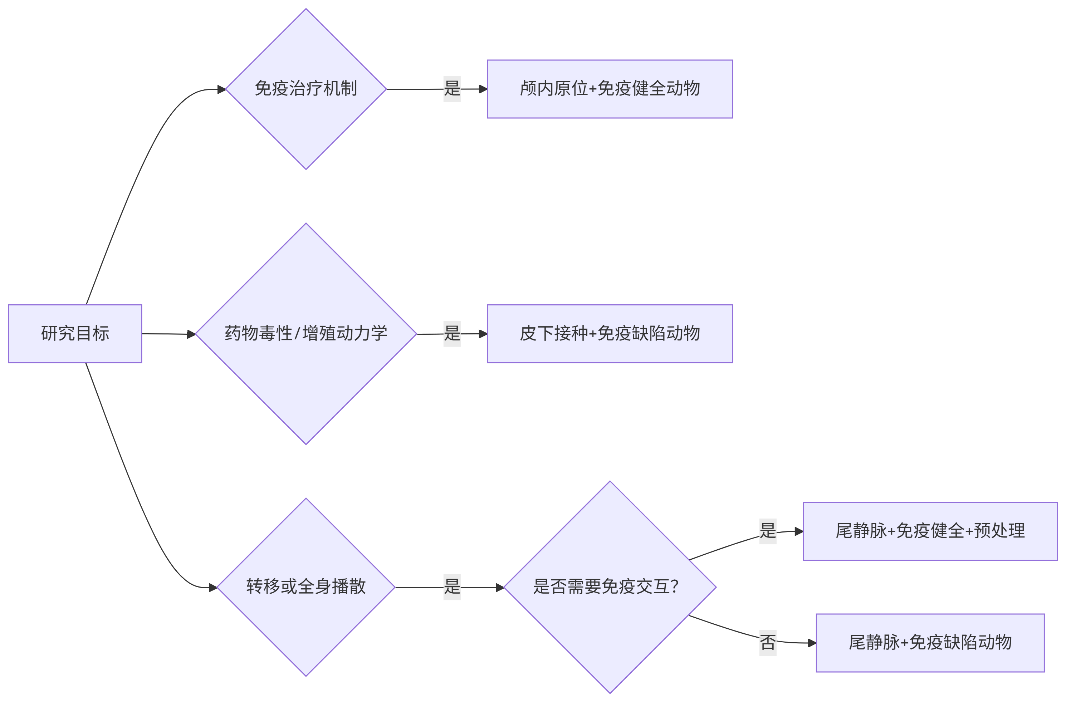
| 主要应用方向 | 侵袭/屏障穿透/靶向治疗 | 药物初筛/增殖动力学 | 转移机制/抗转移药物 |
| 优势 | 高临床相关性,精准模拟人脑胶质瘤微环境 | 操作简单、成本低,适合大样本量筛选 | 构建全身转移模型 |
| 局限性 | 局限性 | 手术创伤干扰,技术要求高 | 缺乏脑组织特异性,血管生成模式不同 |
| 产品货号 | 细胞系 | 物种来源 | 培养特性 | 体内生长速度 | 侵袭性 | 血管生成 | 免疫微环境互作 | 常用研究方向 |
| IM-R019 | C6 | 大鼠 | 贴壁,成纤维样 | 快(7-14天) | 高(浸润性) | 丰富微血管 | 强小胶质细胞趋化 | 侵袭/血管生成/药物递送 |
| IM-H211 | U87 | 人 | 贴壁,上皮样 | 中(14-21天) | 中 | 中等 | 弱(免疫缺陷鼠为主) | 放疗/靶向治疗 |
| IM-M084 | GL261 | 小鼠 | 贴壁,混合型 | 中慢(21-28天) | 中高 | 中等 | 保留免疫应答(适用免疫治疗) | 免疫治疗机制 |
| IM-H328 | U251 | 人 | 贴壁,星形 | 快(10-18天) | 高 | 强 | 弱 | 基因治疗/耐药机制 |
| IM-R043 | 9L | 大鼠 | 贴壁,梭形 | 快(10-15天) | 中 | 弱 | 有限 | 溶瘤病毒/化疗 |
| 问题现象 | 主要原因 | 解决方案 | 验证方法 |
| 活体成像信号弱 | 1.颅骨衰减(原位模型) 2.细胞活性低(传代过度/冻存损伤) 3.底物furimazine失效 | 1.信号补偿: 预实验测算衰减系数(通常×1.5-2.0) 2.细胞活性控制: -使用≤P15代细胞 -复苏后培养≥48h再接种 3底物管理: --80℃分装避光保存 -注射前37℃复温 | 体外NLuc活性检测(≥5×108RLU/mg) 添加阳性对照细胞(如HEK293-NLuc) |
成瘤率低 (原位<80%,皮下<90%) | 1.接种细胞密度不足 2.注射技术失误(原位返流/皮下渗漏) 3.免疫排斥(免疫健全动物 ) | 1.密度优化: -原位:5×10⁴/μL+10%Matrigel -皮下:1×107/0.1mL 2.技术规范: -原位:留针2min,退针1μm/min -皮下:针头预涂PBS防粘附 3.免疫管理: -免疫健全鼠用环磷酰胺预处理 (50mg/kg,接种前3天) | 接种后即刻活体成像确认细胞滞留 组织切片验证接种位点肿瘤细胞 |
| 动物急性死亡(接种后72h内) | 1.颅内压骤升(原位注射过快/体积过大) 2.肺栓塞(尾静脉注射气泡或细胞团块) 3.感染(手术器械污染) | 1.注射参数: -原位:≤1μL/min,总量≤10μL -尾静脉:0.2mL注射器+细胞滤网(40μm) 2.无菌操作: -高温灭菌立体定位仪配件 -术后腹腔注射恩诺沙星(5mg/kg) | 尸检确认死因(脑出血/肺栓塞) 细菌培养检测感染源 |
| 转移模型无信号(尾静脉接种后28天) | 1.免疫清除(未用免疫缺陷鼠 ) 2.转移灶休眠(细胞侵袭力不足) 3.成像灵敏度不足 | 1.动物模型:改用NSG小鼠(T/B/NK三缺陷 ) 2.细胞强化: -体内传代筛选高转移亚株 -过表达MMP9/CD44 3.成像优化: -曝光时间延长至300s -腹腔注射底物增至150μL | 肺组织HE染色检测微转移灶 体外Transwell验证侵袭力提升 |
| 信号背景噪声高 | 1.底物非特异性结合 2.动物毛发/粪便残留荧光 3.仪器校准偏移 | 1.底物净化:离心后取上清(16,000g,5min) 2.样本准备: -剃毛+酒精清洁皮肤 -成像前禁食4h 3.设备维护: -每月黑场校准 -使用标准光源校验" |
| 研究目标 | 实验分组设计 | 接种方案 | 检测指标与时间点 | 数据分析重点 |
| 基础成瘤特性验证 | 1.阴性对照(PBS接种) 2.C6-NLUC-Puro组(3个密度梯度) 3.母本C6细胞对照 | 原位接种: ·密度:5×10⁴/μL,1×105/μL,2×105/μL · 体积:5μL/只 ·坐标:前囟后1.0mm,右偏2.5mm,深3.0mm | ·活体成像:D3/7/10/14(底物150μL,注射后10min成像) · 组织学:D14取脑(H&E,GFAP/IHC) · 生存分析:≥D30 | · 信号强度-时间曲线 · 侵袭距离(距接种点mm) · 中位生存期 |
| 放疗联合替莫唑胺疗效 | 1.对照组 2.放疗单药(6Gy×3) 3.替莫唑胺单药(50mg/kg) 4.联合组 | 原位接种: · 密度:1×10⁵/μL · 体积:5μL/只(SD大鼠) | ·成像监测:治疗前+治疗后D3/7/14 ·MRI:D14(T2加权测瘤体积) ·流式细胞术:D7瘤组织(凋亡/细胞周期) | · 相对信号衰减率(vs基线) · 肿瘤控制率(TCDso) ·Caspase-3阳性率 |
| 抗PD-1免疫治疗响应 | 1.1gG对照组 2.抗PD-1单药(10mg/kg,Q3D×4) 3.C6-NLUC-Puro+免疫健全C57BL/6鼠 | 原位接种: · 密度:8×10⁴/μL · 体积:3μL/只(小鼠) | · 成像:D7/14/21 ·流式:D14脑组织(CD8+T细胞, Treg,MDSC) ·ELISA:血清IFN-Y | ·肿瘤浸润CD8+T细胞占比 · 信号增长延迟时间 · 长期生存率(≥D60) |
| 尾静脉转移模型构建 | 1.NSG对照组 2.C6-NLUC-Puro组 3.高转移亚株(C6-LM) | 尾静脉注射: ·密度:1×106/0.1 mL ·注射器:29G胰岛素针+40μm滤网 | ·全身成像:W2/3/4 · 离体器官成像: W4(肺/脑/肝) · 组织学:肺切片(H&E计数转移灶) | · 转移器官分布率 · 荧光强度-转移灶数量相关性 · 微灶大小(μm) |
| 血脑屏障穿透药物评价 | >1.游离药物组 2.纳米载体组 3.靶向肽修饰载体组 | 原位接种: · 密度:1×10⁵/μL(BALB/c裸鼠) | ·成像:给药前+给药后2h/24h ·LC-MS/MS:D24脑组织药物浓度 · 电镜:瘤周血脑屏障紧密连接 | · 脑/血浆药物浓度比 ·瘤内NLuc信号抑制率 · 载体蓄积效率 |
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:LA795-NLUC-puro小鼠肺腺癌细胞尾静脉成瘤验证
下一篇:MB49-FLUC-puro小鼠膀胱癌细胞皮下成瘤验证