常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2024-07-04 17:27:27 细胞资源库平台 访问量:1217
人神经母细胞瘤SH-SY5Y细胞系被广泛用于神经系统研究,该细胞系是SK-N-SH细胞系的亚系,于1970年从4岁女性转移性神经母细胞瘤的骨髓穿刺活检中建立,该细胞系包括两种形态上不同的细胞类型,一种为成神经细胞,另一种为上皮样细胞。SH-SY是来源于SH-N-SH的成神经细胞亚系,SH-SY5是SH-SY的亚系,SH-SY5Y是SH-SY5的亚系,经历了三轮克隆选择最终形成。
sh-sy5y cells是人骨髓神经母细胞瘤细胞株,它衍生于人的神经母细胞瘤细胞系SK2N 2SH。这些细胞具有神经突样的细胞质突起,是研究神经元和神经内分泌系统疾病常用的动物模型。SH-SY5Y细胞能够表达GABA受体、谷氨酸受体等功能的亚型,并参与多种神经递质的合成与释放。在临床医学中,SHSY5Y常用于神经系统疾病的发病机制及治疗的研究,如阿尔茨海默病、癫痫等。此外,它还可以作为一种工具来探索其他药物的作用机制以及其对正常生理功能的影响。
sh-sy5y cells衍生于人的神经母细胞瘤细胞系SK2N 2SH ,它具有表达儿茶酚胺能神经元特有的酪氨酸羟化酶、多巴胺2B2羟化酶和多巴胺转运体, 该细胞系被广泛运用于PD 发病机制的研究。
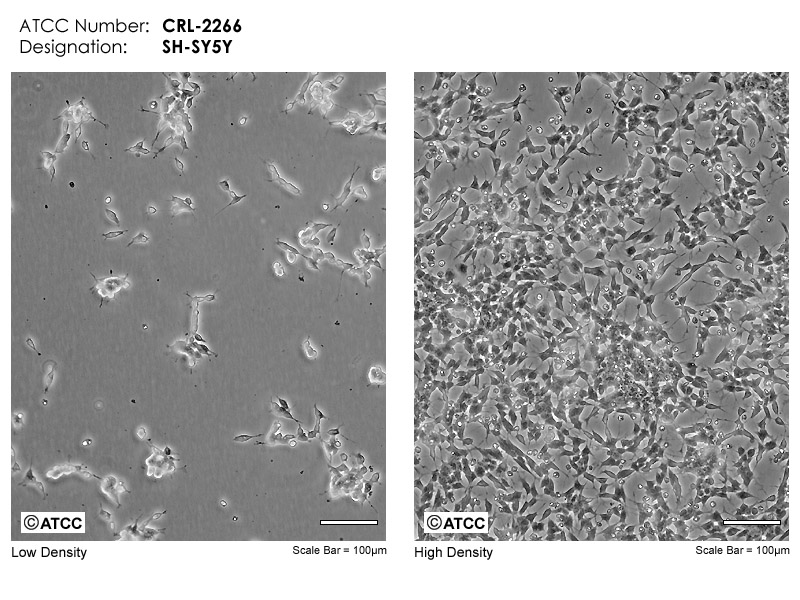
细胞名称:SH-SY5Y,人神经母细胞瘤细胞
细胞别称:SHSY5Y; SHSY-5Y; SH-Sy5y; SK-SH-SY5Y; SY5Y;人神经母细胞瘤细胞
种属来源:人
年龄性别:女;4岁
组织来源:脑神经母细胞瘤,转移部位骨髓
生长特性:半贴壁生长(贴壁和悬浮同时存在)
细胞形态:上皮细胞样
STR位点信息:Amelogenin:X;CSF1PO:11;D13S317:11;D16S539:8,13;D18S51:13,16;D19S433:13,14;D21S11:31,31.2;D2S1338:17,19;D3S1358:15,16;D5S818:12;D7S820:7,10;D8S1179:15;FGA:23.2,24;TH01:7,10;TPOX:8,11;vWA:14,18;
保藏机构:ATCC; CRL-2266 DSMZ; ACC-209 ECACC; 94030304 ;中国典型培养物保藏中心细胞库
培养基:43%MEM+43%F12+10%FBS+1% MEM NEAA(非必需氨基酸)+1%丙酮酸钠+1% GlutaMAX-1+PS
培养条件:气相:95%空气+5%二氧化碳;温度:37℃
冻存条件:无血清冻存液,液氮储存
倍增时间:~48-72 hours
抗原表达情况:Blood Type A; Rh+
染色体:81~92
2. 由于SH-SY5Y细胞是三维团簇的方式生长,复苏和传代后会重新附着为三维岛(会有一些不会重新附着的簇)。生长最终会从岛屿状慢慢扩散开来,随着时间的推移,细胞会缓慢变成单层,这个时候细胞基本处于对数生长期。
3. SH-SY5Y细胞是一种本身生长缓慢的细胞,当细胞培养至细胞 70~80% 的汇合度,即可进行分瓶处理,一般T25培养瓶建议1:2传代,每周可传代2~3次,如果细胞生长速度比正常的时候更慢,可以适当提高血清到20%有利于促进生长。
4. SH-SY5Y细胞在复苏、传代后,细胞会有一些漂浮状态,这些漂浮细胞是正常现象,可以视为混合的贴壁和悬浮细胞系。一般复苏、传代培养3天后漂浮细胞会再继续粘附贴壁。直到生长从岛屿扩散开来并且在培养瓶内伸展开,通常在进行换液的时候我们会补加培养基,如果一定要全换液,可以通过离心收集悬浮细胞以1000转5min,并将悬浮细胞接种到新培养瓶。
5. SH-SY5Y细胞密度低时,生长缓慢,接种密度建议启动接种密度:8.0×104至 1.5× 105活细胞/cm2为宜,继代培养的接种密度:4.0 × 104至 1.0×105 活细胞/cm2。
实验室条件
1. 无菌环境:无菌室包括更衣室,缓冲间,风淋间,操作间
2. 仪器设备:超净工作台-操作平台、CO2 培养箱-细胞生长的环境、倒置显微镜-观察细胞、离心机-离心收集细胞、冰箱-放置培养基等试剂、水浴锅-复苏细胞、真空泵-收集废液、灭菌锅-灭菌、干燥箱-烘干器材、液氮罐-冻存细胞、纯水仪-制备一级水
3. 器材耗材:玻璃瓶、培养瓶、培养皿、巴士管、离心管、移液枪、枪头(白色 0-10ul;黄色 20-200ul;蓝色 100-1000ul)、滤器,吸管,多孔培养皿、6cm 皿、10cm 皿,培养瓶等。
4. 试剂:MEM、F12、NEAA(非必需氨基酸)、丙酮酸钠、GlutaMAX-1、FBS胎牛血清、双抗、胰酶(0.25%Trypsin-0.02% EDTA)、pbs
操作者工作范畴
1. 无菌操作:洗手,戴手套,穿实验服,常喷 75%酒精
1.准备:紫外线照台 30min,提前打开水浴锅设置 37℃,培养基临用前放水浴箱里温育20 分钟(或者放在超净工作台常温放 30min)。在操作台上摆放好物品,左边放完全培养液,1mL 枪头(已灭菌),培养皿,右上角放废液缸,1mL 移液枪,3mL 巴氏管。检查离心机,废液泵。
2)待水浴锅温度达到 37℃时,戴上手套和护目镜,从-196℃液氮罐中取出冻存管,将含有1 mL细胞悬液的冻存管在 37℃水浴中迅速摇晃解冻,同时不断轻轻摇动冻存管,尽量保证冻存管内细胞 1min 内融化,加4 mL培养基混合均匀, 移入离心机中 100rpm 离心 3min,以 75%酒精喷冻存管外部,移入无菌操作台内。
3)用 3mL 巴氏管取 5mL 新鲜培养基到一个新的 6cm 培养皿中,(若离心后细胞量较多,可取 12mL 新鲜培养基到一个新的 10cm 培养皿中),标记日期、所用培养基名称和细胞名称。
4)用废液泵(吸力不要太大)取一个黄色枪头从冻存管中吸走上清,取 1mL 新鲜培养基重悬细胞后(充分混匀),将细胞悬液加入到培养皿中,将培养皿在超净工作台上以画“8”字法铺匀细胞(一般培养皿在台子上画 30 个 8 字即可铺匀),最后在显微镜下检测是否铺匀细胞。
5)确定细胞已铺匀后,再把培养皿放入 CO2 培养箱过夜。(尽量平直放入不要晃动),第二天换液并检查细胞密度。
1) 准备工作:紫外线照台 30min,准备好细胞培养所需试剂物品:培养液,胰酶,PBS(试剂提前拿出 37℃预热或者常温放置半小时以上);传代用培养皿,巴士管,离心管(已灭菌),枪头(已灭菌),移液枪,废液缸。检查离心机,废液泵;
2)从培养箱拿出细胞,在显微镜下观察细胞密度和细胞状态,当细胞状态良好,且密度达到 85%左右的时候即可进行传代;
4)打开废液泵,用废液泵吸头(吸力不要太大)取一个蓝色枪头吸走上清废液,用巴士管取 4ml 不含钙、镁离子的1xPBS(6cm 皿)到细胞培养皿中(若是 10cm 皿则取 8ml 1xPBS),轻轻晃动以清洗细胞表面1-2次;
5)用废液泵吸走 PBS 废液,加1 mL消化液(0.25%Trypsin-0.02% EDTA)于培养瓶中,拿起培养皿轻轻转动以便胰酶浸泡到每个细胞,消化 1-3min(根据细胞贴壁情况判断,贴壁较牢的消化时间长一点或者放入 CO2 培养箱中消化几分钟)后,在显微镜下观察细胞是否变圆变亮,一旦发现大量细胞胞质回缩,细胞间隙增大,即将脱离培养皿底,迅速拿回操作台,轻敲几下培养瓶后加少量培养基终止消化。
6)用 1ml 移液枪轻柔吹打,保证培养皿底的每个角落都吹打到,边缘处也不能忽略(吹打时尽量避免产生气泡,因其对细胞有伤害;需轻柔吹打,用力吹打对细胞也有伤害),把培养瓶中所有细胞悬液用吸 1ml 移液枪移入无菌离心管中。
7)将装有细胞悬液的离心管放入离心机中(配平),1000 转离心 3-5min,用废液泵取一个黄色枪头从冻存管中吸走上清,取 1-2mL 新鲜培养基重悬细胞后(充分混匀),将细胞悬液按1:2比例分到新的含8 mL培养基的新皿中或者瓶中,将培养皿在超净工作台上以画“8”字法铺匀细胞(一般培养皿在台子上画 30 个 8 字即可铺匀),最后在显微镜下检测是否铺匀细胞。
8) 确定细胞已铺匀后,再把培养皿放入 CO2 培养箱培养。(尽量平直放入不要晃动)。第二天再观察细胞密度。
1. 培养该SH-SY5Y细胞要有耐心,不能看见抱团或不贴壁,就急着处理或频繁观察,给细胞稳定的培养环境和时间成长。
2. SH-SY5Y细胞消化时,肉眼很快会发现细胞脱落,不要着急终止消化,因细胞团块虽然脱落,但细胞之间的蛋白还紧密连接。所以稀释消化液,延长消化时间很关键。
3. 根据SH-SY5Y细胞特点,一定要正确判断细胞密度,如感觉细胞生长缓慢,5-6天还不能传代,可消化下来计数判断。该细胞大部分呈贴壁生长,根据情况,如悬浮量少,可不回收。
1) 准备工作:紫外线照台 30min,准备好细胞培养所需试剂物品:培养液,胰酶,PBS(试剂提前拿出 37℃预热或者常温放置半小时以上);传代用培养皿,巴士管,离心管(已灭菌),枪头(已灭菌),移液枪,废液缸。检查离心机,废液泵;
2)从培养箱拿出细胞,在显微镜下观察细胞密度和细胞状态,待细胞生长状态良好且存活率高的状态下,细胞密度达 80–90%时,可进行细胞冻存操作,以T25 瓶为例
a.收集细胞及细胞培养液,将培养瓶内所有培养基转入无菌离心管,装入无菌离心管中,1000 rpm条件下离心4 min,弃去上清液,用PBS清洗一遍,弃尽PBS,进行细胞计数。
b.根据细胞数量加入无血清细胞冻存液,使细胞密度5×106~1×107/mL,轻轻混匀,每支冻存管冻存1mL细胞悬液, 在细胞冻存管上贴上细胞标签(细胞标签上包含:细胞名称、冻存日期、培养用的 培养基)。
c.将冻存管入库到-80 度冻存盒里,放置 24 小时后,即可移入液氮中保存,标记好入库位置和冻存日期。
1.冻存管在液氮长期保存过程中难免渗入液氮,取出细胞时震动不要过大,水浴前一定要观察管内是否存在液氮,若有液氮建议静置一会待液氮完全蒸发后再水浴;
2.水浴时可以使用一次性PE手套包住冻存管避免直接接触水源,可以降低管盖缝隙渗入水导致污染的概率;
3.水浴至剩米粒大小时及时终止水浴,避免过度水浴或水浴时间不足;
4.建议水浴完成后直接在离心管内离心细胞,避免再次转移细胞;
5.复苏后的SH-SY5Y细胞比较脆弱,吹打和转移细胞时尽量轻柔,复苏24h后换液去除死亡细胞;
1. 贴壁弱,消化时间短,注意控制消化时间;
2. 细胞传代容易成团聚集,可以通过控制细胞密度不超过80%,当密度到达或超过80%及时传代,传代时切勿暴力吹打,避免对细胞造成机械刺激,同时注意尽量吹散细胞;
3. 细胞生长偏慢,注意控制细胞密度不要过低;细胞密度过高时及时传代,避免培养基变黄导致细胞脱落或者状态变差。
4. MEM/F12以及DMEM/F12都可以培养SH-SY5Y细胞,但不同培养基培养之后会有部分形态差异;
5. SH-SY5Y细胞是成簇生长,饱和度高,其表现会是镜下观察密度低,但每团细胞簇密度大,可以根据培养基颜色进行换液;
常温运输过程中,sh-sy5y cells不免受到震荡和温度变化的影响,出现皱缩、聚团甚至脱落的现象。遇到这种情况,不用紧张,只要正确处理,细胞就能恢复正常生长。
常温细胞收货后,把sh-sy5y cells放进细胞培养箱静置4小时即可。
脱落后的细胞通常聚团漂浮,通过离心将漂浮的细胞团收集起来,在离心管里进行胰酶消化后重新铺板即可。
贴壁细胞常规方法消化下来,和处理好的脱落细胞合并,混匀后铺板。
1.SH-SY5Y脱落处理步骤
a. 1000rpm(约250g)4min离心收集细胞,去除旧培养基;
b. PBS 重悬细胞,再次 1000rpm(约250g)4min离心,去除PBS;
c. 加入 1mL左右 0.25%胰酶重悬细胞,吹打1-2下吹起沉淀即可;
d. 放入细胞培养箱约 5-8min;
e. 用移液枪轻轻吹打细胞悬液,使细胞团分散;
f. 迅速加入 3-5mL含血清的培养基混匀以终止消化;
g. 1000rpm(约250g)4min离心,去除胰酶;
h. 加入新鲜培养基按合适比例接入无菌培养器皿中;
2.SH-SY5Y细胞复苏后成团,不贴壁,不能平铺皿底?
复苏后,镜下观察会有部分成团,不要着急吹打分散,因为细胞刚复苏,比较脆弱。轻柔吹匀,即可放入培养箱,放入后不要再移动。
复苏第一天,如图贴壁细胞抱团贴壁,且部分贴壁部分飘起的大细胞团。这时你要观察细胞的活率,看看如死细胞较多,可再放置一天后处理。可根据情况补液,不可直接换液。
3.SH-SY5Y细胞非常敏感,在受到温度、化学或物理刺激后容易出现成团现象?
SH-SY5Y细胞培养时,贴壁细胞和悬浮细胞同时存在,贴壁细胞呈上皮样,有短触角延伸出来,倾向于成簇生长,容易成团。
悬浮细胞过多:SH-SY5Y细胞生长时有少量悬浮细胞,是正常现象。 如果出现大量悬浮的细胞,就需要引起注意了。
处理方法:换液时将悬浮细胞离心收集,新鲜培养基重悬后接种回原瓶/原皿。当贴壁细胞生长状态良好、密度适中时,可以舍弃悬浮细胞。
成团严重:SH-SY5Y细胞非常敏感,在受到温度、化学或物理刺激后容易出现成团现象。一个视野下,有少量成团现象,无需特殊处理。成团几乎没有铺展开的细胞时,就需要按以下方法特殊处理一下了。
成团较严重的SH-SY5Y细胞处理方法
方法1:低密度接种,用0.125%的低浓度胰蛋白酶消化细胞(时间不超过5min),按1:6比例传代接种,并换新的培养器皿。 延长换液时间,3天换液一次,防止细胞脱落。
方法2:使用多聚赖氨酸包被的培养器皿,以加快细胞贴壁速度,降低细胞聚集成团的几率。
方法3:重新铺板,并更换新配制的培养基,并加大血清比例(不超过20%)
方法4:接种时,减少培养基量(如T25加3mL)以加快细胞贴壁速度,等待细胞贴壁后(约8-12小时),再补加培养基。
预防成团的方法
1 控制细胞密度不超过80%,当密度到达或超过80%及时传代;传代时切勿暴力吹打,避免对细胞造成机械刺激
2 使用质量好的细胞培养基和胎牛血清,减少内毒素等有害物质对细胞的刺激
3 请勿频繁把细胞从培养箱拿出,气温低时需开暖气维持细胞房温度;使用PBS、培养基前37度预热,以避免温差对细胞造成刺激
4.SH-SY5Y细胞消化时间多久?
根据贴壁时间,培养箱静置消化5-8分钟,SH-SY5Y细胞易成团。
5.培养过程中SH-SY5Y细胞碎片较多怎么处理?
a.细胞内的黑色颗粒是细胞外分泌泡及细胞器折光,这个属于细胞自身特性,无法清除也无法改变,大部分细胞都会有这种现象,只是不同细胞颗粒多少有区别,细胞培养体系不适应、营养缺乏、渗透压异常等均可能导致细胞内颗粒增加,建议使用合适的培养条件。
b.细胞外的黑色颗粒大部分是细胞碎片和细胞代谢产物,可以先吸走培养基后用PBS润洗清除,再加新的培养基继续培养。润洗不能清除的可以换液清洗后等SH-SY5Y细胞密度70-80%左右消化处理细胞,消化完成后加完全培养基终止消化,混匀细胞,收集细胞悬液900-1000rpm离心3min,弃上清。再加5ml PBS重悬细胞,再离心后,用完全培养基重悬接种到新的培养皿。第二次PBS重悬是为了去除碎片,如果平时碎片比较少,传代时可以省略PBS重悬的步骤;如果碎片很多,建议PBS多洗几次。
1. 细胞贴壁较弱
细胞贴壁比较弱,因此在遇到运输低温及震荡、室温静置太长时间、添加的培养基或其他试剂过冷、密度较高、聚集未吹散、加液吹打到细胞面等情况时会出现明显的成片脱落现象,此时若脱落现象不严重应尽快放回培养基继续培养,若呈大片脱落的情况时需要收集细胞重新消化吹散并接种;建议使用经过包被或者高贴壁培养瓶培养细胞,尽量避免接触低温或密度过高;
2. 细胞本身偏嗜酸性,消耗培养基较快
有细胞在略微偏酸性的环境下生长状态会比偏碱性的好,注意培养基pH控制;细胞密度达到70%以上时,培养基消耗会很快,主意及时观察并换液;
3. 细胞生长到完全汇合时间较长
细胞呈岛状生长,生长是逐渐向外发射状增多,最终生长成片,但仍会有较多细胞间间隙;
4. 细胞聚团后很难再吹散
细胞传代过程中一定要注意吹散细胞,接种密度不要过高,否则接种后细胞聚团将很难再吹散,会形成类似神经球的聚集体贴壁生长,培养条件合适的情况下细胞会逐渐摊开生长,但若培养条件无法有效促进细胞贴壁,可能会长时间呈球状增殖;
5.生长异常缓慢
当SH-SY5Y细胞培养一周都无法传代时,可以将细胞消化下来,接种到更小的容器中,人为增加细胞密度,从而促进细胞生长。平时传代时也要注意接种密度不能太低。
6.能否使用DMEM/F12
MEM/F12和DMEM/F12都可以培养SH-SY5Y细胞培养,并且都有相应的文献支持。但这两种培养基培养出来的形态会有细微差异。 另外,使用品质好的胎牛血清将极大改善细胞生长状态。
神经母细胞瘤呈现为蓝染的小圆形细胞,菊花形排列。肿瘤细胞围绕神经毡(neuropil)呈菊花形排列,与其他的肿瘤(如视神经母细胞瘤)围绕血管呈菊花形排列有所不同。其他还有一些神经母细胞瘤所特异的免疫组化染色,用以与其他肿瘤(尤因肉瘤,淋巴瘤等)进行鉴别诊断。
SH-SY5Y细胞是神经母细胞瘤细胞系中常用的模型系统,广泛用于神经生物学和神经药理学研究。转染SH-SY5Y 细胞是一项重要的实验技术,在基因功能研究、蛋白表达和定量分析等方面扮演着关键角色。然而,由于SH-SY5Y细胞的特殊性质,使用传统转染方法可能会遇到一些困难。以下介绍一种优化的SH-SY5Y 细胞转染方法,并详细描述每个步骤。
SH-SY5Y细胞系:可从Cell Bank of the Chinese Academy of Sciences或其他来源获得。
细胞培养基:Dulbecco's Modified Eagle Medium(DMEM)/F12混合培养基。
热稳定型胰酶:用于细胞的传代与分离。
转染试剂:例如,聚乙烯亚胺(PEI)、脂质体等。
目标基因的质粒DNA或siRNA:用于转染和表达。
Opti-MEM:用于稀释转染试剂和质粒。
准备SH-SY5Y细胞
1. 获得SH-SY5Y细胞系并进行培养。
2. 在T25细胞培养瓶中分别加入10 ml完整的MEM/F12培养基及10%胎牛血清(FBS)。
3. 将SH-SY5Y细胞从细胞冻存管中复苏,并将细胞传递至培养瓶中。
4. 在37℃、5% CO2的培养箱中培养细胞,直至细胞达到80-90%的密度。
转染前的预处理
1. 转染前用DMEM/F12培养基含10% FBS对SH-SY5Y细胞进行预处理。
2. 将细胞培养至80-90%的密度。
3. 用1X PBS洗涤细胞2次,去除细胞内的残留培养基。
转染操作
1. 根据转染试剂的使用说明,将转染试剂稀释至合适的浓度,如使用PEI转染,可在Opti-MEM中稀释PEI至最终浓度。
2. 在另一个离心管中将质粒DNA或siRNA按照使用的量稀释至合适体积,并在Opti-MEM中混合均匀。
转染操作步骤
1. 向细胞中加入预先稀释好的转染试剂,注意不要形成气泡并避免细胞过度干扰。
2. 轻轻震荡培养瓶,使转染试剂均匀分布。
3. 将稀释好的质粒DNA或siRNA加入到培养基中,与转染试剂充分混合,避免形成沉淀。
4. 震荡培养瓶并置于37℃的培养箱中进行培养。
5. 根据研究需求,在48-72小时后进行下一步实验(如蛋白表达、基因敲除等)。
SH-SY5Y细胞可以制备成未分化和分化两种形式,两种SH-SY5Y细胞都被用于神经科学领域的体外实验研究。在未分化状态下,SH-SY5Y细胞不能完全表现出原代神经元的某些特征。通过向细胞培养物中添加特定化合物,神经母细胞瘤细胞可以分化为更成熟的神经元样细胞,表现出胆碱能、肾上腺素能或多巴胺能表型。
完全分化的SH-SY5Y神经细胞比其未分化的前体细胞更接近于体内发现的成熟人类神经元。此外,SH-SY5Y细胞可以进行基因遗传操作,包括基于转基因的基因敲除或病毒诱导地过表达,因此适合研究与疾病相关的基因功能。本文阐述SH-SY5Y细胞系的神经分化方法,SH-SY5Y细胞在神经退行性疾病,尤其在帕金森病、阿尔茨海默病等实验研究中的应用。
未分化的SH-SY5Y细胞形态特征为神经母细胞样、未极化的胞体,突起少而截断。这些细胞倾向于成簇生长,并可能形成团块。未分化的SH-SY5Y细胞持续增殖,表达不成熟的神经元标记,缺乏成熟的神经元标记。
SH-SY5Y细胞经过不同的分化方法可以分化为胆碱能、肾上腺素能或多巴胺能表型,分化的特征是细胞增殖停止,以及形态、生化和功能改变。形态学上,细胞突起明显延长;生化变化包括神经递质、神经调节剂、酶活性、神经组织特异性蛋白和囊泡蛋白的增加;从功能上讲,细胞的膜电位增加,导致细胞兴奋性增强。
多种化合物可诱导SH-SY5Y细胞分化,常用的分化剂有维甲酸、十四烷基佛波醇醋酸酯、脑源性神经营养因子。另外,神经生长因子、星形孢子素、17β-雌二醇、胆固醇、二丁酰环磷腺苷、胰岛素样生长因子1、胰高血糖素样肽-1等也可诱导SH-SY5Y细胞分化。
不同的分化剂组合,不同的培养环境也可促进细胞分化为更接近于体内的成熟人类神经元,分化后的SH-SY5Y细胞表现出不同的生化和功能改变。SH-SY5Y细胞经过逐渐去除血清,添加维甲酸、脑源性神经营养因子和细胞外基质蛋白,以及连续裂解来筛选分化的成熟贴壁神经元形成完全分化的SH-SY5Y神经元,比未分化的细胞更接近于成熟人类神经元。
脑源性神经营养因子是轴突标记物tau和树突状微管相关蛋白-2表达的关键驱动和调节因子,脑源性神经营养因子促进突触发生和突触连接的形成。在维甲酸处理下,SH-SY5Y细胞形成基本的轴突,但是在维甲酸-脑源性神经营养因子联合作用下,SH-SY5Y细胞分化并显示出分子不对称和大量神经元标记物的表达,维甲酸-脑源性神经营养因子对SH-SY5Y细胞的序贯调节导致了形态和分子的快速极化,模拟了真实神经元的分化。
另外,Goldie等通过对SH-SY5Y细胞的基因表达和转录后调控环境的研究发现,全反式维甲酸和脑源性神经营养因子的序贯调节分化诱导关键突触基因,脑特异性miRNA和miRNA生物发生机制的表达以及乙酰胆碱酯酶活性增加,产生更多具有特征的成熟神经元细胞群体。相比之下,仅由全反式维甲酸诱导的变化似乎在未成熟的神经母细胞和成熟的神经元之间产生了一种中间表型,并且可能是研究发育中神经元的合适模拟物。而Strother等提出了一种新颖、简单、无脑源性神经营养因子的技术,即使用维甲酸诱导细胞分化,将SH-SY5Y细胞在含5-氟脱氧尿苷、铁强化小牛血清或市售血清替代品(SR-2)的培养基中培养,形成了SH-SY5Y细胞的有效分化和长期培养。
此外,在无血清培养条件下,维甲酸和GLP-1可诱导SH-SY5Y细胞分化为形态和生理成熟的谷氨酸和多巴胺能神经元。用维甲酸预处理然后进行ECM凝胶培养,并结合脑源性神经营养因子、神经调节蛋白β1、NGF和维生素D3处理可产生与成人神经元明显相似的可持续细胞。SH-SY5Y细胞生长在层粘连蛋白包被的玻璃片上,用维甲酸处理后,显示出良好的神经元分化的形态,并强烈附着在玻片上(作为下游功能分析中稳定的细胞间连接的一部分),使其适合于研究突触分子。
以人神经干细胞条件培养液为诱导剂,与维甲酸联合诱导SH-SY5Y细胞向神经元分化,SH-SY5Y细胞在3 d内就足以产生神经元,显著缩短了SH-SY5Y细胞产生神经元分化所需的时间,而且能显著提高SH-SY5Y细胞中神经元的比例。利用与基质细胞系PA6的共培养系统可以更容易,更快速地诱导SH-SY5Y细胞分化为与成熟原代神经元非常接近的特性,这种分化加快了速度,缩短了时间,能够获得足够分化的细胞以供实验使用。
人神经母细胞瘤细胞系SH-SY5Y是研究神经退行性疾病的常用细胞系。神经分化的SH-SY5Y细胞表达神经元特异性标志物,更适用于帕金森病、阿尔茨海默病等的生化、毒理学研究。
帕金森病的特征是黑质多巴胺能神经元的死亡,鱼藤酮、1-甲基-4苯基-1,2,3,6-四氢吡啶( MPTP)和6-羟基多巴胺等毒素可引发与运动和行为改变相关的黑质多巴胺能神经元死亡,被广泛应用于帕金森病实验模型。
SH-SY5Y细胞的未分化和分化两种形式都被广泛应用于帕金森病的研究,但是哪种细胞是最合适的模型仍在争论中。通过比较未分化的SH-SY5Y细胞和分化的SH-SY5Y细胞的大量神经元标志物,以及对帕金森病神经毒素1-甲基-4苯基-吡啶离子和6-羟基多巴胺的反应性,Cheung等发现未分化的SH-SY5Y细胞在维甲酸分化后多巴胺能特性没有改变,但对帕金森神经毒素的敏感性降低,因此认为未分化的SH-SY5Y细胞可能更适合作为实验性帕金森病研究的模型。
而Lopes等将SH-SY5Y细胞维甲酸分化后,分化细胞在分化后第4天、第7天和第10天中神经元标志物酪氨酸羟化酶、神经元特异性烯醇化酶和神经元核蛋白的免疫含量明显高于未分化细胞,在分化的第7天和第10天,对神经毒素6-羟基多巴胺的敏感性增加,因此认为第7天维甲酸分化的SH-SY5Y细胞是研究帕金森病病理生理基础的分子和细胞机制的更合适的实验模型。
1-甲基-4苯基-吡啶离子或鱼藤酮诱导的毒性机制取决于不同的分化细胞类型,应用维甲酸、佛波酯12-肉豆蔻13-醋酸酯和脑源性神经营养因子诱导SH-SY5Y细胞分别分化为胆碱能乙酰胆碱转移酶(ChAT)阳性表型及多巴胺能TH阳性表型。
氧化应激在多巴胺能表型中占主导地位,而炎症介质在胆碱能表型中占主导地位,两种分化细胞在暴露于线粒体毒素的情况下都表现出钙蛋白酶的激活。有研究者认为,维甲酸处理SH-SY5Y细胞诱导促进一般神经元样表型和主要多巴胺能特征的分化程序。维甲酸分化的SH-SY5Y细胞能够摄取1-甲基-4苯基-吡啶离子,很可能是通过多巴胺和去甲肾上腺素转运蛋白,其模仿体内多巴胺能神经元摄取1-甲基-4苯基-吡啶离子,因此,检测1-甲基-4苯基-吡啶离子在维甲酸分化的神经元样细胞中的作用,可能会更准确地模拟帕金森病脑中多巴胺能神经元的线粒体功能障碍。
而另有研究者认为,维甲酸+TPA诱导分化的SH-SY5Y细胞表现出更明显的多巴胺能表型,表现出与体内多巴胺神经元相似的1-甲基-4苯基-吡啶离子毒性特征。与维甲酸+TPA分化细胞相比,维甲酸分化细胞对多巴胺的摄取明显减少,对1-甲基-4苯基-吡啶离子的毒性不敏感,且对1-甲基-4苯基-吡啶离子的毒性不受多巴胺转运蛋白阻滞剂的抑制。维甲酸+TPA分化的SH-SY5Y细胞为探索1-甲基-4苯基-吡啶离子引起的细胞死亡机制提供了一种更可行的模型。分化的SH-SY5Y细胞暴露于低剂量鱼藤酮模型模拟了早期帕金森病的变化,可能有助于筛选该疾病阶段的神经保护疗法,特别是那些可能防止突起回缩和路易神经突起形成的初始病理的疗法。
α-突触核蛋白是帕金森病的主要成分。α-突触核蛋白可以与多巴胺转运蛋白相互作用,减少底物摄取,调节多巴胺传递,从而影响神经元功能。过表达的α-突触核蛋白可以形成α-突触核蛋白聚集体,诱导SH-SY5Y细胞的细胞毒性和凋亡。在亚铁存在的情况下,维甲酸和脑源性神经营养因子诱导神经元分化促进胞浆内α-突触核蛋白阳性包涵体的形成,这些包涵体与人路易体有相同的基本免疫病理特征。Song等设计了表达人突变型A53T α-突触核蛋白的质粒转染SH-SY5Y细胞,证明了作为研究帕金森病突触核蛋白异常聚集的细胞模型,SH-SY5Y细胞中类似突触核蛋白异常调节通路的完整性。Vasquez等建立并鉴定了一个含有Tet-on SNCA cDNA盒的SH-SY5Y细胞系,它不仅避免了高水平的α-突触核蛋白对分化的不利影响,而且允许在神经元分化之前/之后有控制的、有条件的和可重复的α-突触核蛋白的过度表达,与其他常规使用的细胞模型相比,这种可诱导的神经细胞系为帕金森病和其他帕金森病样突触病变提供了一个可靠和更相关的细胞模型。Pantazopoulou等研究了在诱导表达人α-突触核蛋白神经分化的SH-SY5Y神经母细胞瘤细胞中,重组α-突触核蛋白预制纤维(PFF)诱导α-突触核蛋白组装的周转。这一成熟的细胞模型可以被证明是评估α-突触核蛋白组件的聚集和周转以及不同翻译后修饰(即磷酸化、泛素化、截断、磺酰化)的作用及其对寡聚化的影响的重要工具,并可以进一步筛选影响α-突触核蛋白聚集、清除、分泌和细胞间传递的修饰物。
阿尔茨海默病的特点是认知功能减退,并伴有胆碱能神经元的特定变性。组织学上,阿尔茨海默病的主要病理特征有2个:神经纤维缠结和淀粉样蛋白-β的细胞外沉积。阿尔茨海默病体外模型的一个重要特征是基于表达阿尔茨海默病相关基因的人胆碱能神经元的产生,形成tau磷酸化及淀粉样蛋白-β沉积病理生理学相似的体外模型有助于研究阿尔茨海默病疾病机制及筛选神经保护药物等。
维甲酸分化后,SH-SY5Y细胞获得了胆碱能样表型,适合作为研究淀粉样蛋白-β暴露对胆碱能影响的细胞模型。在维甲酸+脑源性神经营养因子处理的细胞中,我们观察到胆碱能标志物的高表达和酶活性。联合使用亚致死剂量的冈田酸和可溶性淀粉样蛋白-β寡聚体处理分化的SH-SY5Y细胞,提供了一种与最初受阿尔茨海默病影响的胆碱能神经元的病理生理学相似的体外模型。二丁酰环磷腺苷对去甲肾上腺素能表型的处理和维甲酸+脑源性神经营养因子对胆碱能表型的处理增加了细胞对淀粉样蛋白-β42毒性的易感性,二丁酰环磷腺苷分化和维甲酸+脑源性神经营养因子分化的SH-SH5Y细胞可能为进一步研究淀粉样蛋白-β的毒性机制以及筛选保护神经细胞免受淀粉样蛋白-β毒性作用的化合物提供依据。
维甲酸+TPA分化的多巴胺能SH-SY5Y细胞具有对淀粉样蛋白-β介导的毒性具有高度抗性的特点,维甲酸+TPA分化细胞可用于揭示淀粉样蛋白-β耐受的机制,有助于更好地理解阿尔茨海默病的神经退行性变和神经保护作用。闫宇辉等采用APP基因转染SH-SY5Y细胞模拟 淀粉样蛋白-β沉积致阿尔茨海默病的细胞模型,进而探究药物的神经保护作用。
在维甲酸+脑源性神经营养因子分化的SH-SY5Y细胞中,tau的含量和磷酸化状态均增加,这与形态学上明显的突起生长一致。维甲酸+脑源性神经营养因子分化的SH-SY5Y细胞可作为研究tau磷酸化机制和筛选潜在的GSK3β抑制剂的合适模型。Agholme等将SH-SY5Y 细胞用维甲酸预处理,然后在培养基中加入脑源性神经营养因子、神经调节蛋白、神经生长因子和VitD3的细胞外基质凝胶培养分化为神经元样细胞,显示出成熟神经元的形态和生化特征,tau的表达水平与成人大脑相当,这种细胞体外模型可用于阿尔茨海默病的研究。
小结
SH-SY5Y细胞来源于人骨髓,是神经母细胞瘤细胞系的亚克隆,通过不同的分化方法可以使SH-SY5Y细胞分化为更成熟的神经元样表型,表现出一系列极具指导性的神经生物学特性,从而促进对神经元细胞和分子机制的研究。
SH-SY5Y细胞广泛应用于神经退行性疾病的实验研究,不同的分化导致细胞代谢和特定神经元特征的差异,因此,不同的分化方案可使SH-SY5Y细胞表达不同的神经元表型,且能让SH-SY5Y细胞应用于不同疾病病理生理机制研究的优点和局限性表现出来,选择分化方案显得至关重要。
另外,基因方法也应用于SH-SY5Y细胞的功能研究中,以靶向与疾病相关的一种或多种途径。这些对不同的分化SH-SY5Y细胞模型的正确利用将更有利于神经退行性疾病的病理机制及疾病的药物治疗研究。
用于PARP-1依赖性程序性细胞死亡(Parthanatos)在布比卡因致SH-SY5Y细胞损伤中作用的研究
应用SH-SY5Y细胞培养技术,通过检测细胞内PARP-1的表达、PAR含量变化及细胞内NAD+水平的变化,初步明确布比卡因所致的神经毒性中是否存在Parthanatos;同时通过外源性NAD对布比卡因所致的细胞内ROS含量增加、线粒体膜电位降低、细胞核损伤及细胞凋亡的影响,确定外源性NAD是否有助于减轻布比卡因的神经毒性。
其目的在于从新的角度探讨在布比卡因神经毒性的机制,为临床上防治局麻药的神经毒性提供实验依据。第1章布比卡因神经毒性是否与多聚腺嘌呤二核苷酸核糖聚合酶-1(Poly(ADP-ribose)polymerase-1,PARP-1)激活有关目的明确布比卡因是否导致SH-SY5Y细胞PARP-1激活,其神经毒性是否与激活PARP-1有关。
方法以1-10mM布比卡因培养液处理SH-SY5Y细胞30分钟-6小时,以Western-blot法检测细胞内PARP-1及其代谢产物-多聚腺苷二磷酸核糖(Poly-(ADP)ribose,PAR)的表达情况;以100nM、200nM的PARP-1抑制剂-PJ34培养液与5mM布比卡因培养液共同处理细胞30分钟,或单独以5mM布比卡因处理细胞30分钟,光镜下观察其对布比卡因所致细胞形态改变的影响,并以CCK-8法其对细胞存活率的影响。
计量资料以均数±标准差(x±s)表示,采用SPSS17.0统计软件分析。不同浓度布比卡因处理30分钟后细胞内PARP-1及PAR的表达、1mM布比卡因处理0-6小时后细胞内PAPR-1及PAR的表达采用完全随机单因素方差分析,组间比较采用LSD法(方差齐)或Dunnett’s T3法(方差不齐);PJ34对布比卡因处理后细胞存活率的影响采用两因素析因设计资料方差分析,组间比较采用LSD法(方差齐)或Dunnett’s T3法(方差不齐)。
[1]Glutathione synthesis and its role in redox signaling[J].Hongqiao Zhang,Henry Jay Forman.Seminars in Cell and Developmental Biology.2012(7)
[2]Bupivacaine induces apoptosis via mitochondria and p38 MAPK dependent pathways[J].Jun Lu,Shi yuan Xu,Qing guo Zhang,Rui Xu,Hong yi Lei.European Journal of Pharmacology.2011(1)
[3]Ropivacaine Versus Bupivacaine for Epidural Labor Analgesia[J].Yaakov Beilin,Stephen Halpern.Anesthesia&Analgesia.2010(2)
[4]PARP inhibitors:New tools to protect from inflammation[J].Vincenzo Giansanti,Francesca Donà,Micol Tillhon,A.Ivana Scovassi.Biochemical Pharmacology.2010(12)
[5]郑艇.PARP-1依赖性程序性细胞死亡(Parthanatos)在布比卡因致SH-SY5Y细胞损伤中作用的研究[D].南方医科大学,2014.
Ross RA, et al. Coordinate morphological and biochemical interconversion of human neuroblastoma cells. J. Natl. Cancer Inst. 71: 741-749, 1983. PubMed: 6137586
Biedler JL, et al. Multiple neurotransmitter synthesis by human neuroblastoma cell lines and clones. Cancer Res. 38: 3751-3757, 1978. PubMed: 29704
Ross RA, et al. Coordinate morphological and biochemical interconversion of human neuroblastoma cells. J. Natl. Cancer Inst. 71: 741-749, 1983. PubMed: 6137586
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000