常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2024-07-04 11:01:53 细胞资源库平台 访问量:627
786-O细胞源自一个原发性透明细胞癌。此细胞有微绒毛和桥粒,能在软琼脂是生长。 此细胞生成的一个PTH样的多肽与乳癌和肺癌中的肽相似。这个多肽的N端与PTH相似,活性与PTH相似,分子量为6000道尔。786-O细胞可以用于3D细胞培养,也是一种合适的转染宿主。
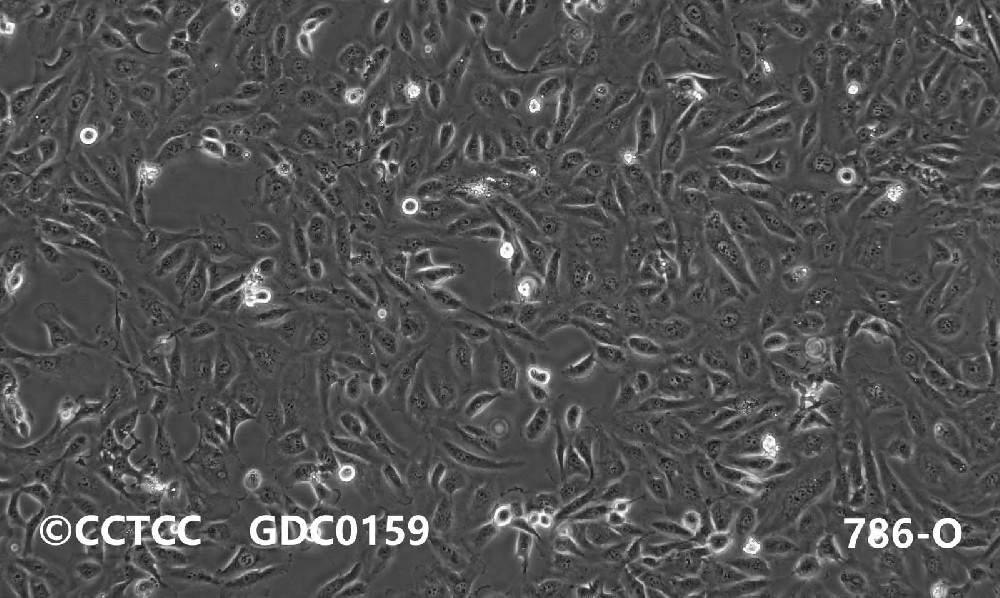
细胞名称:786-O,人肾透明细胞腺癌细胞
细胞别称:786-o; 786O; 786-0; 786.O; 786-O RCC; RCC 786-O; RCC_7860; RCC 7860; 7860; 786-0WT;人肾透明细胞腺癌细胞
种属来源:人
年龄性别:男;58岁
组织来源:肾;肾细胞腺癌
生长特性:贴壁生长
细胞形态:上皮细胞样
STR位点信息:Amelogenin:X,Y;CSF1PO:10;D13S317:8;D16S539:12;D18S51:13,14;D19S433:14,15;D21S11:29,30;D2S1338:17,18;D3S1358:16;D5S818:9;D7S820:11;D8S1179:13;FGA:24;TH01:6,9.3;TPOX:8,11;vWA:15,17;
保藏机构:ATCC; CRL-1932 BCRC; 60243;中国医学科学院基础医学研究所细胞资源中心
培养基:1640+10%FBS+PS
培养条件:气相:95%空气+5%二氧化碳;温度:37℃
倍增时间:~24-45 hours
致瘤性:Yes, in immunosuppressed hamsters.
冻存条件:无血清冻存液,液氮储存
实验室条件
1. 无菌环境:无菌室包括更衣室,缓冲间,风淋间,操作间
2. 仪器设备:超净工作台-操作平台、CO2 培养箱-细胞生长的环境、倒置显微镜-观察细胞、离心机-离心收集细胞、冰箱-放置培养基等试剂、水浴锅-复苏细胞、真空泵-收集废液、灭菌锅-灭菌、干燥箱-烘干器材、液氮罐-冻存细胞、纯水仪-制备一级水
器材耗材:玻璃瓶、培养瓶、培养皿、巴士管、离心管、移液枪、枪头(白色 0-10ul;黄色 20-200ul;蓝色 100-1000ul)、滤器,吸管,多孔培养皿、6cm 皿、10cm 皿,培养瓶等。
4. 试剂:1640基础培养基、FBS胎牛血清、双抗、胰酶(0.25%Trypsin-0.02% EDTA)、pbs
操作者工作范畴
1. 无菌操作:洗手,戴手套,穿实验服,常喷 75%酒精
1.准备:紫外线照台 30min,提前打开水浴锅设置 37℃,培养基临用前放水浴箱里温育20 分钟(或者放在超净工作台常温放 30min)。在操作台上摆放好物品,左边放完全培养液,1mL 枪头(已灭菌),培养皿,右上角放废液缸,1mL 移液枪,3mL 巴氏管。检查离心机,废液泵。
2)待水浴锅温度达到 37℃时,戴上手套和护目镜,从-196℃液氮罐中取出冻存管,将含有1 mL细胞悬液的冻存管在 37℃水浴中迅速摇晃解冻,同时不断轻轻摇动冻存管,尽量保证冻存管内细胞 1min 内融化,加4 mL培养基混合均匀, 移入离心机中 100rpm 离心 3min,以 75%酒精喷冻存管外部,移入无菌操作台内。
3)用 3mL 巴氏管取 5mL 新鲜培养基到一个新的 6cm 培养皿中,(若离心后细胞量较多,可取 12mL 新鲜培养基到一个新的 10cm 培养皿中),标记日期、所用培养基名称和细胞名称。
4)用废液泵(吸力不要太大)取一个黄色枪头从冻存管中吸走上清,取 1mL 新鲜培养基重悬细胞后(充分混匀),将细胞悬液加入到培养皿中,将培养皿在超净工作台上以画“8”字法铺匀细胞(一般培养皿在台子上画 30 个 8 字即可铺匀),最后在显微镜下检测是否铺匀细胞。
5)确定细胞已铺匀后,再把培养皿放入 CO2 培养箱过夜。(尽量平直放入不要晃动),第二天换液并检查细胞密度。
1) 准备工作:紫外线照台 30min,准备好786-O细胞培养所需试剂物品:培养液,胰酶,PBS(试剂提前拿出 37℃预热或者常温放置半小时以上);传代用培养皿,巴士管,离心管(已灭菌),枪头(已灭菌),移液枪,废液缸。检查离心机,废液泵;
2)从培养箱拿出细胞,在显微镜下观察786-O细胞密度和细胞状态,当细胞状态良好,且密度达到 85%左右的时候即可进行传代;
4)打开废液泵,用废液泵吸头(吸力不要太大)取一个蓝色枪头吸走上清废液,用巴士管取 4ml 不含钙、镁离子的1xPBS(6cm 皿)到细胞培养皿中(若是 10cm 皿则取 8ml 1xPBS),轻轻晃动以清洗细胞表面1-2次;
5)用废液泵吸走 PBS 废液,加1 mL消化液(0.25%Trypsin-0.02% EDTA)于培养瓶中,拿起培养皿轻轻转动以便胰酶浸泡到每个细胞,消化 1-3min(根据细胞贴壁情况判断,贴壁较牢的消化时间长一点或者放入 CO2 培养箱中消化几分钟)后,在显微镜下观察细胞是否变圆变亮,一旦发现大量细胞胞质回缩,细胞间隙增大,即将脱离培养皿底,迅速拿回操作台,轻敲几下培养瓶后加少量培养基终止消化。
6)用 1ml 移液枪轻柔吹打,保证培养皿底的每个角落都吹打到,边缘处也不能忽略(吹打时尽量避免产生气泡,因其对细胞有伤害;需轻柔吹打,用力吹打对细胞也有伤害),把培养瓶中所有细胞悬液用吸 1ml 移液枪移入无菌离心管中。
7)将装有786-O细胞悬液的离心管放入离心机中(配平),1000 转离心 3-5min,用废液泵取一个黄色枪头从冻存管中吸走上清,取 1-2mL 新鲜培养基重悬细胞后(充分混匀),将细胞悬液按1:2比例分到新的含8 mL培养基的新皿中或者瓶中,将培养皿在超净工作台上以画“8”字法铺匀细胞(一般培养皿在台子上画 30 个 8 字即可铺匀),最后在显微镜下检测是否铺匀细胞。
8) 确定786-O细胞已铺匀后,再把培养皿放入 CO2 培养箱培养。(尽量平直放入不要晃动)。第二天再观察细胞密度。
1) 准备工作:紫外线照台 30min,准备好细胞培养所需试剂物品:培养液,胰酶,PBS(试剂提前拿出 37℃预热或者常温放置半小时以上);传代用培养皿,巴士管,离心管(已灭菌),枪头(已灭菌),移液枪,废液缸。检查离心机,废液泵;
2)从培养箱拿出细胞,在显微镜下观察细胞密度和细胞状态,待细胞生长状态良好且存活率高的状态下,细胞密度达 80–90%时,可进行细胞冻存操作,以T25 瓶为例
a.收集细胞及细胞培养液,将培养瓶内所有培养基转入无菌离心管,装入无菌离心管中,1000 rpm条件下离心4 min,弃去上清液,用PBS清洗一遍,弃尽PBS,进行细胞计数。
b.根据细胞数量加入无血清细胞冻存液,使细胞密度5×106~1×107/mL,轻轻混匀,每支冻存管冻存1mL细胞悬液, 在细胞冻存管上贴上细胞标签(细胞标签上包含:细胞名称、冻存日期、培养用的 培养基)。
c.将冻存管入库到-80 度冻存盒里,放置 24 小时后,即可移入液氮中保存,标记好入库位置和冻存日期。
显微镜下见786-O细胞,呈多角形或长梭形,贴壁生长,每3天传代1次。以1:4比例传代,细胞生长非常快,适时进行换液,细胞密度过大时有部分细胞漂浮。
786-O细胞株对生长环境要求不是很高,培养难度不大,37℃、5%CO2、95%饱和湿度的孵箱中常规培养,RP-MI1640 培养基加10%胎牛血清或新生牛血清均可。消化细胞时,应在显微镜下观察,大部分细胞变圆时停止消化,以免消化过度对细胞造成损伤。细胞传代可按1:4至1:12比例进行,传代细胞数量多则生长较快,根据具体情况传代比例可在此范围内进行调整。需要注意的是,培养任何细胞操作过程都必须做到无菌原则。所以,一般都在培养基里加青霉素、链霉素(均为100U/mL),可在一定程度避免细菌污染;另外,还要注意防止空气中的霉菌污染。一般来讲,细胞受到污染,培养基会过早变得偏碱性,颜色由原来的红色变为金黄色,显微镜下可见大量的细菌,并且有活跃的运动;简便的处理办法是彻底销毁受污染的细胞,查清任何可能受污染的环节,并做相应的处理。除此以外,也应注意防止受到实验室里的Hela细胞污染。鉴别方法有两点:首先786-O细胞的染色体特征同Hela细胞的不同,尤其是Y染色体;其次是酶学上的不同,786-O细胞所含的葡萄糖6磷酸脱氢酶(G6PD)为B型,而后者为A型。786-O细胞在体外被稳定地传代培养,是一株良好的实验细胞模型。首先因为种属是人,实验研究可最大限度地接近人体实验。另外,由于培养特性稳定,使得科研人员精确地复制实验条件成为可能。
786-O是来源于人的肾癌细胞系,经皮下成瘤检测实验表明该细胞系在皮下接种后,能正常成瘤。
为验证 786-O 细胞系能否实现皮下成瘤,我们设计了在 M-NSG 小鼠右侧腋下接种一定量的 786-O 细胞,其成瘤结果说明:在皮下接种 786-O 细胞系能正常成瘤。如图二所示:
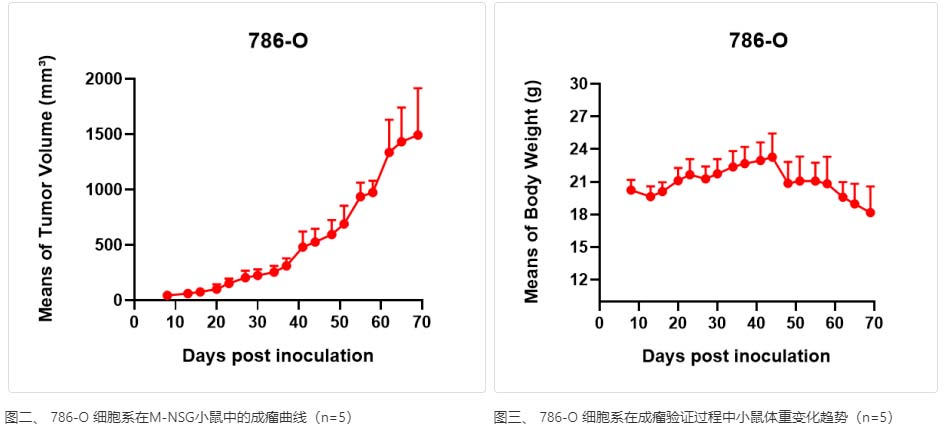
图二、 786-O 细胞系在M-NSG小鼠中的成瘤曲线(n=5)
小鼠体重变化曲线
在验证 786-O 细胞系成瘤性的同时,为了从体重方面检测该细胞系对小鼠是否有负面影响,我们也持续监测了小鼠的体重情况,从结果来看,小鼠在整个成瘤过程中,整体体重呈先增长后下降趋势,但小鼠精神状态无明显异常,期体重变化趋势如图三所示:
图三、 786-O 细胞系在成瘤验证过程中小鼠体重变化趋势(n=5)
786-O/786-0/人肾透明细胞腺癌细胞主要用于科研实验研究,如有实验探讨PI3K-Akt信号通路PI3K抑制剂LY294002对786-O/786-0/人肾透明细胞腺癌细胞增殖和凋亡的影响。采用MTT法检测LY294002对786-O/786-0/人肾透明细胞腺癌细胞增殖能力的影响,倒置显微镜观察不同浓度及时间点处理LY294002对786-O/786-0/人肾透明细胞腺癌细胞形态的影响,Hochest染色检测其对786-O/786-0/人肾透明细胞腺癌细胞凋亡的影响。MTT结果显示LY294002对细胞增殖表现出显著抑制(P0.05或P0.01,vs阴性),并表现为药物剂量和时间的依赖性,形态学显示,相对于正常细胞,LY294002可以使细胞生长受到不同程度的抑制,表现为体积缩小,突起变少等现象,Hochest染色结果显示,随着LY294002浓度的加大,细胞逐渐出现染色质凝聚,出现凋亡小体进而完成凋亡。结论PI3K抑制剂LY294002可明显抑制786-O/786-0/人肾透明细胞腺癌细胞增殖,促进786-0细胞凋亡,并且呈现浓度依赖性变化。
人肾透明细胞腺癌细胞可以用于LY294002抑制PI3K/AKT信号通路对人肾透明细胞腺癌细胞增殖和凋亡的影响
应用PI3K高特异抑制剂2-(4-吗啉基)-8-苯基-4氢-1-苯并吡喃-4-酮(LY294002)作用于人肾透明细胞癌786-0细胞系,探讨LY294002对人肾透明细胞癌细胞凋亡的影响及机制,从而为其临床治疗的研究奠定基础。
方法:
(1)人肾透明细胞癌786-0细胞系培养,建立细胞模型。
(2)将对数生长期的肾透明细胞癌细胞分组培养。用不同药物浓度的LY294002(5μg/mL,10μg/mL,20μg/mL,40μg/mL)处理肾透明细胞癌细胞,MTT法检测癌细胞在不同的作用时间(24h、48h、72h)下的OD值,计算增殖抑制率,绘制肾癌细胞浓度-抑制率曲线及时间-抑制率曲线。用Hoechst染色法观察肾透明细胞癌细胞,经LY294002(5μg/mL,10μg/mL,20μg/mL,40μg/mL)不同的作用时间(24h、48h、72h)下,细胞凋亡情况。
(3)采用RT-PCR法分别检测LY294002在不同浓度及时间点对786-O细胞处理后细胞的PI3K、mTOR、Akt mRNA的表达情况,探讨其对PI3K、mTOR、Akt mRNA表达的影响,及其对786-O细胞增殖的影响。
结果
(1)通过MTT法检测LY294002在24、48、72h均表现出增殖抑制作用,当LY294002浓度从1μg/mL增加到40μg/mL时,作用24h细胞抑制率从6%增加到55%,作用48h时,细胞抑制率从12%增加到78%,作用72h时细胞抑制率从14%增加到84%,同一时间不同浓度的各组细胞与阴性对照组相比,抑制率有统计学意义(P<0.05或0.01),提示随着LY294002浓度的增加,其抑制786-O细胞增殖的作用逐渐增加。用倒置显微镜下观察LY294002用药对786-O细胞生长及形态的影响,各浓度LY294002作用48h时细胞形态变化最为典型。结果显示,相对于正常细胞,LY294002可以令细胞生长受到不同程度的抑制,表现出浓度依赖性变化。正常细胞的形态整齐,边缘清晰,细胞排列紧密,而随药物浓度的增加,药物作用下细胞变圆漂浮无法正常贴壁,细胞固缩,细胞密度减少。
(2)通过Hoechst染色法在荧光显微镜下观察对照组细胞核呈弥散均匀淡蓝色的荧光;出现细胞凋亡时,细胞核或细胞质内可见浓染致密的颗粒块状亮蓝色荧光;相对于未经药物处理的786-0细胞,1μg/mL的药物处理48h后,细胞形态还未出现明显的变化;2.5μg/mL药物处理可见个别细胞内出现染色质凝聚,出现凋亡小体;5μg/mL药物处理染色质荧光增强,出现凋亡小体的细胞增多;10μg/mL药物处理可见凋亡前期的细胞进一步增多;20μg/mL药物处理可见凋亡小体突破细胞膜开始释放;40μg/mL药物处理可见大部分细胞凋亡小体释放,完成凋亡。
(3)在LY294002处理细胞48h,采用1、2.5、5、10、20、30、40μg/mL浓度处理下,PI3K、Akt、mTOR mRNA的表达显著受到抑制,并且呈现出随药物浓度的变化出现抑制程度增大的正比关系;细胞增殖实验显示随着药物浓度及其作用时间的延长,其抑制肿瘤作用逐渐增加。
786o 细胞系是一种来源于人类的肿瘤细胞系,常用于肿瘤研究和药物筛选。在实验室中,研究人员需要通过调整细胞密度来控制细胞系的生长,这就涉及到一个重要的参数:moi。
moi,即细胞密度的倒数,是衡量细胞生长状态的重要指标。在细胞培养过程中,moi的范围会直接影响到细胞的生长状态和实验结果。对于786o细胞系,其moi范围通常在0.1-10 之间。当 moi过低时,细胞密度过大,细胞之间的竞争激烈,容易导致细胞死亡。而当moi过高时,细胞密度过低,细胞生长缓慢,会影响实验的进度和结果。因此,选择合适的moi范围对于 7860细胞系的生长至关重要。研究发现,对于7860细胞系,最适合的moi 范围在1-5之间。在这个范围内,细胞生长迅速,且细胞状态稳定,适合进行各种实验。总的来说,moi是控制细胞系生长的重要参数,对于7860细胞系,其最适合的moi范围在1-5之间。
Williams RD, et al. In vitro cultivation of human renal cell cancer. I. Establishment of cells in culture. In Vitro 12: 623-627, 1976. PubMed: 1010528
Williams RD, et al. In vitro cultivation of human renal cell cancer. II. Characterization of cell lines. In Vitro 14: 779-786, 1978. PubMed: 721102
Thiede MA, et al. Human renal carcinoma expresses two messages encoding a parathyroid hormone-like peptide: evidence for the alternative splicing of a single- copy gene. Proc. Natl. Acad. Sci. USA 85: 4605-4609, 1988. PubMed: 3290897
MacKay K, et al. Glomerular epithelial, mesangial, and endothelial cell lines from transgenic mice. Kidney Int. 33: 677-684, 1988. PubMed: 2835539
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000