常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2026-02-15 09:00:00 细胞资源库平台 访问量:10
原发性开角型青光眼(POAG)是不可逆失明的首要原因,系统性红斑狼疮(SLE)患者发生 POAG 的风险显著升高(相对风险 RR=9.01),但两者关联的分子机制尚不明确。中南大学湘雅医院团队在《iMetaOmics》上发表题为Novel insights into immunopathogenesis and crucial biomarkers between primary open‐angle glaucoma and systemic lupus erythematosus的研究:通过整合 GEO 数据库 3 个数据集(POAG 的 GSE27276、SLE 的 GSE50772、小梁网单细胞数据 GSE148371),结合差异表达分析(DEA)、加权基因共表达网络分析(WGCNA)、机器学习(LASSO+SVM-RFE)、免疫浸润、单细胞转录组及分子对接,筛选出 5 个共有的核心生物标志物(LAMB3、MGP、NFKBIA、CSRNP1、FRZB),发现两者均存在巨噬细胞、T/B 细胞等免疫细胞浸润,且预测去氢鱼藤素(deguelin)、小檗胺(berbamine)、蛇床子素(osthole)3 种药物可靶向这些标志物;RT-qPCR 在人小梁网干细胞中验证了标志物的表达趋势,为 SLE 相关 POAG 的免疫机制解析与靶向治疗提供新依据。
实验背景
POAG 与 SLE 均与免疫炎症相关,SLE 患者 POAG 发病风险显著升高,但两者共同的发病机制及生物标志物尚未明确,现有研究缺乏对两者免疫关联的系统解析,亟需寻找共有的诊断标志物与潜在治疗药物。
实验方法
基于 GEO 数据集(POAG:17 例患者 + 19 例对照;SLE:61 例患者 + 20 例对照),通过 DEA 筛选差异表达基因(DEGs),WGCNA 构建共表达网络筛选疾病相关模块,交集获得 10 个关键基因;用 LASSO 回归与 SVM-RFE 机器学习筛选核心生物标志物;通过 GO/KEGG 富集分析解析功能通路,免疫浸润分析(ssGSEA、CIBERSORT)评估免疫细胞关联,单细胞转录组分析标志物在小梁网细胞中的分布;分子对接预测靶向药物,RT-qPCR 在人小梁网干细胞中验证标志物表达。
实验结果
筛选出 5 个核心生物标志物(LAMB3 下调,MGP、FRZB、CSRNP1 上调,NFKBIA 下调),均富集于免疫炎症通路(PD-1/PD-L1、NF-κB、Wnt);POAG 与 SLE 均存在巨噬细胞、T/B 细胞浸润增加,且标志物与 Th17 细胞、调节性 T 细胞显著相关;分子对接显示 deguelin、berbamine、osthole 与标志物结合亲和力强(<-6 kcal/mol);RT-qPCR 验证了标志物在氧化应激诱导的小梁网细胞模型中的表达趋势。
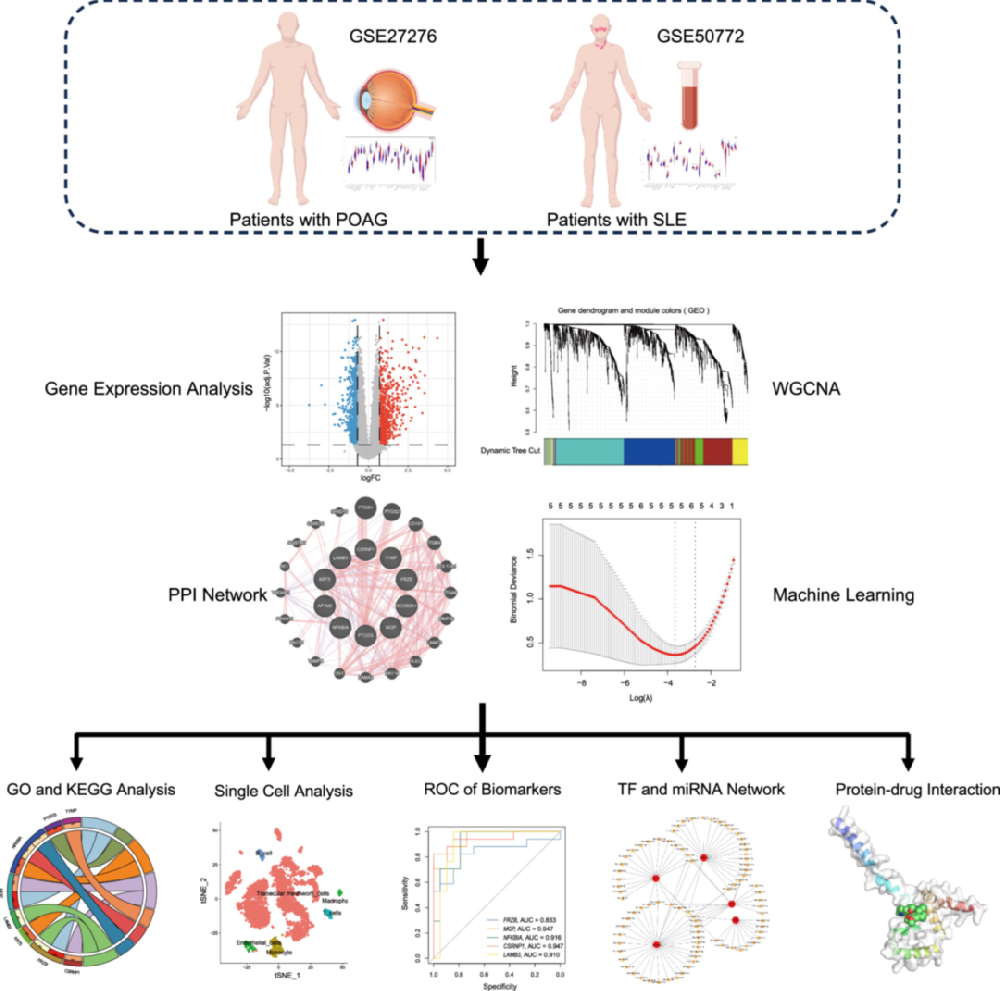
数据来源与预处理:从 GEO 数据库获取 3 个数据集 ——POAG 的 GSE27276(人小梁网组织,17 例患者 + 19 例对照)、SLE 的 GSE50772(血液样本,61 例患者 + 20 例对照)、POAG 小梁网单细胞数据 GSE148371(6 例患者);用 R 包 “Limma” 进行差异表达分析,筛选标准为 | log2FC|>1 且调整后 p<0.05,“pheatmap” 绘制热图,“Venn” 构建交集图。
WGCNA 构建共表达网络:用 R 包 “WGCNA” 对 POAG 和 SLE 数据集分别构建网络,计算基因相关性后聚类为模块,通过模块与疾病表型的相关性(POAG:MEturquoise 模块,Cor=0.72;SLE:MEblue 模块,Cor=0.67)筛选关键模块基因,与 DEGs 交集获得 10 个关键基因。
生物标志物筛选与验证:用 R 包 “glmnet” 进行 LASSO 回归(lambda 最小值对应 5 个基因),“e1071” 进行 SVM-RFE(筛选 8 个基因),取交集获得 5 个核心标志物;绘制 ROC 曲线评估诊断价值(AUC 均 > 0.78);培养人小梁网干细胞,用 400μM H₂O₂构建氧化应激模型(细胞活力下降 50%),RT-qPCR 验证标志物 mRNA 表达(引物序列见表 1)。
功能与调控网络分析:用 R 包 “clusterProfiler” 进行 GO/KEGG 富集分析(聚焦免疫、炎症通路);“STRING” 构建 PPI 网络(置信度 > 0.4);“NetworkAnalyst” 平台基于 miRTarBase 和 JASPAR 数据库,构建 miRNA(84 个)和转录因子(34 个)调控网络,“Cytoscape” 可视化。
免疫浸润与单细胞分析:用 R 包 “GSVA” 进行 ssGSEA 分析,评估 POAG 与 SLE 的免疫细胞浸润差异;“CIBERSORT” 分析标志物与免疫细胞的相关性;单细胞数据用 “Seurat” 聚类(17 个簇注释为 6 类细胞),“celldex” 标注细胞亚型,“ggplot2” 绘制小提琴图与散点图展示标志物分布。
分子对接:从 Uniprot 获取标志物蛋白结构,PubChem 获取 10 种潜在药物(源自 DSigDB 数据库)结构;用 Open Babel 转换格式,AutoDock Vina 进行半柔性对接(50 次对接,结合能 <-6 kcal/mol 为有效),PyMOL 与 Discovery Studio 可视化结合位点。
统计分析:用 R 4.3.1 和 GraphPad Prism 9 进行分析,计量资料以 “均值 ±SEM” 表示,两组用 t 检验,多组用 ANOVA+Dunnett 校正,p<0.05 为显著。
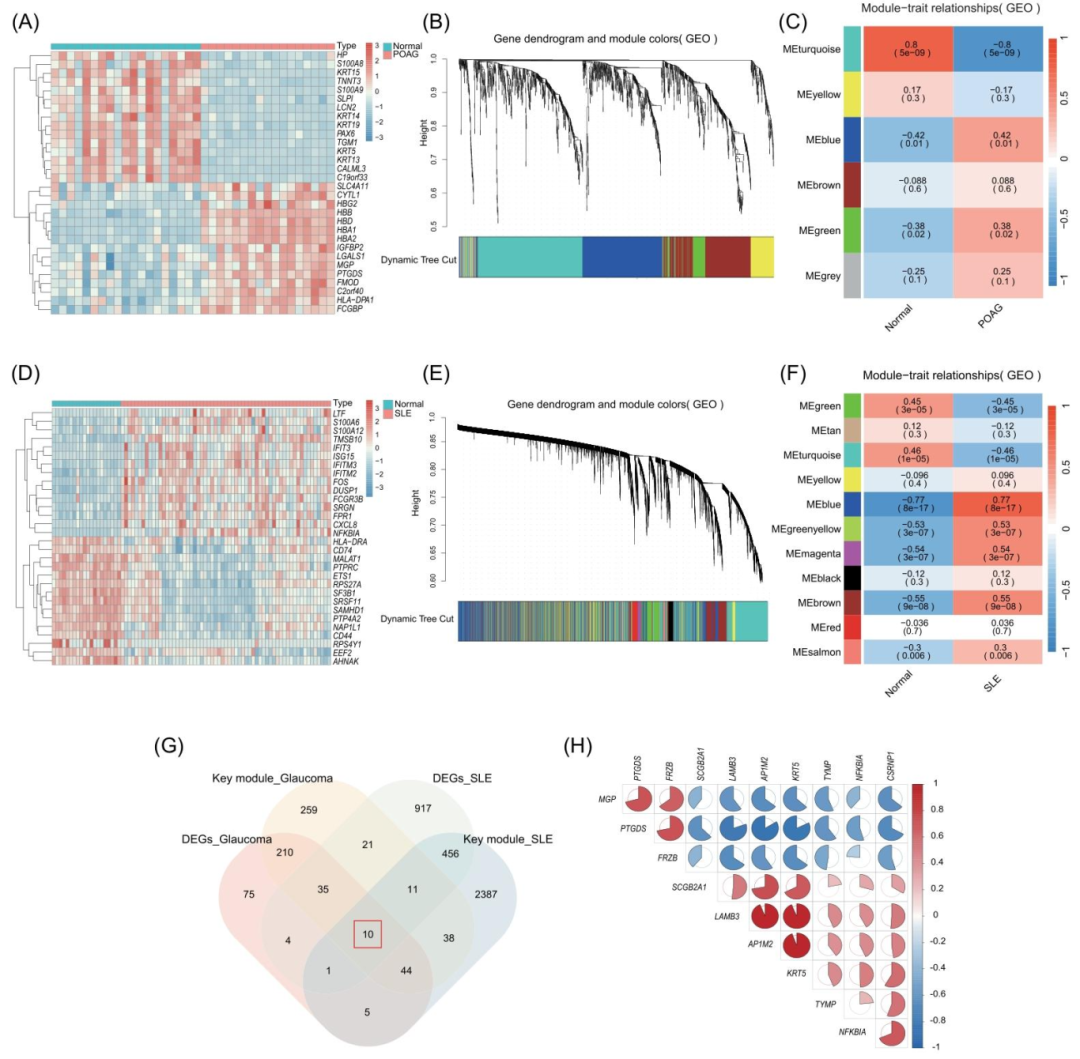
图1:POAG 与 SLE 的 DEG 筛选及 WGCNA 分析
POAG 数据集筛选出 384 个 DEGs(上调 192 个,下调 192 个),SLE 数据集筛选出 1455 个 DEGs(上调 721 个,下调 734 个);WGCNA 将 POAG 基因聚类为 6 个模块,MEturquoise 模块(628 个基因)与 POAG 相关性最强(Cor=0.72,p<0.001),SLE 基因聚类为 11 个模块,MEblue 模块(2952 个基因)与 SLE 相关性最强(Cor=0.67,p<0.001);10 个关键基因(LAMB3、MGP、NFKBIA 等)为 DEGs 与关键模块基因的交集,相关性热图显示基因间存在强正相关(r>0.6)。
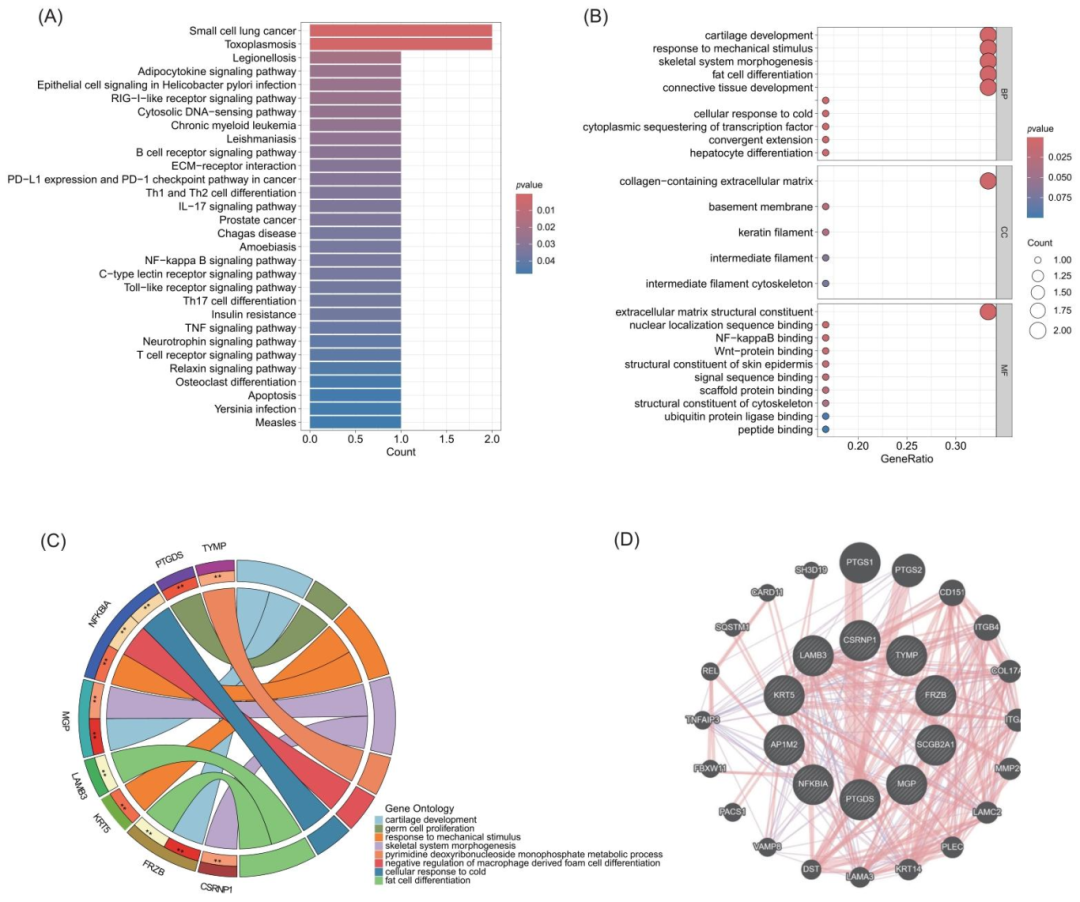
图2:关键基因的功能富集分析
KEGG 富集显示,10 个关键基因主要富集于免疫炎症通路 ——PD-1/PD-L1 信号通路(p=0.002)、B 细胞与 Th 细胞活化通路(p=0.003)、Toll 样受体通路(p=0.005);GO 富集显示,生物过程聚焦于巨噬细胞分化(p=0.001)、脂肪细胞分化(p=0.003),分子功能涉及 NF-κB 结合(p=0.002)、Wnt 蛋白结合(p=0.004);GeneMANIA 构建的互作网络显示,关键基因与前列腺素代谢、炎症因子分泌相关基因(如 PTGS2、IL-6)存在互作。
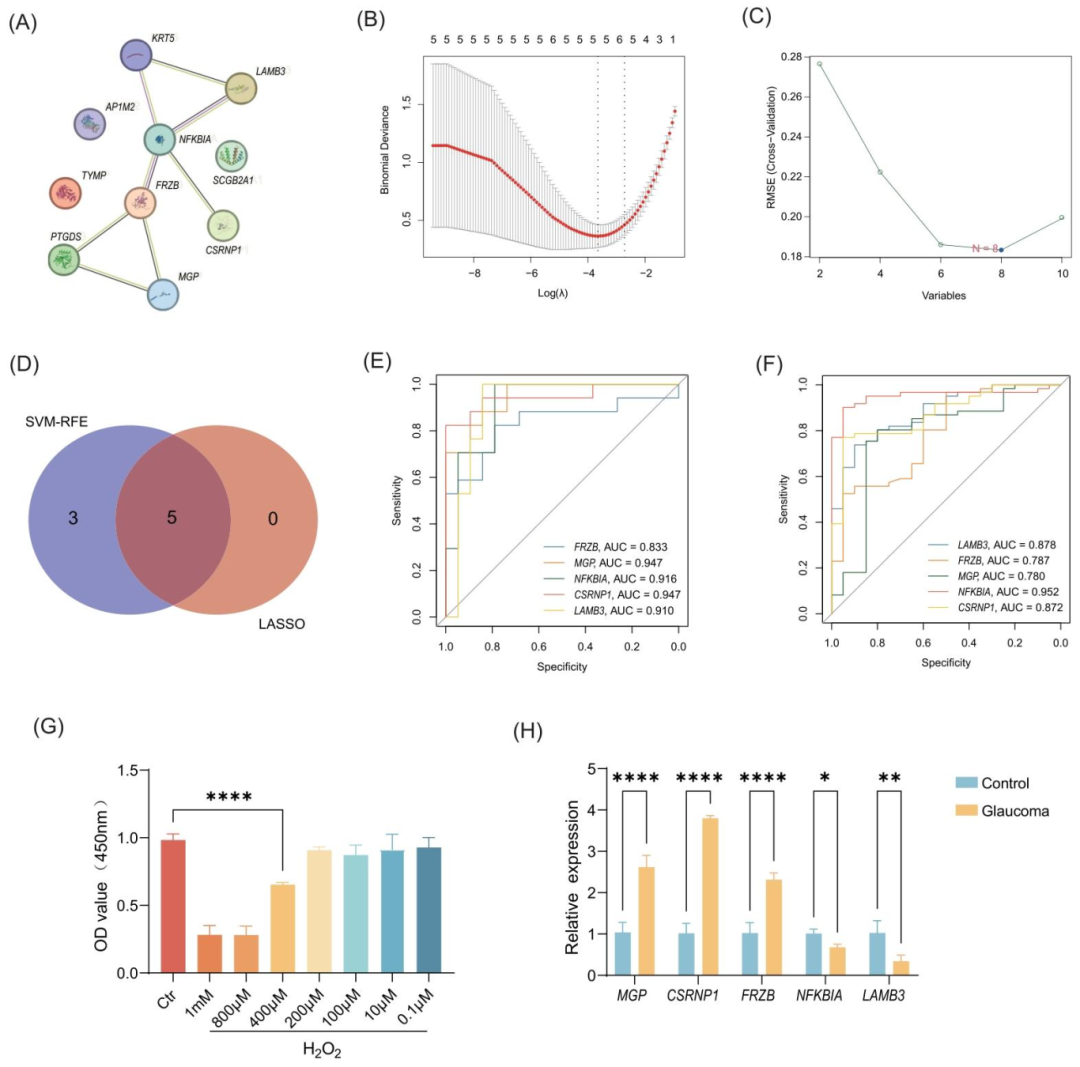
图3:生物标志物筛选与 RT-qPCR 验证
PPI 网络显示 10 个关键基因中 7 个存在强互作(结合评分 > 0.7);LASSO 回归筛选出 5 个基因(lambda=0.025),SVM-RFE 筛选出 8 个基因,交集获得 5 个核心标志物(LAMB3、MGP、NFKBIA、CSRNP1、FRZB);ROC 曲线显示,5 个标志物在 POAG 中 AUC 为 0.78-0.91,在 SLE 中为 0.79-0.83,诊断价值良好;RT-qPCR 验证显示,H₂O₂模型中 MGP、CSRNP1、FRZB mRNA 表达上调(分别升高 2.1、3.5、1.8 倍),NFKBIA、LAMB3 下调(分别降低 0.4、0.6 倍),与生物信息学结果一致(仅 CSRNP1 预测下调、实验上调,推测与细胞模型应激状态相关)。
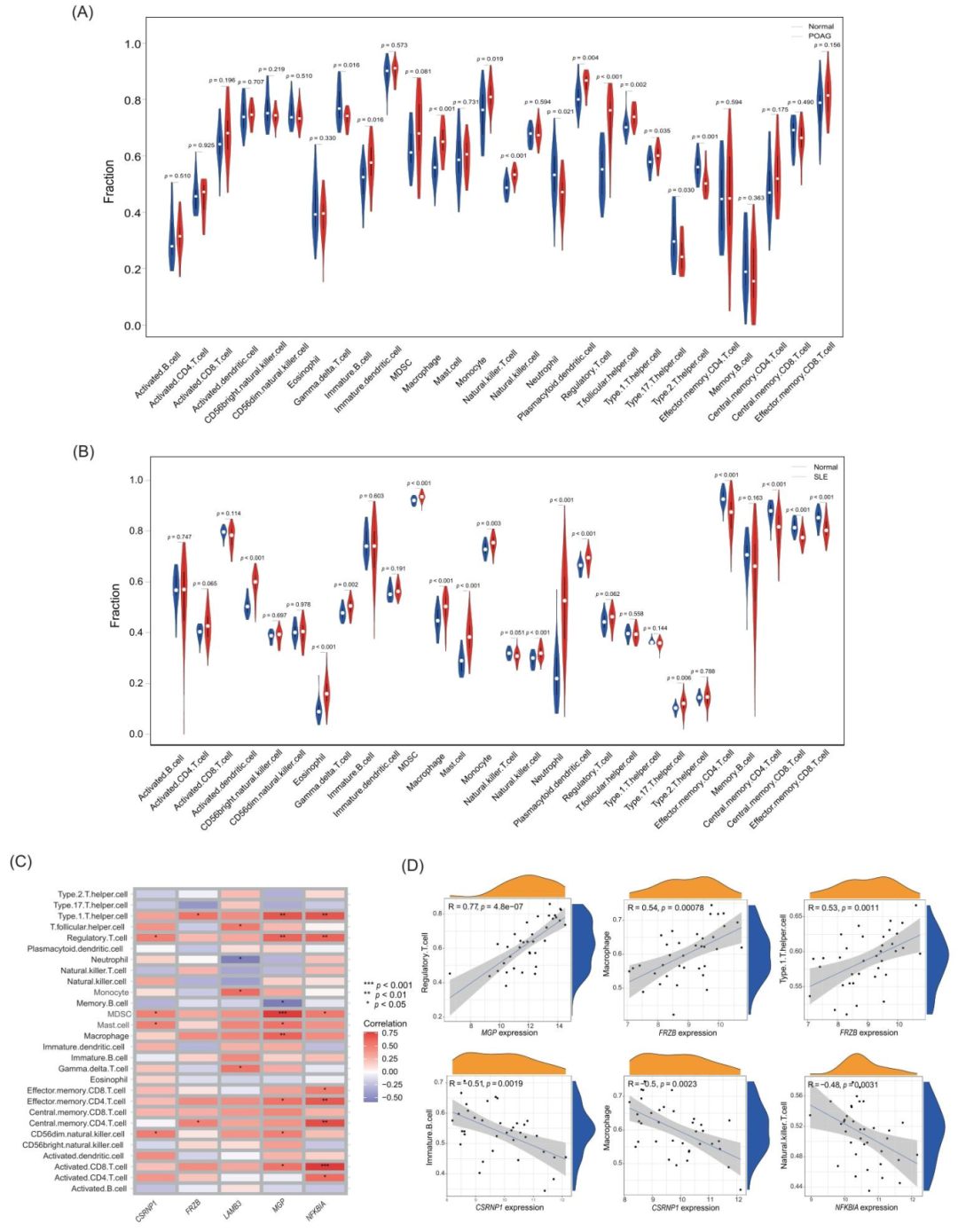
图4:免疫浸润分析
ssGSEA 显示,POAG 患者小梁网组织中巨噬细胞、单核细胞、调节性 T 细胞浸润较对照增加 20%-30%(p<0.05);SLE 患者血液中 Th 细胞、肥大细胞、中性粒细胞浸润增加 15%-25%(p<0.05);相关性分析显示,MGP 与调节性 T 细胞正相关(r=0.54,p<0.001),FRZB 与 Th17 细胞负相关(r=-0.51,p<0.001),NFKBIA 与 B 细胞正相关(r=0.48,p<0.001),证实标志物与免疫细胞的紧密关联。
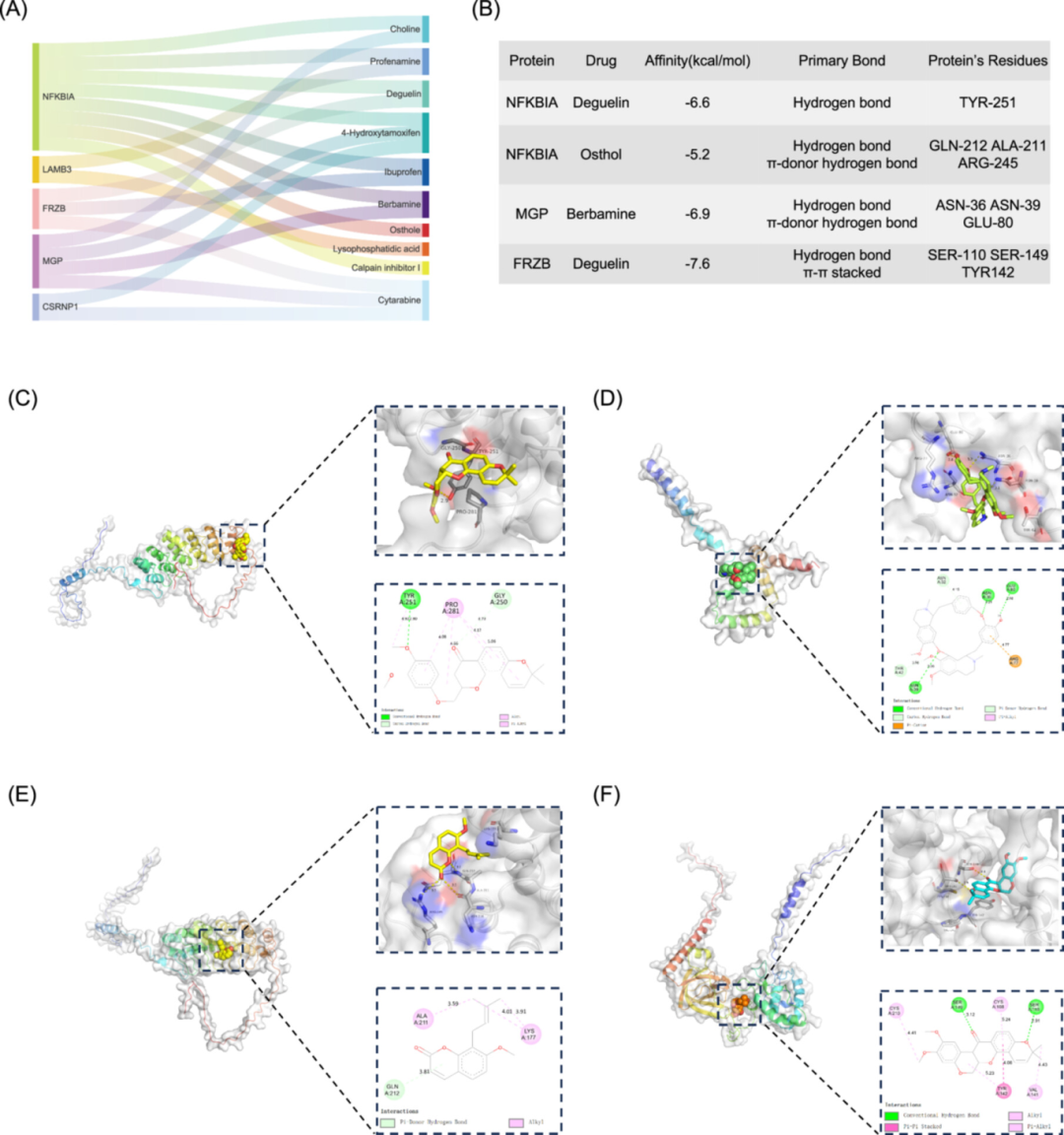
图5:潜在药物预测与分子对接
从 DSigDB 数据库筛选 10 种潜在药物(基于 p<0.01),其中 deguelin(豆科植物提取物)、berbamine(小檗属中药成分)、osthole(蛇床子提取物)研究较多;分子对接显示,deguelin 与 NFKBIA 结合亲和力为 - 6.9 kcal/mol(形成氢键结合 GLU-80),berbamine 与 MGP 结合亲和力为 - 6.7 kcal/mol,osthole 与 FRZB 结合亲和力为 - 6.5 kcal/mol,均满足 “强结合” 标准(<-6 kcal/mol),且结合位点位于蛋白功能结构域(如 NFKBIA 的 NF-κB 结合区)。
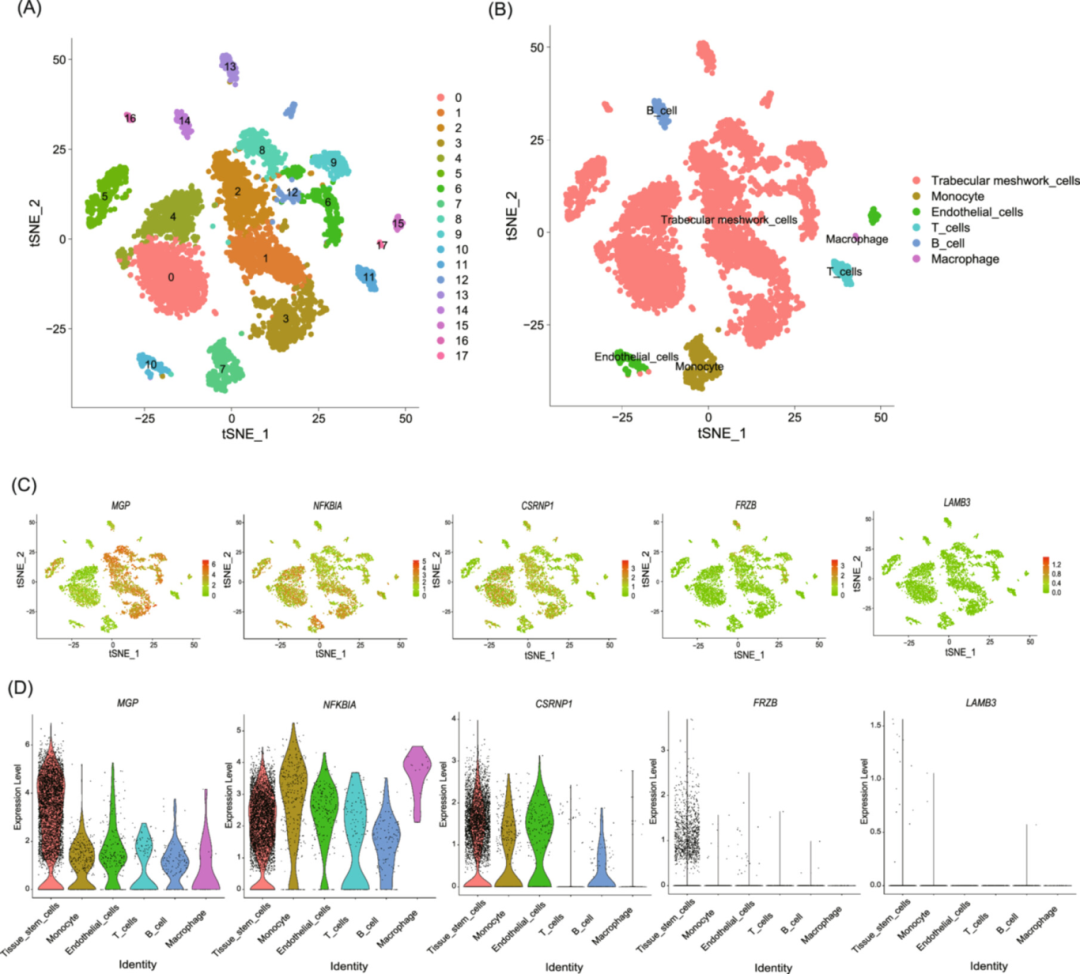
图6:单细胞水平标志物分布
对 POAG 小梁网单细胞数据聚类获得 17 个簇,注释为 6 类细胞(小梁网干细胞、内皮细胞、单核细胞、巨噬细胞、T 细胞、B 细胞);小提琴图显示,MGP、CSRNP1、FRZB、NFKBIA 在小梁网干细胞中高表达(表达量 > 2),NFKBIA、MGP 在单核细胞、巨噬细胞中表达量 > 1.5,LAMB3 在所有细胞中低表达(<0.5);散点图进一步证实标志物在免疫细胞(T/B 细胞)中的富集,提示其在小梁网细胞与免疫细胞互作中的调控作用。
本研究首次系统解析了原发性开角型青光眼(POAG)与系统性红斑狼疮(SLE)的共同免疫发病机制:两者通过 PD-1/PD-L1、NF-κB、Wnt 等免疫炎症通路关联,5 个核心生物标志物(LAMB3、MGP、NFKBIA、CSRNP1、FRZB)可作为 SLE 相关 POAG 的诊断靶点,且与巨噬细胞、T/B 细胞浸润密切相关;deguelin、berbamine、osthole 3 种天然化合物通过靶向这些标志物,有望成为潜在治疗药物。
研究局限性在于多基于生物信息学预测,需在动物模型(如 SLE-POAG 双疾病模型)中验证标志物功能及药物疗效;未来可进一步探索标志物在免疫细胞 - 小梁网细胞互作中的具体机制,为 SLE 相关 POAG 提供精准免疫干预策略。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:OBM1701 通过抑制视网膜色素上皮细胞 HIF-1α 减轻实验动物脉络膜新生血管
下一篇:鱿鱼(Euprymna berryi)原代细胞的分离、培养与转染实验方案