常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2026-02-04 09:00:00 细胞资源库平台 访问量:2
浓缩生长因子(CGF)是再生医学中常用的自体血液制品,富含生长因子与细胞,但此前仅明确其来源细胞(CPCs)的成骨分化能力,其他谱系分化研究匮乏。
意大利萨兰托大学团队在《International Journal of Molecular Sciences》发表题为Cells Derived from Concentrated Growth Factor Exhibit a Multilineage Differentiation Capacity研究:从健康供体 CGF 中分离培养 CPCs,发现其表达干细胞标志物(CD105、Oct3/4、Nanog),在特定诱导条件下可分化为脂肪细胞、内皮细胞及神经样细胞,分化能力与骨髓间充质干细胞(BMSCs)相当;通过油红 O 染色、免疫荧光、qPCR 等证实,分化细胞表达对应谱系特异性标志物(如脂肪的 PPARγ、内皮的 eNOS、神经的 TUBB3)。该研究填补了 CGF 细胞多向分化研究的空白,为 CPCs 在多组织再生治疗中的应用提供实验依据。
研究背景:CGF 作为第三代自体血小板浓缩物,含高浓度生长因子(VEGF、TGF-β 等)及异质性细胞群,已用于口腔、整形等再生场景,但此前仅证实 CPCs 可成骨分化,其向脂肪、内皮、神经等谱系的分化潜力尚未明确;外周血单核细胞等具有一定可塑性,而 CPCs 与单核细胞标志物(CD14、CD45)重叠,推测其可能具备多向分化能力,需进一步验证。
实验方法:纳入 5 名 27-50 岁健康供体,采集 8mL 静脉血离心制备 CGF;培养 14 天后切割 CGF,分离 CPCs 并传代;分别用含 IBMX / 地塞米松的培养基(脂肪)、M199+VEGF(内皮)、分四步的血清 - free 培养基(神经)诱导分化,以 BMSCs 为对照;通过油红 O 染色(脂肪脂质)、免疫荧光(谱系标志物)、qPCR(基因表达)、Western blot(蛋白)及 ImageJ 形态计量分析验证分化效果,PCA 分析形态数据,GraphPad Prism 进行统计。
实验结果:CPCs 表达 CD105、CD45、CD31、CD14,Oct3/4 与 Nanog mRNA 水平与 BMSCs 相当;脂肪诱导后油红 O 阳性,PLIN2、FABP4 等基因及 PPARγ 蛋白上调;内皮诱导后 eNOS、VEGFR-2、CD31 表达升高;神经诱导后 TUBB3、Nestin、NFL 上调,细胞呈神经样分支形态;CPCs 分化能力与 BMSCs 无显著差异,仅部分标志物表达强度略有不同。
CGF 收集与 CPCs 分离培养:采集 5 名健康供体 8mL 静脉血,用 Medifuge 离心(2700-3000rpm 梯度)制备 CGF,PBS 洗涤后用 DMEM 低糖培养基培养 14 天;切割 CGF 为 8 块,接种于 6cm 板,用含 10% FBS、2ng/mL FGF-2 的 DMEM 培养,CPCs 贴壁生长至汇合,传代 2 次后以 1.5×10⁴ cells/mL 接种于 24 孔板用于分化实验,全程遵循赫尔辛基宣言,获取供体知情同意。
BMSC 培养:采用 ATCC 来源 BMSCs(PCS-500-012),用含 10% FBS、2ng/mL FGF-2 的低糖 DMEM 培养基,在 37℃、5% CO₂环境培养,约 80% 汇合时传代,调整接种密度以匹配实验需求,作为 CPCs 分化能力的对照。
三谱系分化诱导:脂肪分化用高糖 DMEM 培养基(含 0.5mM IBMX、1μM 地塞米松、10μM 胰岛素、200μM 吲哚美辛)培养 14 天;内皮分化用 M199 培养基(含 2% FBS、50ng/mL VEGF)培养 14 天,每 3 天换液;神经分化分四步:24h 用含 2% B27、250μM IBMX、10ng/mL FGF-2 的培养基,后续 3 天仅加 2% B27,再 7 天加 1μM 全反式维 A 酸,最后 7 天加 2% B27+10ng/mL BDNF,共 18 天。
检测与形态分析:脂肪分化用 4% 多聚甲醛固定后油红 O 染色,ImageJ 定量染色强度;免疫荧光检测谱系标志物(脂肪:PPARγ;内皮:eNOS/VEGFR-2;神经:TUBB3),二抗偶联过氧化物酶,DAB 显色;qPCR 检测目标基因(如脂肪的 PLIN2、内皮的 eNOS、神经的 Nestin),以 GAPDH 归一化;Western blot 检测蛋白(如 PPARγ、TUBB3),β-actin 为内参;ImageJ 分析细胞形态(圆度、周长 / 面积比、坚实度),PCA 分析形态数据聚类。
统计分析:用 GraphPad Prism 9.5 软件,定量数据以 “均值 ± 标准差” 表示,两组比较用 t 检验,多组比较用 ANOVA(Bonferroni/Dunn 校正),PCA 分析形态变量归一化后的聚类情况,p<0.05 为差异有统计学意义,所有实验独立重复至少 3 次。
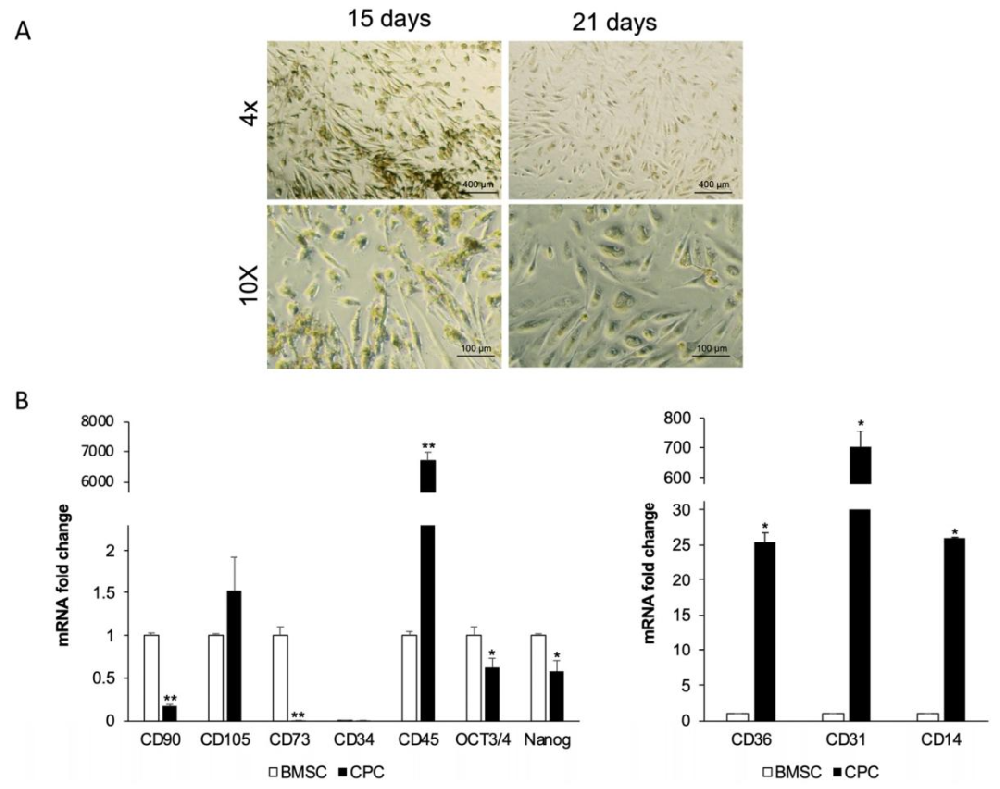
图1:CPCs 的形态与干细胞标志物表达
该图展示 CPCs 的体外培养特征与免疫表型:A 图显示 CPCs 在培养 15-21 天时形态异质,以细长形细胞为主且比例随时间增加;B 图 qPCR 结果显示,CPCs 表达 CD105(与 BMSCs 相当)、CD45、CD31、CD14(显著高于 BMSCs,分别为 26 倍、25 倍),不表达 BMSCs 特征性标志物 CD90、CD73,且与 BMSCs 类似表达 Oct3/4、Nanog(干细胞标志物),不表达造血标志物 CD34,证实 CPCs 为含干细胞特性的异质细胞群。
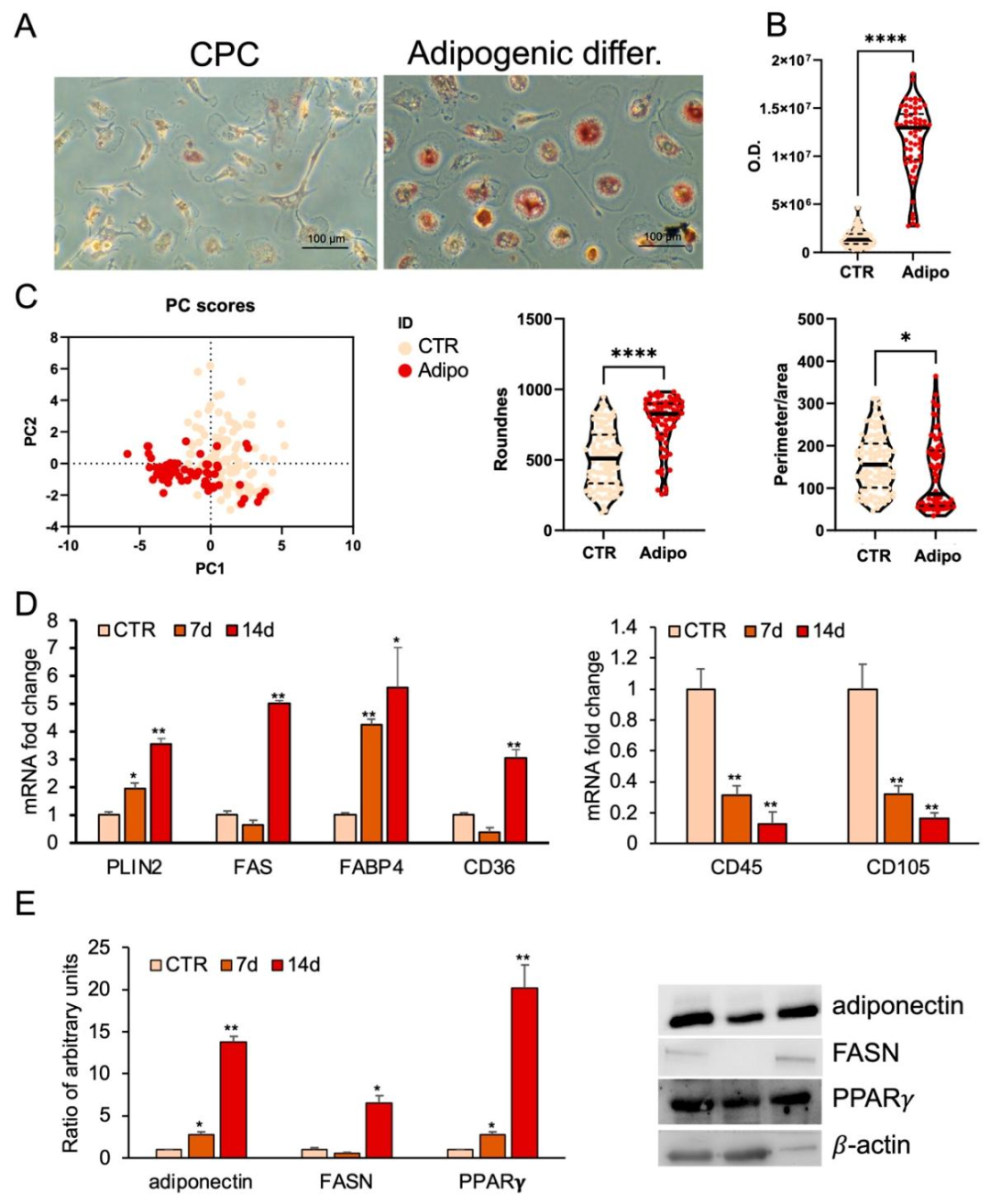
图2:CPCs 的脂肪分化
该图验证 CPCs 向脂肪细胞分化的能力:A 图油红 O 染色显示,脂肪诱导组(Adipo)细胞内出现大量红色脂质滴,对照组(CTR)无明显染色,且诱导组细胞从梭形变为球形;B 图 ImageJ 定量证实诱导组染色强度显著高于对照;C 图形态计量与 PCA 分析显示,诱导组细胞圆度更高、周长 / 面积比更低,且 PCA 聚类与对照完全分离;D 图 qPCR 显示,诱导 7-14 天,脂肪标志物 PLIN2、FABP4、FASN、CD36 mRNA 逐步上调,干细胞标志物 CD45、CD105 下调;E 图 Western blot 证实,诱导后 PPARγ、脂联素、FASN 蛋白表达显著升高,证实 CPCs 成功分化为功能脂肪细胞。
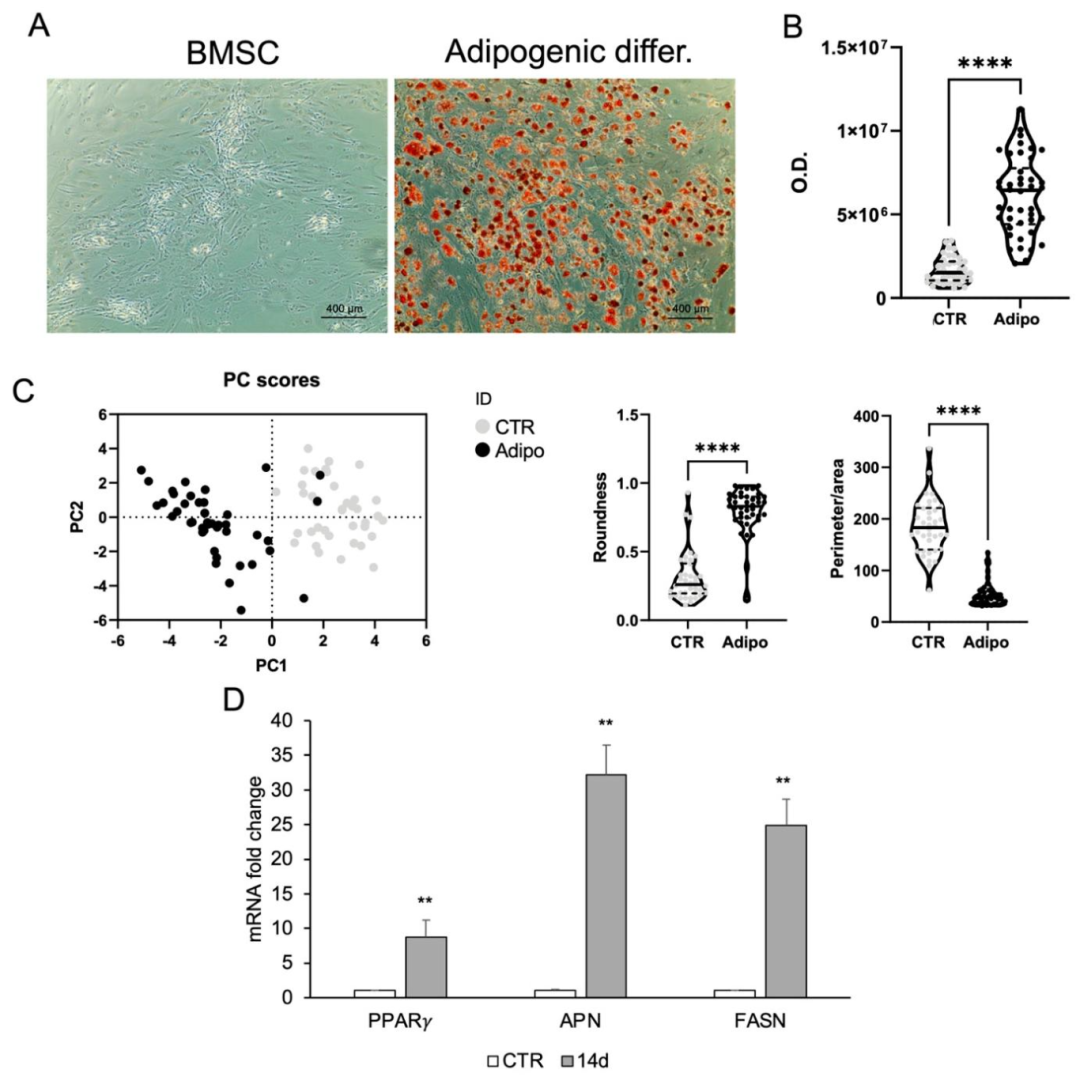
图3:BMSCs 的脂肪分化(对照)
该图作为 CPCs 脂肪分化的阳性对照:A 图油红 O 染色显示 BMSCs 脂肪诱导组脂质滴积累明显,对照无染色;B 图定量显示诱导组染色强度高;C 图形态分析与 PCA 证实诱导组形态更圆,聚类与对照分离;D 图 qPCR 显示 PPARγ、APN、FASN mRNA 在诱导后显著上调,表明 BMSCs 脂肪分化能力正常,可作为 CPCs 分化能力的参照。
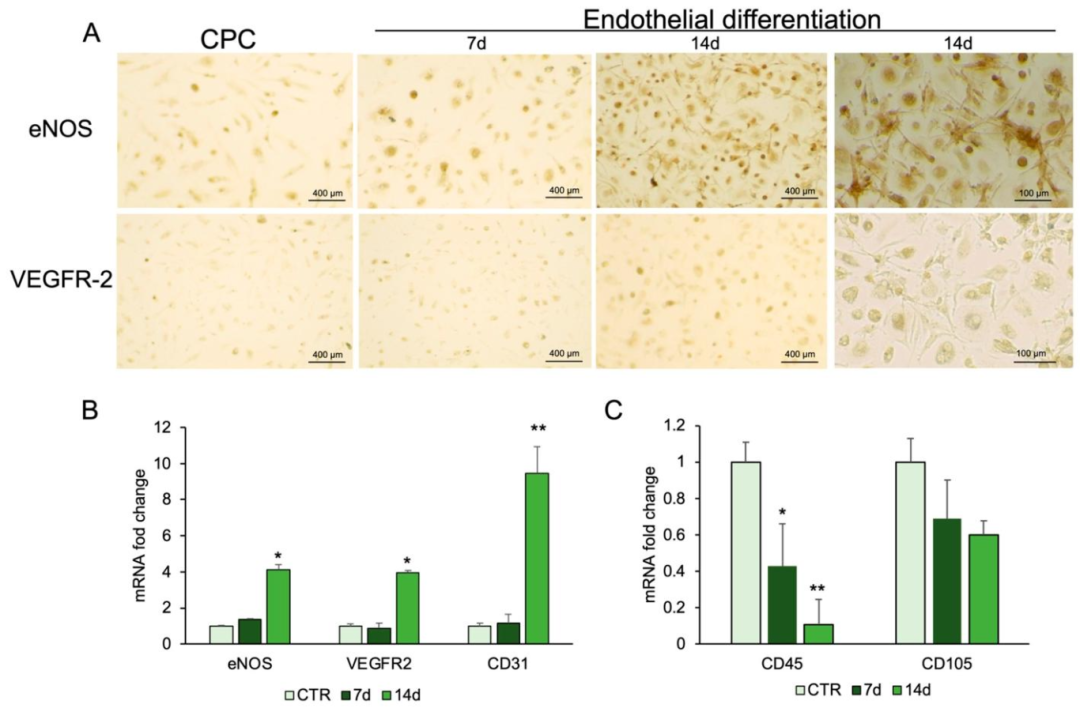
图4:CPCs 的内皮分化
该图展示 CPCs 向内皮细胞分化的效果:A 图免疫荧光显示,诱导 7-14 天,CPCs 表达内皮标志物 eNOS 与 VEGFR-2,且 14 天染色强度更高;B 图 qPCR 证实,诱导后 eNOS、VEGFR-2、CD31 mRNA 显著上调,且随时间增加;C 图显示诱导组造血标志物 CD45 mRNA 显著下调, mesenchymal 标志物 CD105 无明显下降,符合内皮分化过程中谱系转换的特征,证实 CPCs 获得内皮细胞表型。
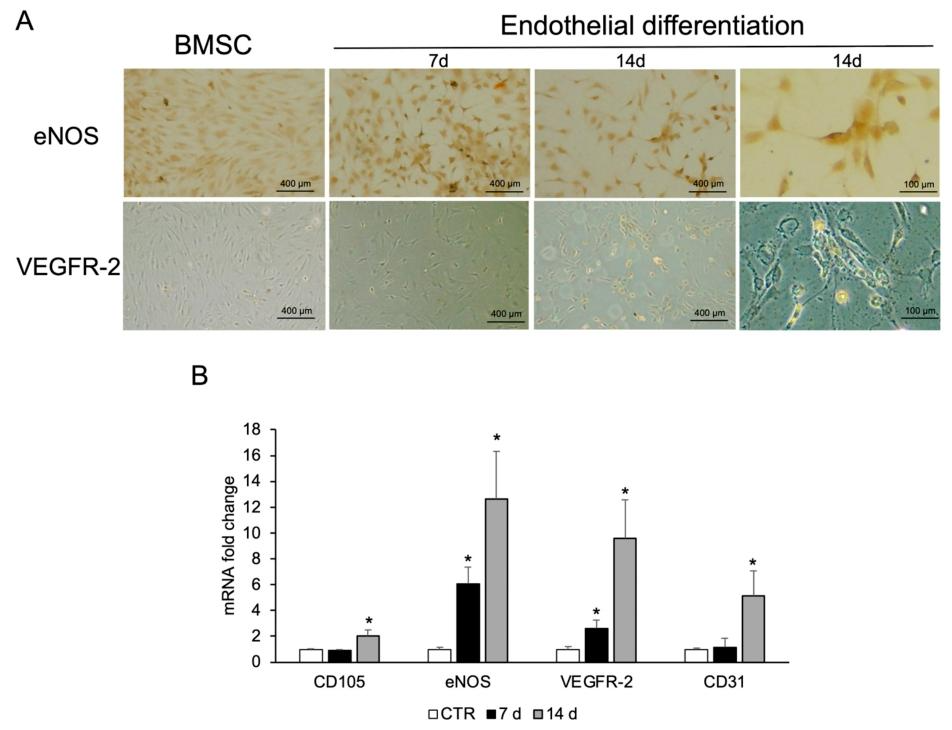
图5:BMSCs 的内皮分化(对照)
该图为 CPCs 内皮分化的对照:A 图免疫荧光显示 BMSCs 诱导 6-14 天,eNOS 表达逐步增强,14 天 VEGFR-2 呈阳性,对照无明显信号;B 图 qPCR 显示,诱导 7-14 天,CD105、eNOS、VEGFR-2、CD31 mRNA 均上调,14 天表达最高,与 CPCs 内皮分化趋势一致,进一步验证诱导体系有效,且 CPCs 分化能力与 BMSCs 相当。
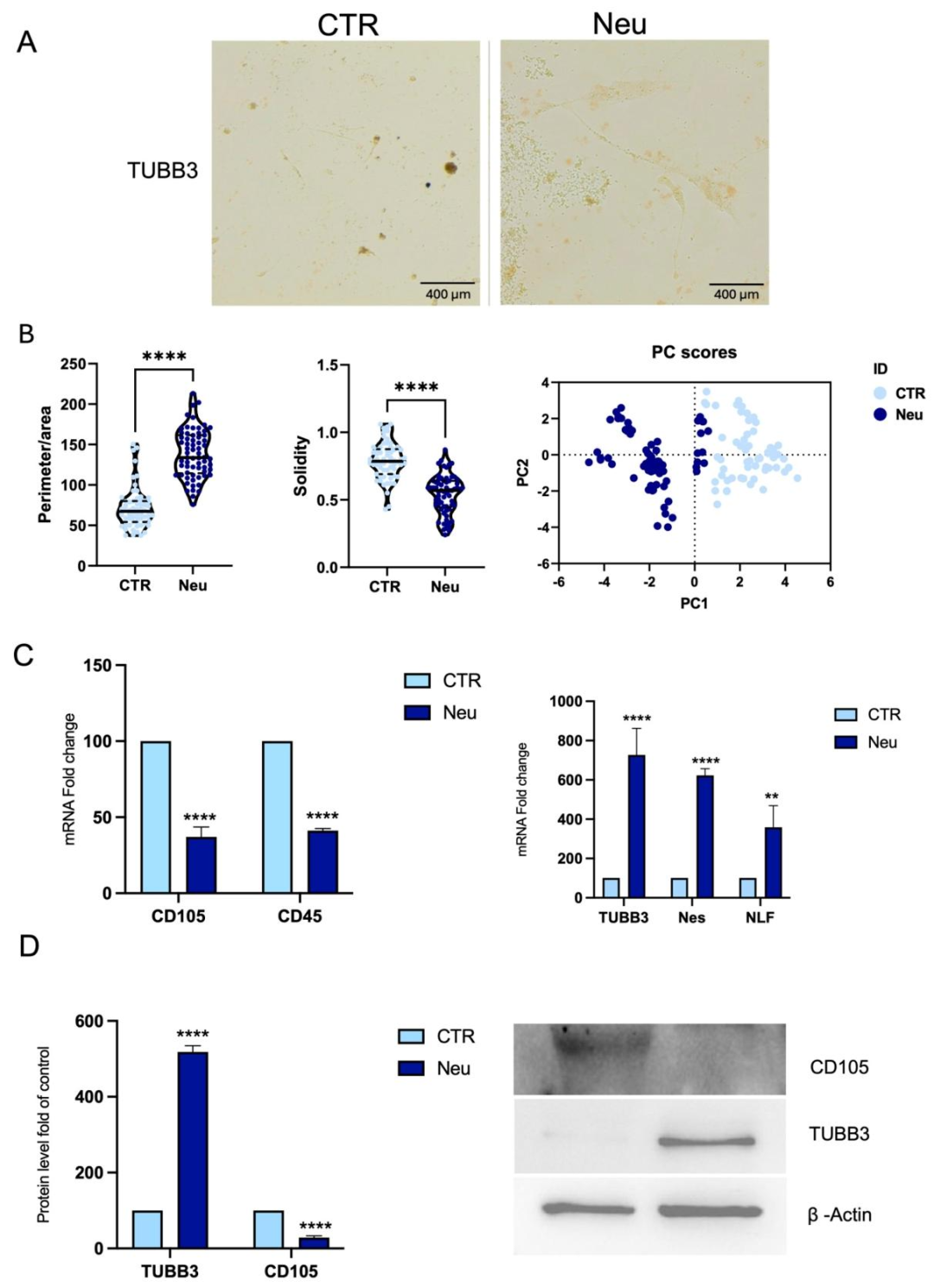
图6:CPCs 的神经样细胞分化
该图验证 CPCs 向神经样细胞分化的潜力:A 图免疫荧光显示,神经诱导组(Neu)细胞 TUBB3 阳性,呈细长分支形态,对照组(CTR)为梭形且 TUBB3 阴性;B 图形态分析与 PCA 显示,诱导组周长 / 面积比更高、坚实度更低(分支更多),PCA 聚类与对照完全分离;C 图 qPCR 显示,诱导组 CD45、CD105 下调,TUBB3、Nestin、NFL 显著上调;D 图 Western blot 证实,诱导组 TUBB3 蛋白升高、CD105 降低,表明 CPCs 成功分化为神经样细胞。
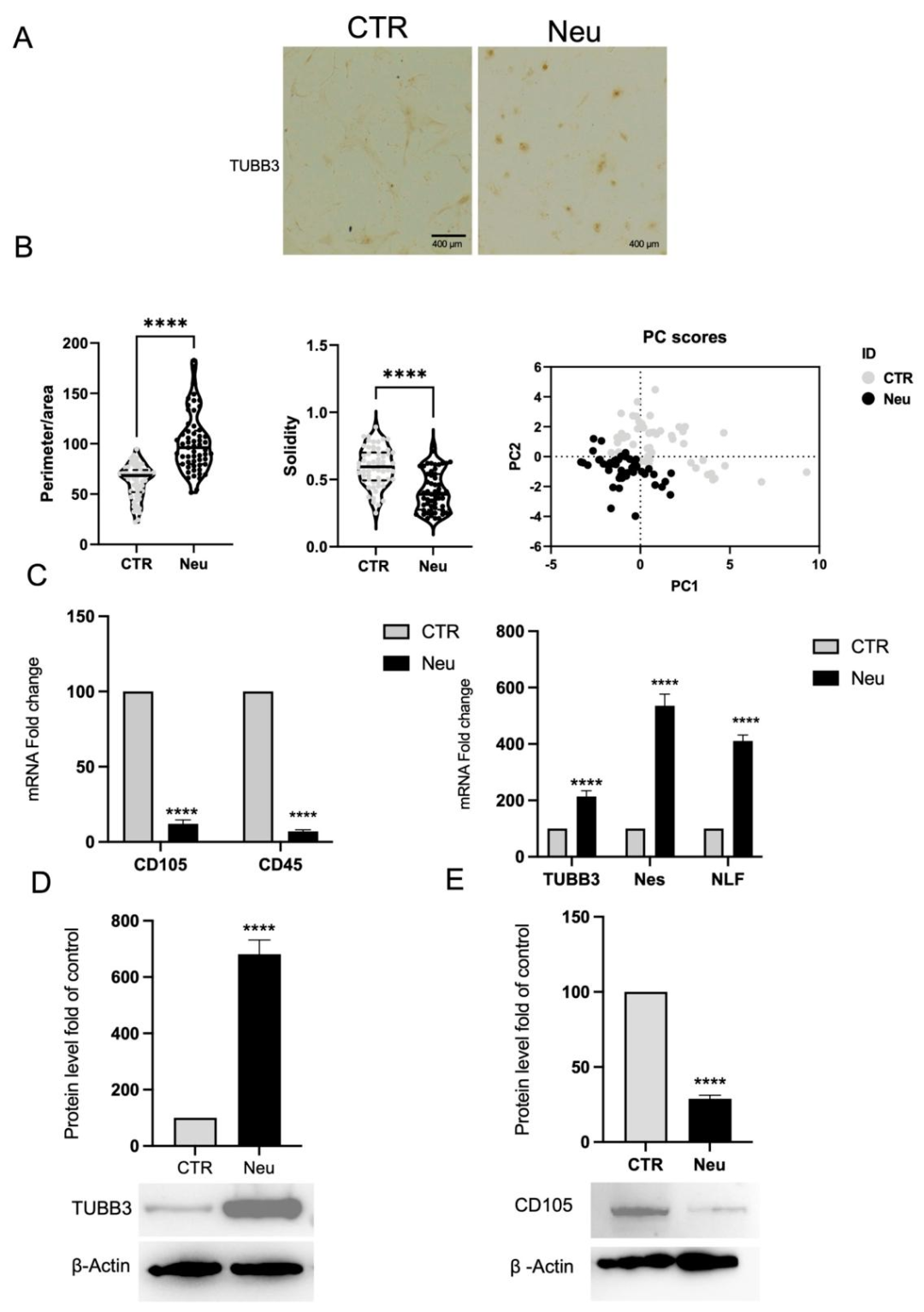
图7:BMSCs 的神经样细胞分化(对照)
该图作为 CPCs 神经分化的对照:A 图免疫荧光显示 BMSCs 神经诱导组 TUBB3 强阳性,呈神经样形态,对照为梭形;B 图形态分析与 PCA 证实诱导组形态更复杂,聚类与对照分离;C 图 qPCR 显示诱导组 CD45、CD105 下调,TUBB3、Nestin、NFL 上调;D-E 图 Western blot 显示诱导组 TUBB3 升高、CD105 降低,与 CPCs 结果一致,证实 CPCs 神经分化能力与 BMSCs 相当。
本研究从健康供体浓缩生长因子(CGF)中分离获得 CGF 来源细胞(CPCs),证实其表达 CD105、Oct3/4、Nanog 等干细胞标志物,且具有与骨髓间充质干细胞(BMSCs)相当的多向分化能力 —— 在特定诱导条件下可成功分化为脂肪细胞(表达 PPARγ、积累脂质)、内皮细胞(表达 eNOS、VEGFR-2)及神经样细胞(表达 TUBB3、Nestin),分化过程中谱系特异性标志物基因与蛋白显著上调,干细胞标志物下调,形态也呈现对应谱系特征。该研究填补了 CGF 细胞除成骨外多向分化研究的空白,表明 CGF 既是生长因子缓释载体,也是自体多能干细胞库,为其在脂肪修复、血管再生、神经修复等多领域再生医学应用提供实验依据;同时研究存在局限性,供体仅为 5 名健康人,未纳入病理状态供体,且未探索软骨分化潜力,未来需扩大样本量并拓展分化谱系,进一步验证 CPCs 在临床场景中的适用性。# 浓缩生长因子来源细胞的多向分化能力研究:脂肪、内皮及神经样细胞分化潜力探索
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:AI 驱动图像分析探索分子涂层在人类角膜内皮细胞原代培养中的作用
下一篇:环状 RNA 在人类胎盘老化与死胎中的作用:机制解析及筛查价值