常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2026-01-27 17:02:33 细胞资源库平台 访问量:31
荧光素酶报告基因系统是一种基于荧光素酶催化底物氧化反应产生生物发光的检测技术,广泛应用于细胞生物学研究。其中,萤火虫荧光素酶(firefly luciferase, Fluc)因其高灵敏度、宽线性检测范围(约7~8个数量级)以及较短的半衰期(在哺乳动物细胞中约为3小时,在植物细胞中约为3.5小时)而成为最常用的报告基因。其发光信号强度在酶浓度为10⁻¹⁶ mol/L至10⁻⁸ mol/L的范围内与酶活性呈线性关系,并且在理想条件下可检测到低至10⁻²⁰ mol/L的荧光素酶活性。此外,荧光素酶报告基因系统具有非放射性、检测快速、灵敏度高(比氯霉素乙酰转移酶CAT高100倍)等优点,特别适用于高通量筛选和活细胞检测。通过将荧光素酶报告基因载体转染至宿主细胞后,可利用荧光素酶检测系统灵敏且便捷地监测基因表达水平,已成为细胞生物学研究中的重要工具。逸漠生物自主研发了近200种表达Fluc的细胞系,均经过荧光素酶活性检测验证,可满足科研人员的多样化需求,欢迎咨询。
英文标题:A quantitative method to monitor STING degradation with dual-luciferase reporters
中文标题:基于双荧光素酶报告基因的 STING 降解定量检测方法
发表期刊:《Cell Structure and Function》
影响因子:2.2
作者单位:
Laboratory of Organelle Pathophysiology, Department of Integrative Life Sciences, Graduate School of Life Sciences, Tohoku University, Sendai, Japan
作者信息:
Tsumugi Shoji,Kanako Sato;通讯作者(Yoshihiko Kuchitsu:yoshihiko.kuchitsu.d8@tohoku.ac.jp;Tomohiko Taguchi:tomohiko.taguchi.b8@tohoku.ac.jp)
STING 作为先天免疫关键分子,可激活 I 型干扰素和炎症反应抵御 DNA 病原体,其激活后通过溶酶体微自噬降解,若降解受阻会导致炎症信号持续,与神经退行性疾病和自身炎症性疾病相关。现有 STING 降解检测依赖 Western blot 和 FACS,存在局限性:无法高通量筛选,且 STING 的 K63 泛素化等翻译后修饰会导致条带移位,难以准确定量。本研究开发基于萤火虫荧光素酶(FLuc)和纳米荧光素酶(NLuc)的双荧光素酶报告系统,实现 STING 降解的定量、高通量检测,弥补现有方法的不足。
构建含 FLuc、P2A 自切割位点和 NLuc 标记 STING 的表达质粒(优化后确定最优排列为 FLuc-P2A-NLuc-STING),FLuc 作为内参反映总翻译量,NLuc 信号对应 STING 含量。将质粒转染 Sting⁻/⁻永生化小鼠胚胎成纤维细胞(iMEFs),通过 DMXAA(啮齿动物特异性 STING 激动剂)或 dsDNA 刺激 STING 激活,检测指标包括:1)双荧光素酶活性定量 NLuc/FLuc 比值,反映 STING 降解动力学;2)Western blot 验证 STING 激活(p-TBK1)和降解;3)免疫荧光验证 NLuc-STING 的亚细胞定位(ER、高尔基体、回收内体);4)siRNA 敲低 STING 转运 / 降解关键基因(Sar1A/B、Atp6v1b2 等)及抑制剂(MLN7243)验证方法特异性;5)扩展至人源 STING 及其常见变体(HAQ、R232H)的降解检测。
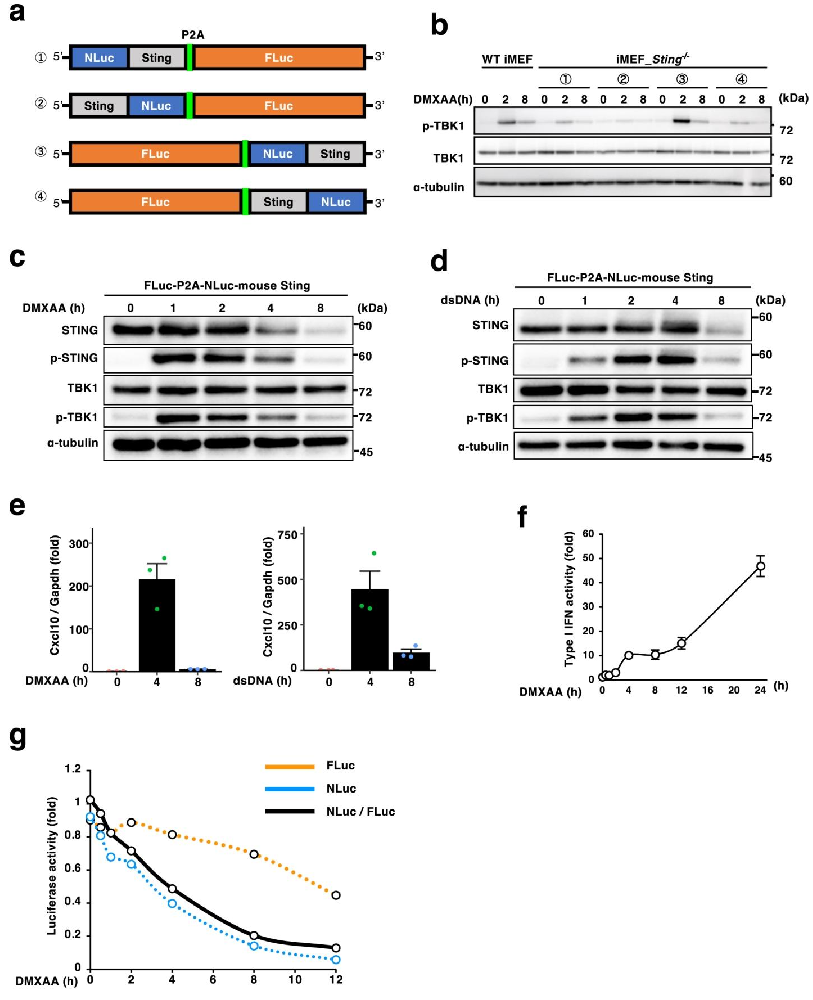
图 1:双荧光素酶报告系统的构建与功能验证
设计 4 种不同排列的双荧光素酶质粒,仅 FLuc-P2A-NLuc-STING 转染后,DMXAA 刺激 2 小时可激活 TBK1(p-TBK1),8 小时后 NLuc-STING 蛋白显著降解(图 1b、c),dsDNA 刺激也能诱导其降解(图 1d)。该融合蛋白可正常诱导 Cxcl10 转录和 I 型干扰素分泌,证实功能完整(图 1e、f)。定量检测显示,DMXAA 刺激后 NLuc/FLuc 比值逐渐下降,8 小时时降低 80%,反映 STING 降解动力学(图 1g)。
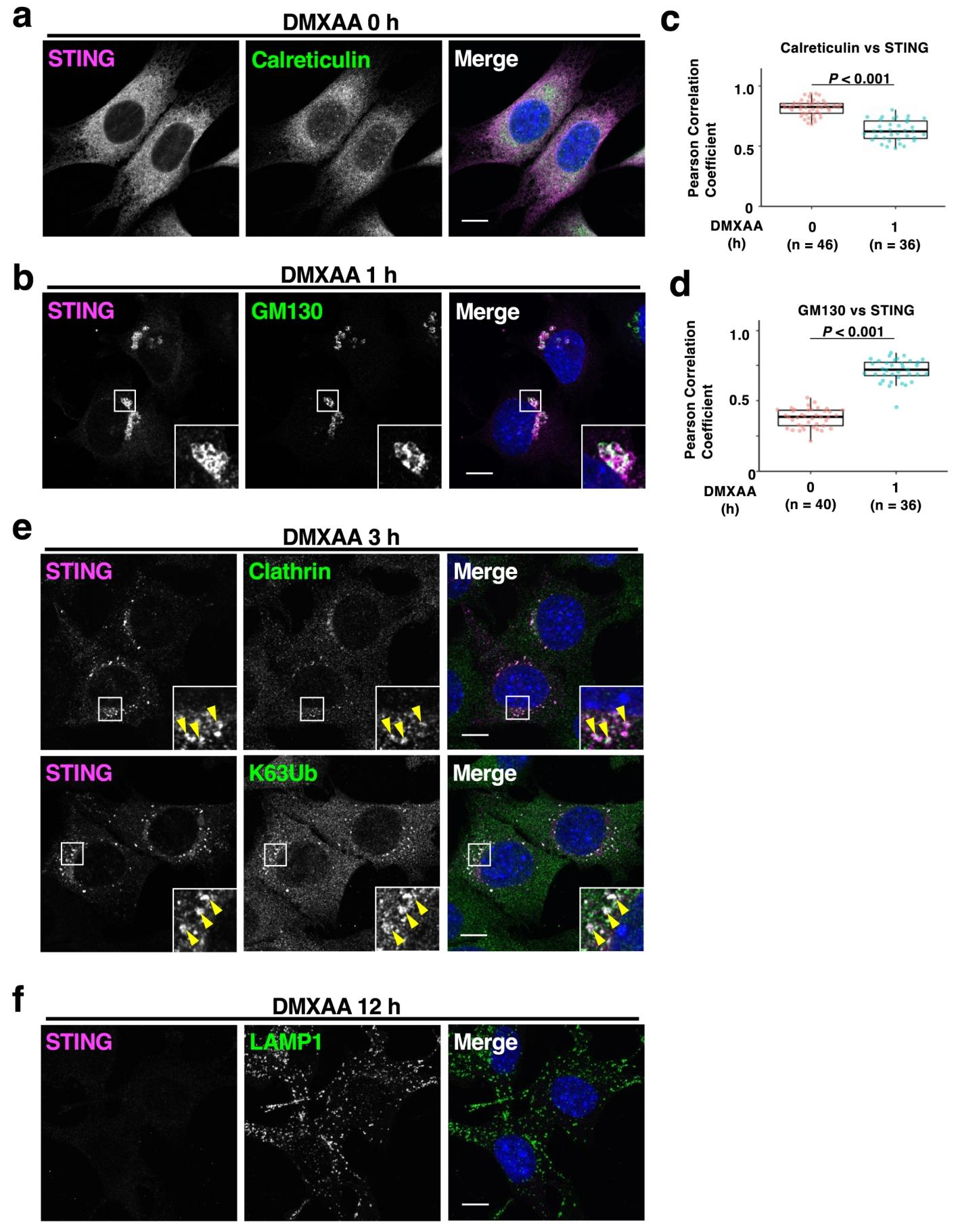
图 2:NLuc-STING 的亚细胞定位验证
未刺激时,NLuc-STING 与 ER 标志物钙网蛋白(calreticulin)共定位(图 2a);DMXAA 刺激 1 小时后,转移至高尔基体并与 GM130 共定位,钙网蛋白共定位系数显著下降,GM130 共定位系数升高(图 2b-d);3 小时后定位于点状结构,与网格蛋白重链和 K63 泛素共定位(回收内体特征)(图 2e);12 小时后信号几乎消失,证实降解(图 2f),表明 NLuc-STING 的转运路径与内源性 STING 一致。
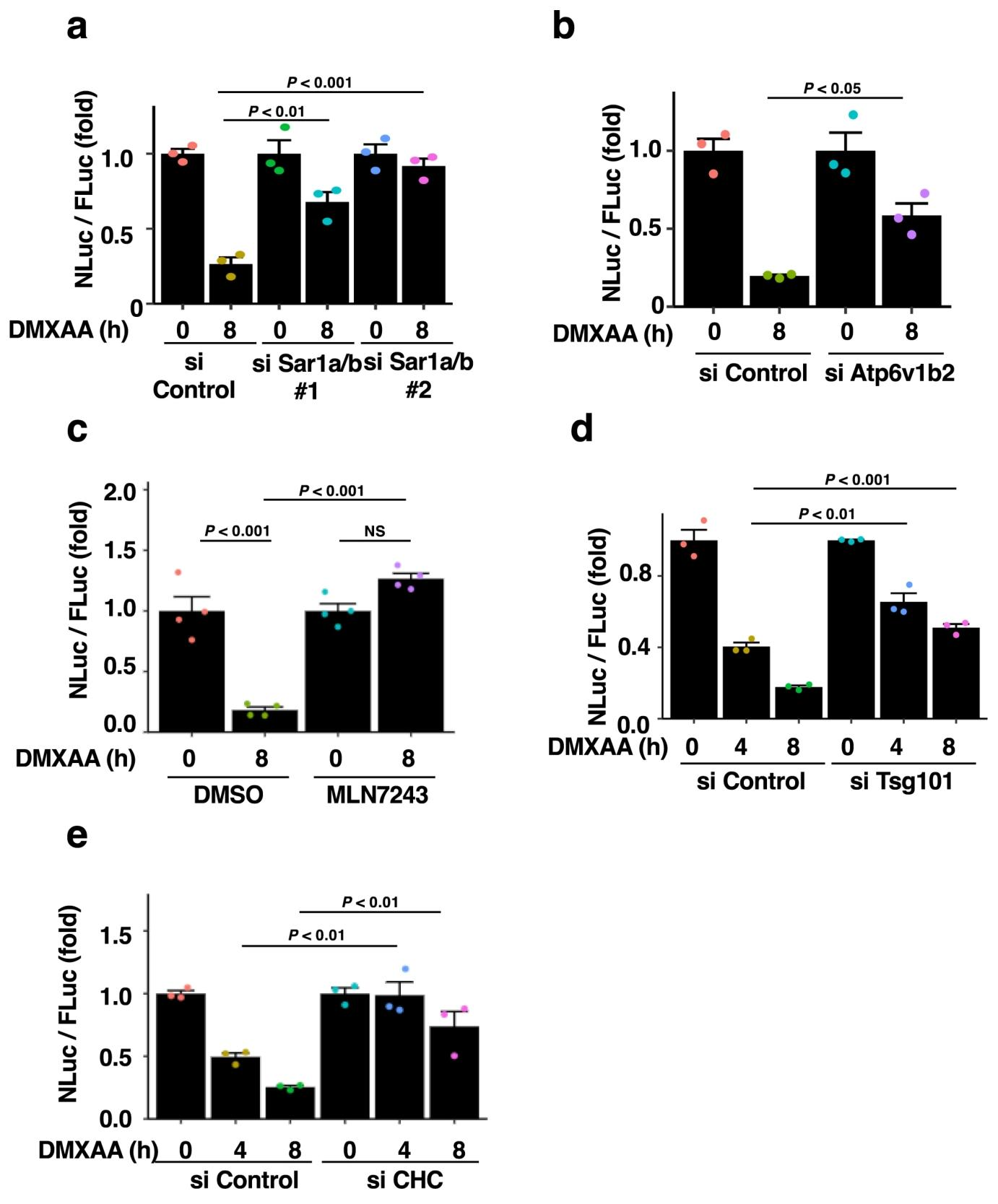
图 3:基因敲低与抑制剂验证方法特异性
siRNA 敲低 ER - 高尔基体转运关键基因 Sar1A/B(图 3a)、溶酶体功能基因 Atp6v1b2(图 3b),均显著抑制 DMXAA 诱导的 STING 降解。泛素激活酶抑制剂 MLN7243(图 3c)、siRNA 敲低 ESCRT 复合体亚基 Tsg101(图 3d)或网格蛋白重链(CHC)(图 3e),也均阻断 STING 降解,证实该方法可特异性反映 STING 的溶酶体微自噬降解过程。
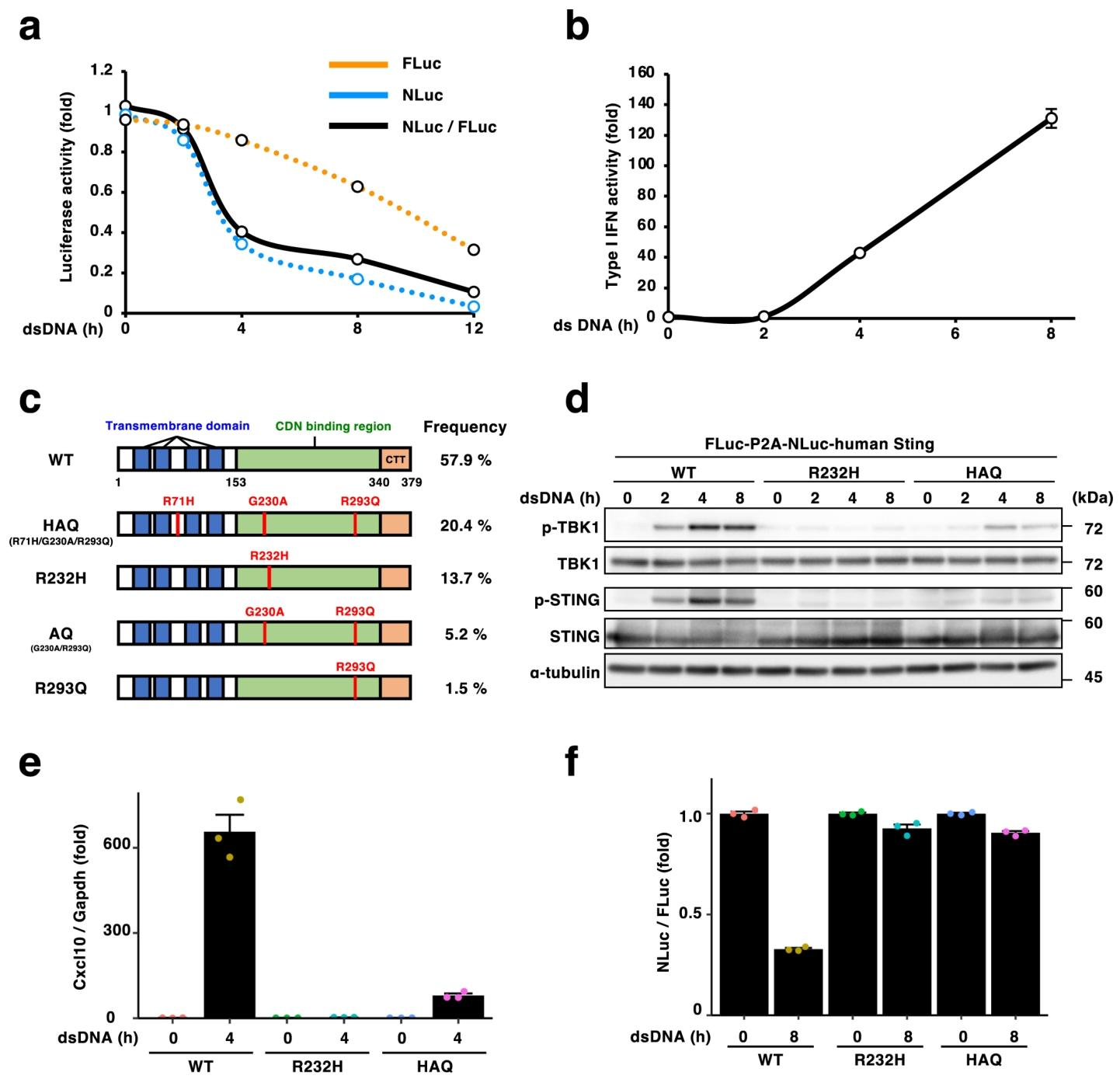
图 4:人源 STING 及其变体的降解检测
构建 FLuc-P2A-NLuc - 人 STING 质粒,dsDNA 刺激后 NLuc/FLuc 比值逐渐下降,12 小时降低 90%,且人 STING 可正常诱导 I 型干扰素分泌(图 4a、b)。人 STING 常见变体 HAQ 和 R232H 中,R232H 无法激活 TBK1 和 Cxcl10 转录,HAQ 激活能力减弱(图 4d、e),且两者刺激后 NLuc/FLuc 比值无下降,表明这两种变体几乎不发生降解(图 4f)。
本研究成功开发了基于双荧光素酶报告基因的 STING 降解定量检测方法,核心成果如下:1)优化得到 FLuc-P2A-NLuc-STING 质粒,FLuc 作为内参可校正转染效率和细胞状态,NLuc/FLuc 比值能准确反映 STING 降解动力学;2)该方法不受 STING 翻译后修饰(泛素化、磷酸化)影响,可实现高通量检测,弥补 Western blot 和 FACS 的不足;3)通过亚细胞定位、基因敲低和抑制剂实验,证实方法特异性强,能反映 STING 的溶酶体微自噬降解路径;4)可扩展至人源 STING 及其变体的降解检测,为 STING 相关疾病的机制研究和药物筛选提供工具。该方法适用于基因组 - wide 筛选 STING 降解调控基因、化学库筛选 STING 降解调节剂,同时为 STING 变体的功能分析提供量化手段。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:PEG 化 ATP 非依赖性荧光素酶底物用于非侵入性高灵敏度高速生物发光成像
下一篇:介孔儿茶素纳米载体增强姜黄素通过协同抗氧化与巨噬细胞重极化治疗骨关节炎