常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2026-01-16 09:00:00 细胞资源库平台 访问量:34
英文标题:Autonomic Lysosomal Escape via Sialic Acid Modification Enhances mRNA Lipid Nanoparticles to Eradicate Tumors and build Humoral Immune Memory
中文标题:唾液酸修饰通过自主溶酶体逃逸增强mRNA脂质纳米粒以根除肿瘤并建立体液免疫记忆
发表期刊:《Journal of Controlled Release》
影响因子:11.8
作者单位:
沈阳药科大学药学院
作者信息:
Xueying Tang, Jiashuo Zhang, Yuejia Sun, Zihan Xu, Tiancheng Hang, Xinrong Liu, Yanzhi Song, Yu Zhang, Yihui Deng
1.溶酶体作为mRNA递送的主要屏障
溶酶体含有大量水解酶,能降解几乎所有物质,是mRNA递送的主要细胞内障碍。传统脂质纳米粒(LNPs)中仅有约2%能成功将mRNA释放至细胞质,超过90%在溶酶体中被降解。
2.现有溶酶体逃逸策略的局限性
现有策略主要依赖溶酶体破坏,效率低且存在细胞溶解风险。这些方法受细胞类型和给药途径等外部因素影响,被称为被动溶酶体逃逸(PLE)。
3.唾液酸(SA)的潜力
唾液酸是一种九碳酸性氨基糖,具有自发逃逸溶酶体降解的能力,在多种病理生理过程中发挥重要生物活性。研究表明,外源性SA(如病毒糖脂末端的SA)可协助病毒实现溶酶体逃逸。
4.研究创新点
本研究首次提出自主溶酶体逃逸(ALE) 策略,即通过SA修饰诱导细胞自发减少溶酶体生成,从而实现高效、可控的溶酶体逃逸。同时,开发了SELECT系统(通过累积测试系统评估LNPs效率),用于科学评估多剂量下LNPs的转染性能。
1.SA修饰LNPs的制备与表征
合成SA-胆固醇偶联物(SA-CH)与可切割PEG-脂质(Ps或Pc),通过微流控设备制备共修饰LNPs(如SAPs@LNPs)。通过动态光散射、冷冻电镜、RiboGreen法等进行粒径、形态、包封率和电位表征。
2.体外细胞转染与溶酶体逃逸实验
在DC2.4细胞中评估不同LNPs的EGFP mRNA转染效率。使用LysoTracker Green和DiD标记LNPs,通过共聚焦显微镜观察溶酶体逃逸过程。
3.体内转染效率评估
通过静脉注射、肌肉注射和吸入给药方式,在不同品系小鼠中评估Fluc mRNA LNPs的体内表达情况。使用活体成像系统监测荧光素酶表达。
4.抗肿瘤治疗实验
在TC-1肿瘤模型小鼠中,评估SA修饰mRNA疫苗(如SAPs@LNPs)单独或与化疗药物(DOX-SL或Caelyx)联用的抗肿瘤效果。监测肿瘤体积、抑制率和治愈率。
5.免疫细胞分析与血清治疗
通过流式细胞术分析外周和肿瘤浸润免疫细胞(如T细胞、NK细胞)比例及Siglec表达。收集治愈小鼠血清,注射至荷瘤小鼠体内,评估其抗肿瘤效果。
6.统计方法
使用SPSS软件进行单因素方差分析(ANOVA),P<0.05视为显著。
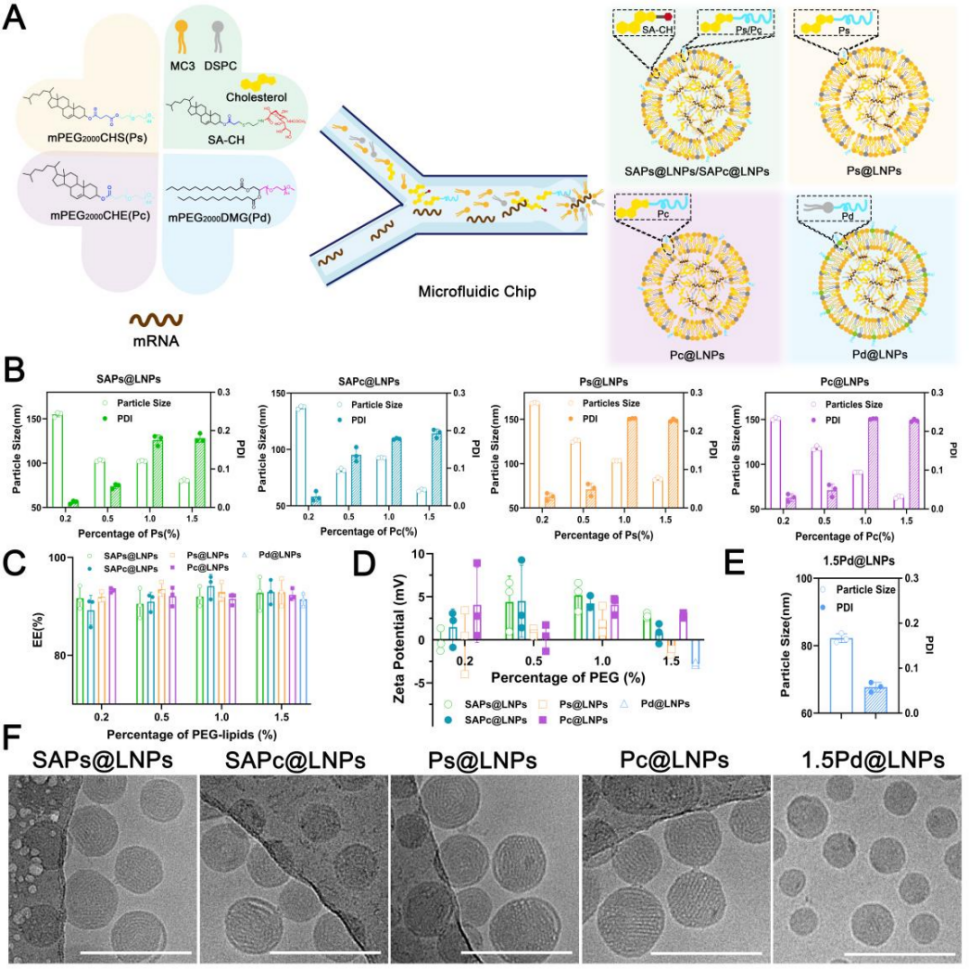
图1 LNPs的制备与表征。
A) SAPs@LNPs、SAPc@LNPs、Ps@LNPs、Pc@LNPs和Pd@LNPs的组成与制备示意图。
B) 含有不同密度Ps或Pc的LNPs的粒径和多分散指数。
C) LNPs的包封率。
D) LNPs的Zeta电位。
E) 1.5Pd@LNPs的粒径。
F) SAPs@LNPs、SAPc@LNPs、Ps@LNPs、Pc@LNPs和1.5Pd@LNPs的代表性冷冻电镜照片。比例尺=200 nm。
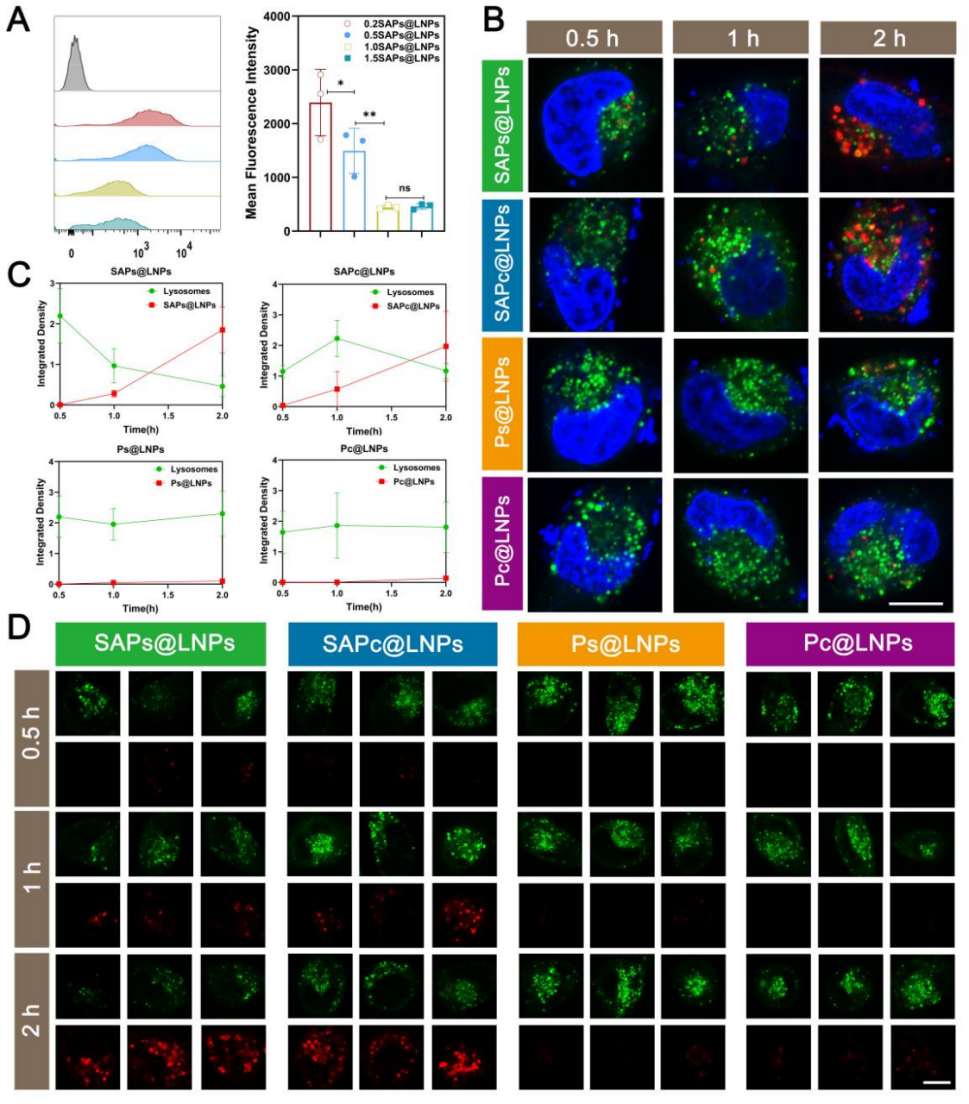
图2 可切割PEG-脂质类型对SA介导的自主溶酶体逃逸的影响。
A) SA与不同密度可切割PEG-脂质共修饰LNPs的转染效率。
B) 与SAPs@LNPs、SAPc@LNPs、Ps@LNPs和Pc@LNPs孵育0.5-2小时后细胞的荧光成像。红色和绿色荧光分别代表DiD标记的LNPs和溶酶体。比例尺=10 μm。
C) 各组DC2.4细胞在不同时间点的红色与绿色荧光积分密度。
D) 从SAPs@LNPs、SAPc@LNPs、Ps@LNPs和Pc@LNPs组获取的溶酶体与吞噬LNPs的荧光图像。观察期为与各LNPs孵育后0.5至2小时。
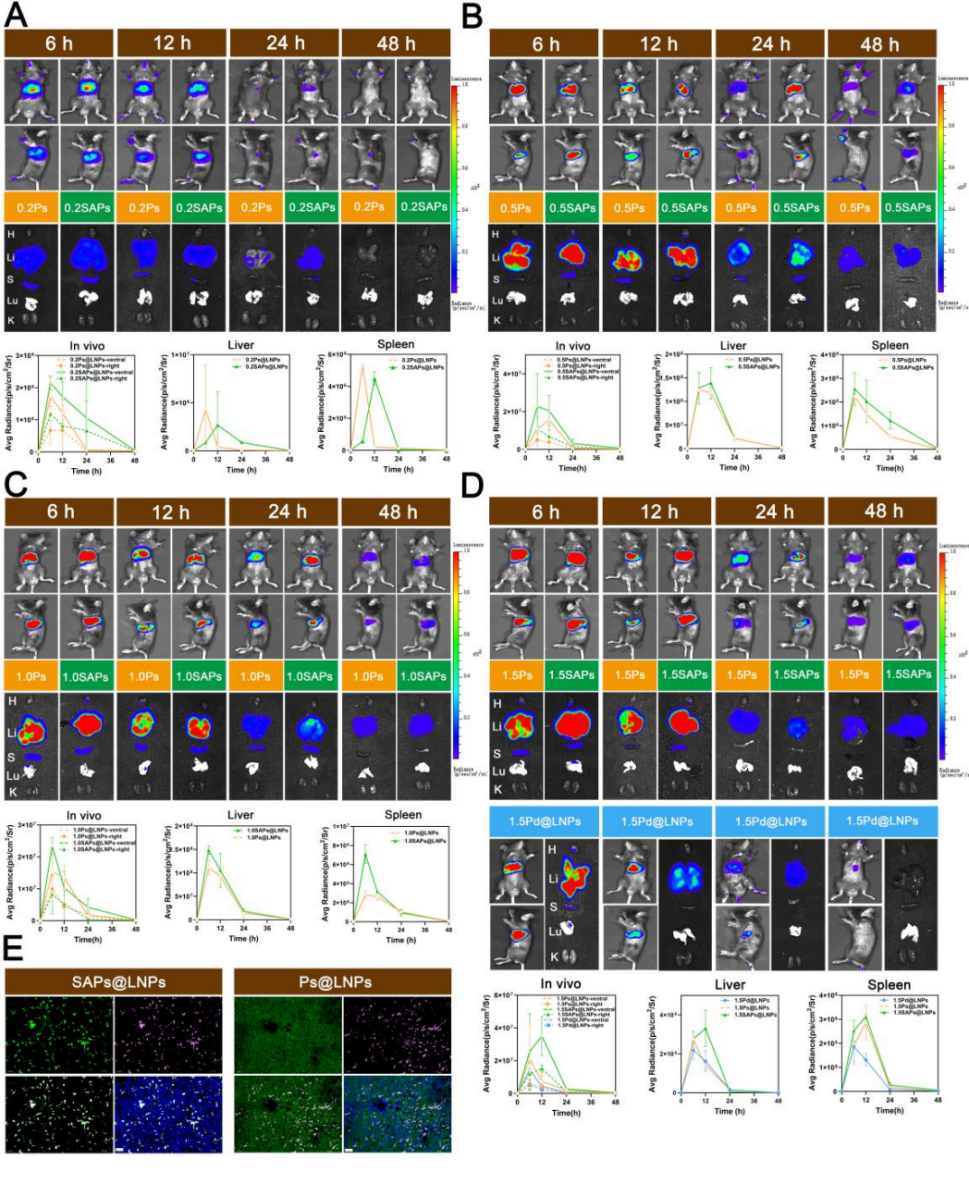
图3 静脉注射SA修饰LNPs的体内转染效率。
A-D) 静脉注射包裹Fluc mRNA的A) 0.2Ps@LNPs、0.2SAPs@LNPs、B) 0.5Ps@LNPs、0.5SAPs@LNPs、C) 1.0Ps@LNPs、1.0SAPs@LNPs、D) 1.5Ps@LNPs、1.5SAPs@LNPs和1.5Pd@LNPs后,在不同时间点(6、12、24、48小时)评估Fluc的全身表达水平及其在肝脏和脾脏的表达情况。
E) 静脉注射EGFP mRNA SAPs@LNPs和Ps@LNPs后24小时小鼠肝组织的免疫荧光成像。绿色荧光对应EGFP,粉色荧光对应巨噬细胞,蓝色荧光对应细胞核。比例尺=50 μm。
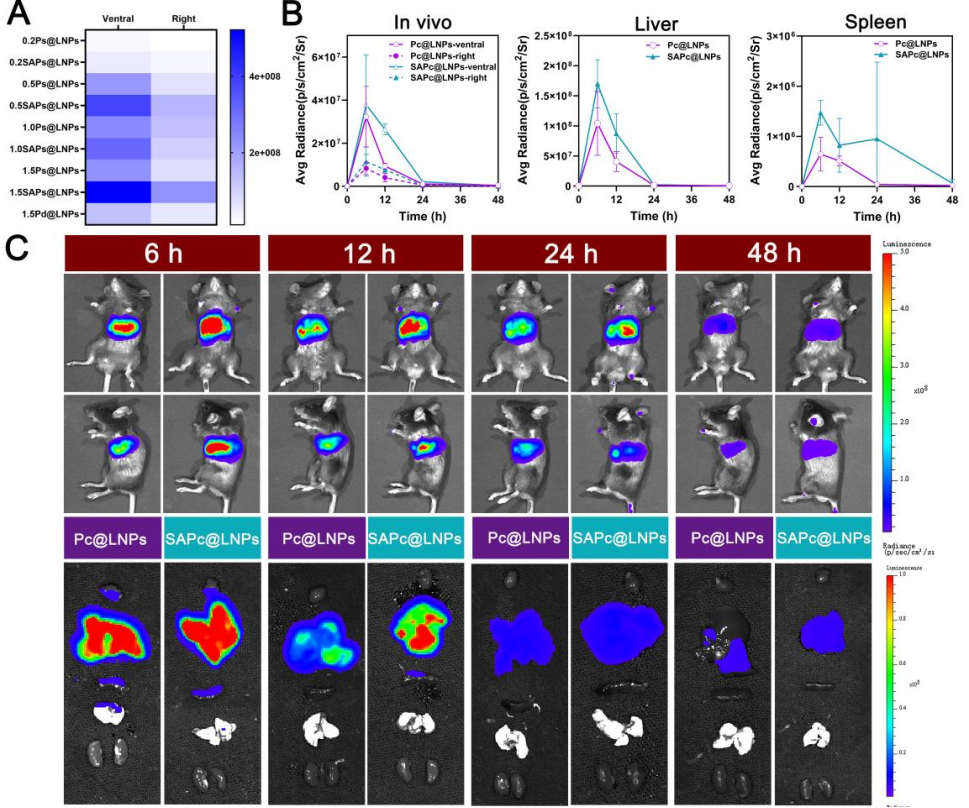
图4 静脉注射SA与不同可切割PEG-脂质共修饰LNPs的体内转染效率。
A) 0.2Ps@LNPs、0.2SAPs@LNPs、0.5Ps@LNPs、0.5SAPs@LNPs、1.0Ps@LNPs、1.0SAPs@LNPs、1.5Ps@LNPs、1.5SAPs@LNPs和1.5Pd@LNPs组体内Fluc表达的曲线下面积。
B-C) 静脉注射包裹Fluc mRNA、含有1.5% Pc的Pc@LNPs和SAPc@LNPs后,在不同时间点评估Fluc的全身表达水平及其在肝脏和脾脏的表达情况。
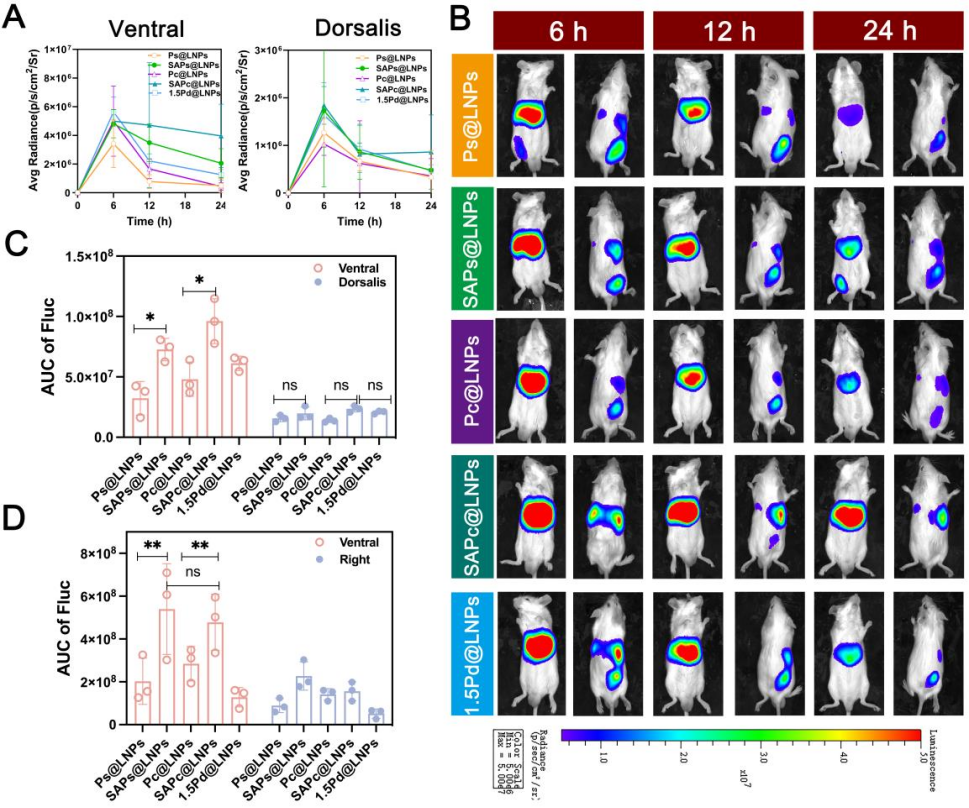
图5 SA与Ps或Pc共修饰LNPs在不同给药途径下的体内转染效果。
A) 肌肉注射Ps@LNPs、SAPs@LNPs、Pc@LNPs、SAPc@LNPs和1.5Pd@LNPs后体内Fluc表达的定量分析。
B) 肌肉注射后体内Fluc表达的活体成像。
C-D) 每种LNPs经C) 肌肉注射或D) 静脉注射后检测到的Fluc表达的AUC0-24小时。
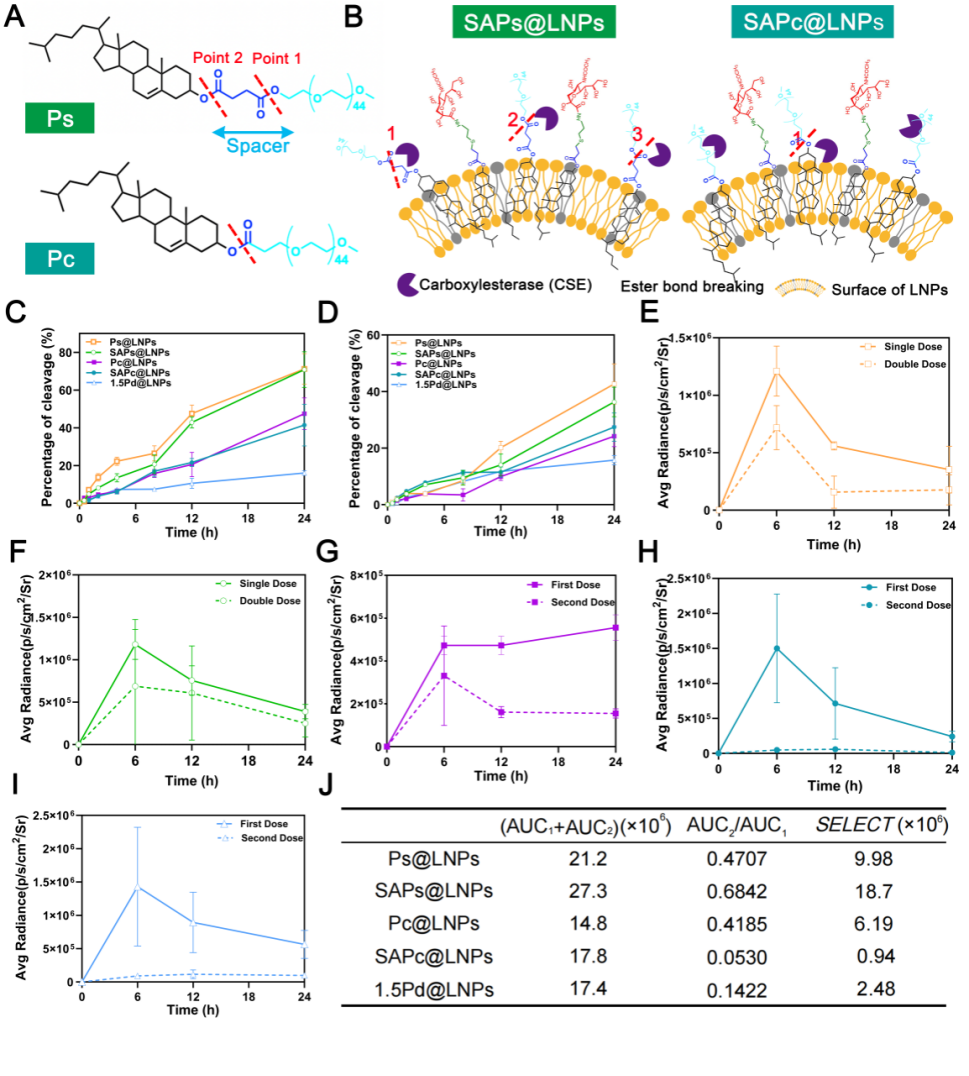
图6 各种可切割PEG-脂质的结构特性与其断裂速率或重复注射后转染效率的关系。
A) Ps和Pc的结构及可切割位点。
B) Ps和Pc在SAPs@LNPs和SAPc@LNPs最外层脂质双层中的分布。图中红色数字标记易于接触CSE的可切割位点。
C-D) Ps@LNPs、SAPs@LNPs、Pc@LNPs、SAPc@LNPs和1.5Pd@LNPs在C) 血清和D) 肌肉研磨液中的PEG脱落率。
E-I) 单次或重复注射E) Ps@LNPs、F) SAPs@LNPs、G) Pc@LNPs、H) SAPc@LNPs、I) 1.5Pd@LNPs后0-24小时Fluc的表达水平。
J) 各组的AUC第一次+AUC第二次、AUC第二次/AUC第一次及SELECT值。
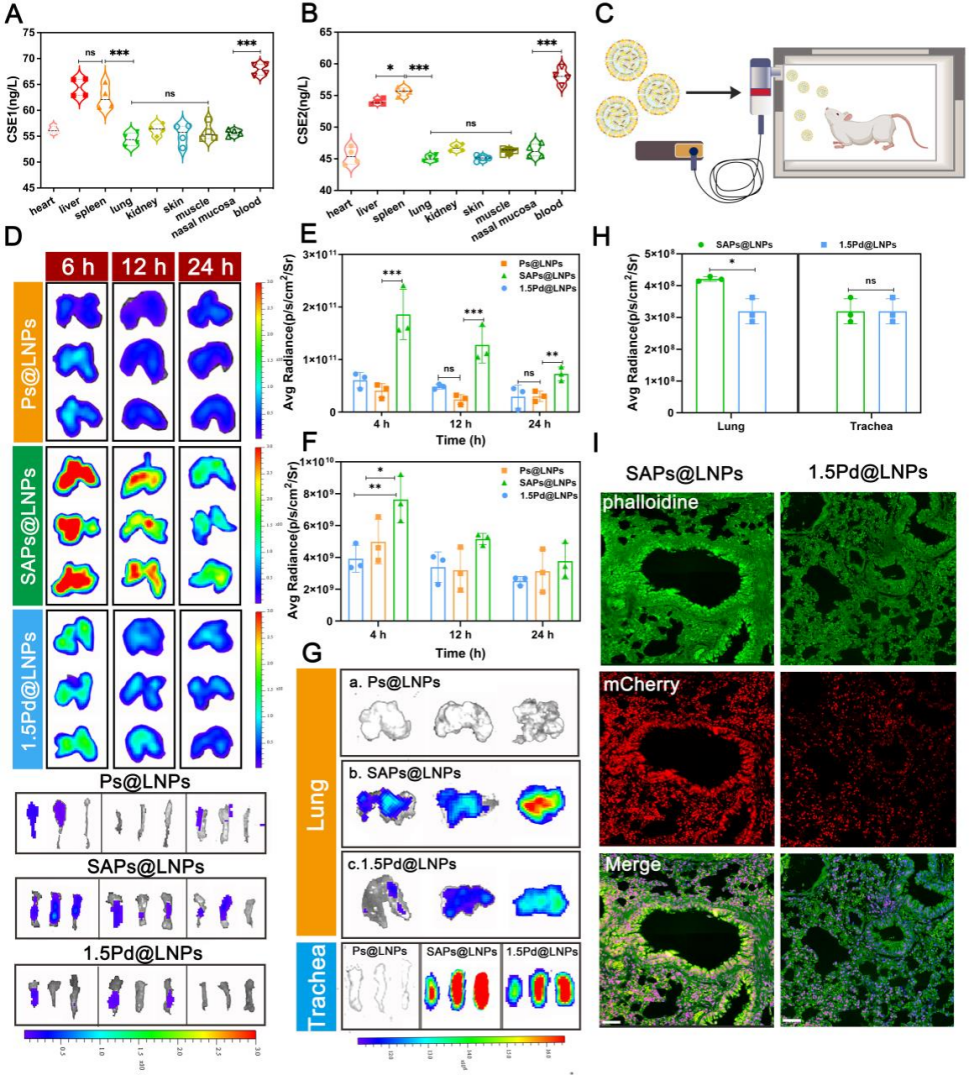
图7 经吸入递送的LNPs在肺和气管中的转染效率。
A-B) 主要器官和组织中A) CSE1和B) CSE2的表达水平。
C) 小鼠雾化LNPs递送装置示意图。
D) 吸入DiR标记的1.5Ps@LNPs、1.5SAPs@LNPs和1.5Pd@LNPs后6、12、24小时小鼠肺和气管的荧光图像。
E-F) 吸入后肺E) 和气管F) 的荧光定量分析。
G) 吸入各mCherry LNPs后24小时小鼠肺和气管的荧光图像。
H) 吸入后肺和气管的荧光定量分析。
I) 吸入mCherry mRNA LNPs后24小时小鼠肺的免疫荧光成像。绿色荧光代表鬼笔环肽染色的肺细胞骨架,红色荧光指示细胞表达的红色荧光蛋白。比例尺=50 μm。
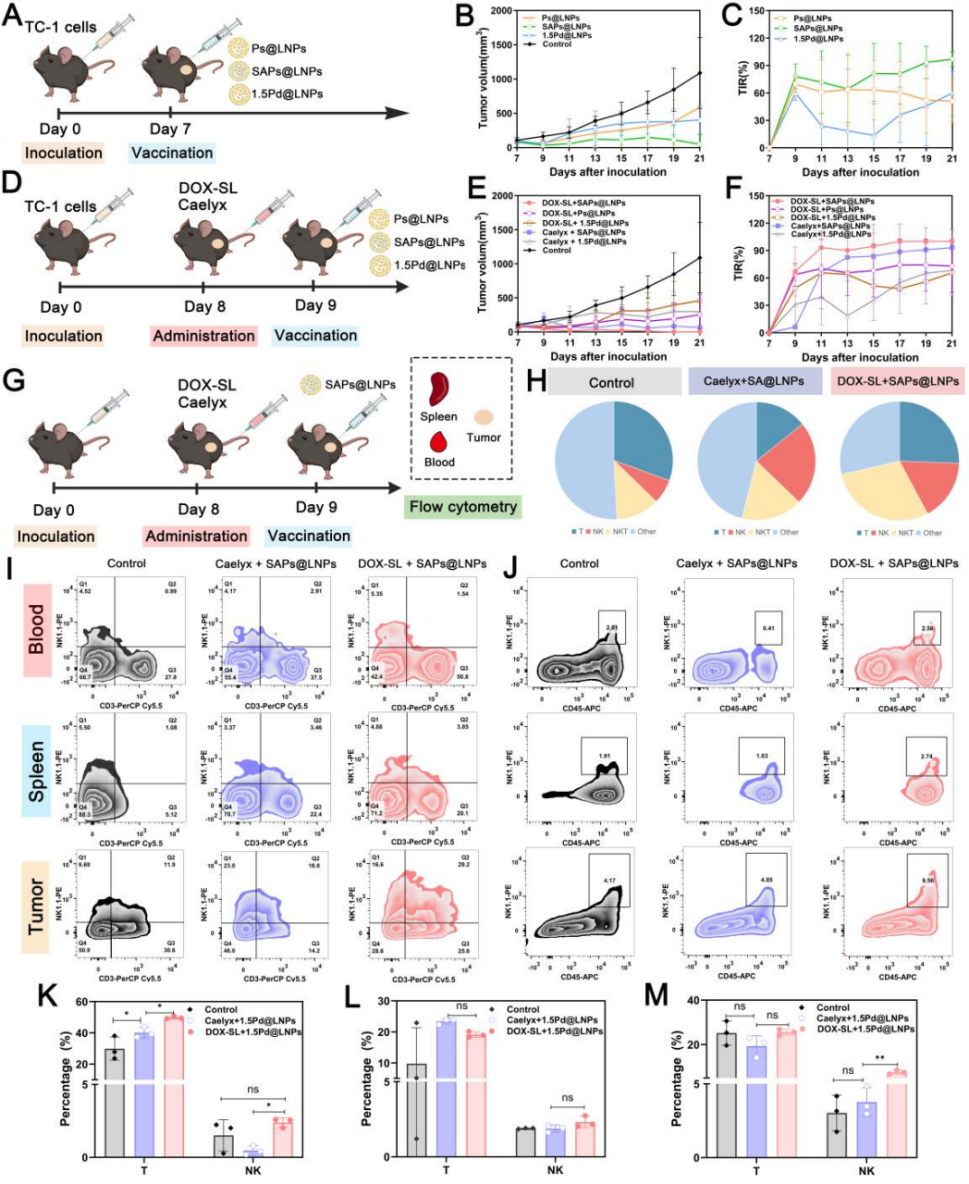
图8 SA修饰LNPs单独或与阿霉素脂质体联用的抗肿瘤效果。
A) Ps@LNPs、SAPs@LNPs和1.5Pd@LNPs疗效实验流程图。
B) 经E6E7 mRNA包裹的Ps@LNPs、SAPs@LNPs和1.5Pd@LNPs处理的小鼠TC-1肿瘤生长曲线。
C) 上述处理组的肿瘤抑制率。
D) DOX-SL/Caelyx与E6E7 mRNA包裹LNPs联合治疗疗效实验流程图。
E) 联合治疗下TC-1荷瘤小鼠的肿瘤生长曲线。
F) 联合治疗下的肿瘤抑制率。
G) DOX-SL+SAPs@LNPs和Caelyx+SAPs@LNPs组小鼠抗肿瘤免疫机制流程图。
H) 肿瘤中T细胞、NK细胞、NKT细胞及其他免疫细胞群占比的饼图。
I-J) 对照组、Caelyx+SAPs@LNPs和DOX-SL+SAPs@LNPs组小鼠血液/脾脏/肿瘤中I) T细胞比例和J) NK细胞比例的流程图。
K-M) 对照组、Caelyx+SAPs@LNPs和DOX-SL+SAPs@LNPs组小鼠K) 血液、L) 脾脏和M) 肿瘤中NK细胞和T细胞的比例。
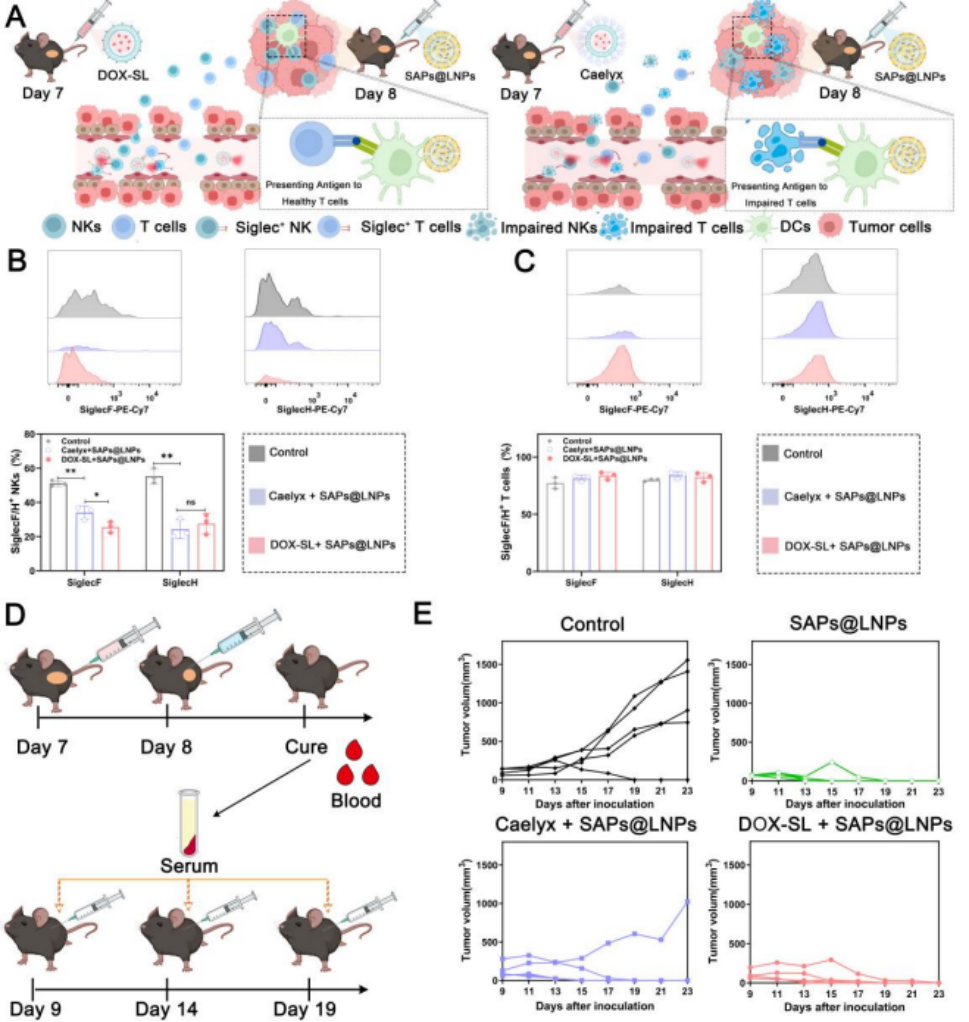
图9 各种阿霉素脂质体对SAPs@LNPs诱导的抗肿瘤免疫反应的影响与免疫环境的改变有关。
A) 不同阿霉素脂质体与免疫细胞体内相互作用的示意图。DOX-SL治疗选择性清除Siglec⁺ NK和T细胞,减轻对正常NK和T细胞的损害,并增强NK和T细胞向肿瘤的浸润。Caelyx给药导致NK和T细胞非选择性耗竭,降低其循环水平,损害SAPs@LNPs的抗肿瘤疗效。
B-C) 血液中B) SiglecF/H⁺ NK细胞和C) SiglecF/H⁺ T细胞的百分比。
D) 小鼠血清抗TC-1肿瘤实验治疗流程图。
E) 用对照组、SAPs@LNPs组、Caelyx+SAPs@LNPs组和DOX-SL+SAPs@LNPs组治愈小鼠血清治疗的TC-1荷瘤小鼠肿瘤生长曲线。
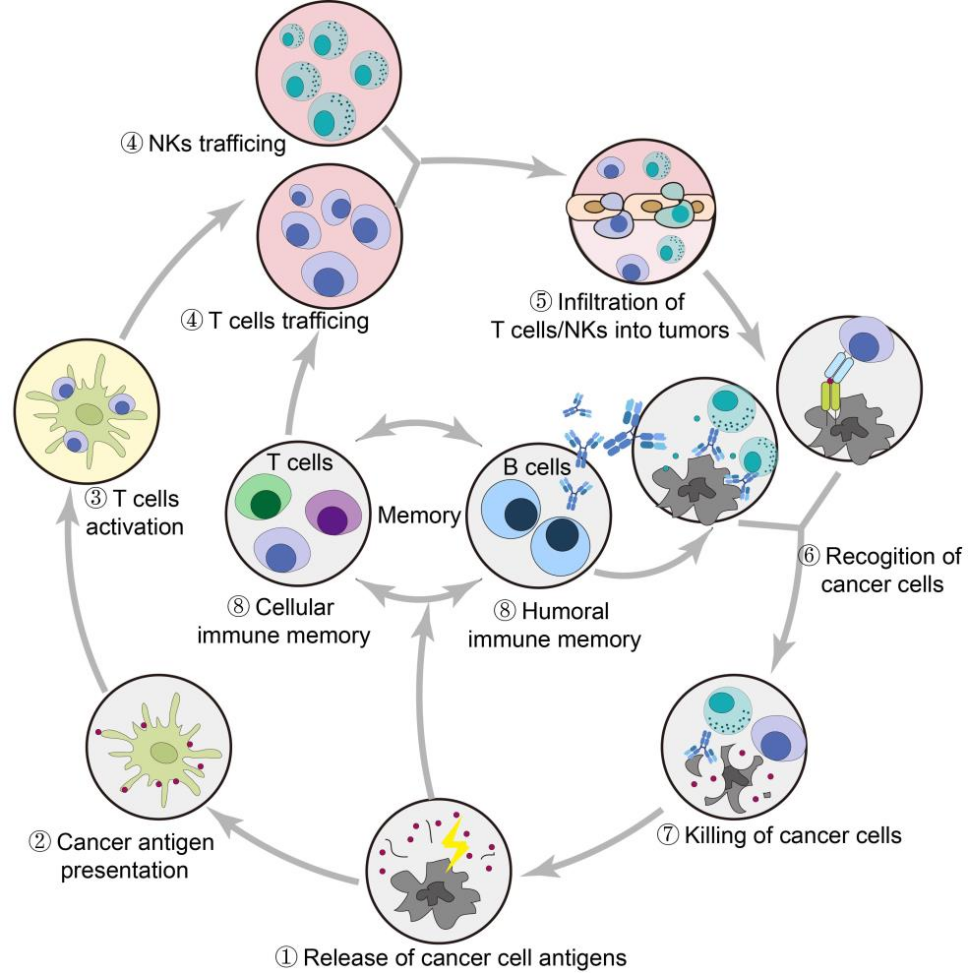
图10 图形摘要:ALE与PLE、普适性及增强的转染效率示意图。
1.SA修饰通过自主溶酶体逃逸(ALE)机制显著增强LNPs的转染效率
SA修饰能诱导细胞自发下调溶酶体生成,使超过90%的LNPs成功逃逸溶酶体,显著提高mRNA递送效率。
2.ALE机制的普适性
SA修饰的LNPs在静脉、肌肉和吸入等多种给药途径下均能有效增强转染效率,显示出广泛的应用潜力。
3.SELECT系统优化LNP筛选
新开发的SELECT系统能科学评估LNPs在多剂量给药下的整体转染性能,有助于筛选最优处方。
4.SAPs@LNPs在肿瘤治疗中的高效性
优化的SAPs@LNPs能100%治愈TC-1肿瘤,并能诱导持久的体液免疫记忆,激活NK细胞介导的ADCC效应。
5.化疗药物联用的差异性影响
SA修饰的阿霉素脂质体(DOX-SL)能选择性清除肿瘤相关免疫细胞(TAICs),与mRNA疫苗联用可加速肿瘤清除。而临床常用PEG化脂质体阿霉素(Caelyx)因非特异性细胞毒性会损害疫苗疗效,联用需谨慎。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:GL261 Red-FLuc 和 TRP-mCherry-FLuc 小鼠胶质母细胞瘤的荧光引导切除术
下一篇:CD70 导向异基因 CAR-NKT 细胞:转移性肾细胞癌(mRCC)的多模态治疗新策略