常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2026-01-15 09:00:00 细胞资源库平台 访问量:67
乙肝病毒(HBV)感染是全球主要公共卫生问题之一,有超过2.5亿人慢性感染HBV。而其中有超三分之一的人口集中在我国,人数接近1亿人。NTCP工具细胞,特别是外源表达NTCP的肝癌细胞系如HepG2-NTCP和Huh7-NTCP,因其易操作、短周期、重现性佳的特点,在乙肝病毒(HBV)研究中扮演着至关重要的角色。这些细胞模型能够有效模拟HBV的感染过程,为研究HBV的生命周期、宿主限制因子、病毒复制以及药物筛选提供了一个强大而便捷的体外平台。它们不仅有助于揭示HBV感染的分子机制,如DDX3作为宿主限制因子阻碍cccDNA转录,GPC5作为附着因子在感染入胞过程中的作用,还能通过直接与NTCP相互作用或下调NTCP表达来筛选和验证抗病毒药物的活性,例如环孢菌素A及其衍生物、雷帕霉素及其衍生物等。此外,这些工具细胞还促进了对HBV宿主特异性分子的发现,为发展支持HBV感染的小动物模型提供了可能,这对于乙肝相关研究和药物开发具有重大意义。
英文标题:Manganese is a potent inducer of lysosomal activity that inhibits de novo HBV infection
中文标题:锰通过诱导溶酶体活性抑制乙型肝炎病毒(HBV)新发感染
发表期刊:《PLOS Pathogens》
影响因子:4.9
作者单位:
1.Key Laboratory of Medical Molecular Virology (MOE/NHC/CAMS), Shanghai Institute of Infectious Disease and Biosecurity, School of Basic Medical Sciences, Fudan University, Shanghai, China
2.Shanghai Frontiers Science Center of Pathogenic Microorganisms and Infection, Fudan University, Shanghai, China
3.Department of Infectious Diseases, Shanghai Key Laboratory of Infectious Diseases and Biosafety Emergency Response, National Medical Center for Infectious Diseases, Huashan Hospital, Shanghai, China
4.Shanghai Institute of Materia Medica, Chinese Academy of Sciences, Shanghai, China
5.State Key Laboratory of Virology, College of Life Sciences, Wuhan University, Wuhan, China
作者信息:
Lin Yu¹,²、Hao Chang¹,²
乙型肝炎病毒(HBV)感染是全球公共卫生难题,钠牛磺胆酸共转运多肽(NTCP)已被确认为 HBV 入侵受体,但病毒内吞后的分子机制仍不明确。溶酶体作为内吞途径的关键细胞器,其在 HBV 感染中的作用存在争议,传统观点认为溶酶体是 HBV 感染的 “死胡同”,但缺乏直接证据。锰(Mn²⁺)作为金属离子,已被证实可激活 cGAS-STING 通路抗 DNA 病毒,但肝细胞中 STING 表达低下,其对 HBV 的作用及机制未知。本研究旨在探究 Mn²⁺对 HBV 感染的影响,揭示溶酶体活性在 HBV 早期感染中的调控作用,并筛选安全有效的抗病毒候选分子,为 HBV 治疗提供新靶点。
采用 HepG2-NTCP 细胞(稳定表达 NTCP 的肝癌细胞)、HepAD38 细胞(HBV 基因组整合细胞)及 ProliHH 类器官(人肝细胞来源的增殖型类器官)作为研究模型。以 MnCl₂(10-100 μM)和番茄碱(3-10 μM,天然甾体生物碱)为干预剂,通过 ELISA 检测 HBeAg/HBsAg 分泌、免疫印迹检测病毒蛋白(HBc、HBs)及信号分子(p-S6K、p-4E-BP1、LAMP1 等)、共聚焦显微镜观察 NTCP 内吞及溶酶体定位、电镜观察溶酶体结构、Southern blot 检测 HBV DNA 复制、溶酶体探针(LysoSensor、LysoTracker)评估溶酶体酸度及体积。通过 siRNA 沉默 ESCRT 复合体(HRS、TSG101)、溶酶体融合相关蛋白(VAMP7、STX7)及 mTORC1 通路分子,验证关键机制。数据采用 GraphPad Prism 分析,P<0.05 为差异有统计学意义。
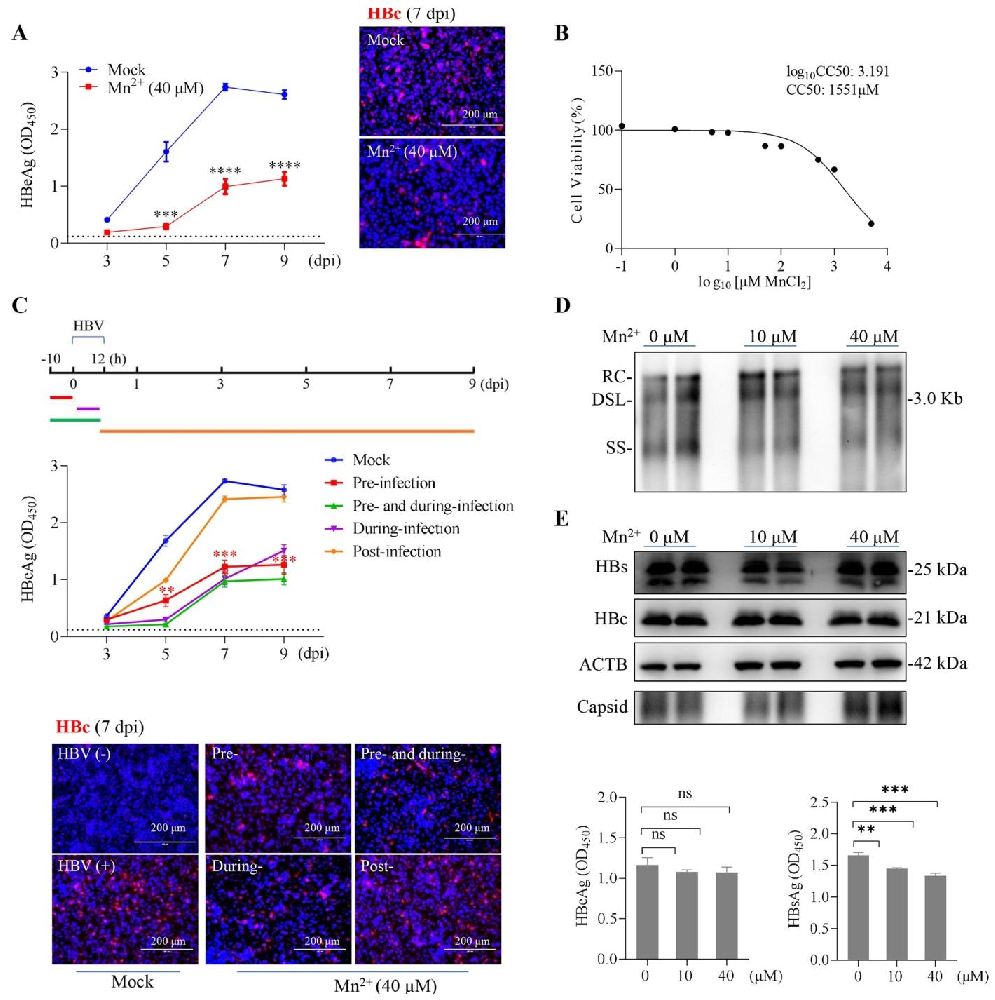
图1:MnCl₂抑制 HBV 新发感染但不影响病毒复制
MnCl₂(10-40 μM)可显著降低 HepG2-NTCP 细胞的 HBeAg 分泌和 HBc 表达(P<0.0001),且对细胞活力无影响(CC₅₀=1551 μM);时间依赖性实验显示,感染前预处理 MnCl₂的抗病毒效果最优,表明其作用于 HBV 感染早期(图 1A、C)。此外,MnCl₂不影响 HBV 质粒转染后的病毒 DNA 复制(RC、DSL、SS 型 DNA 无差异)及病毒粒子释放,仅轻微降低 HBsAg 分泌(图 1D、E),证实其特异性抑制病毒入侵而非复制阶段。
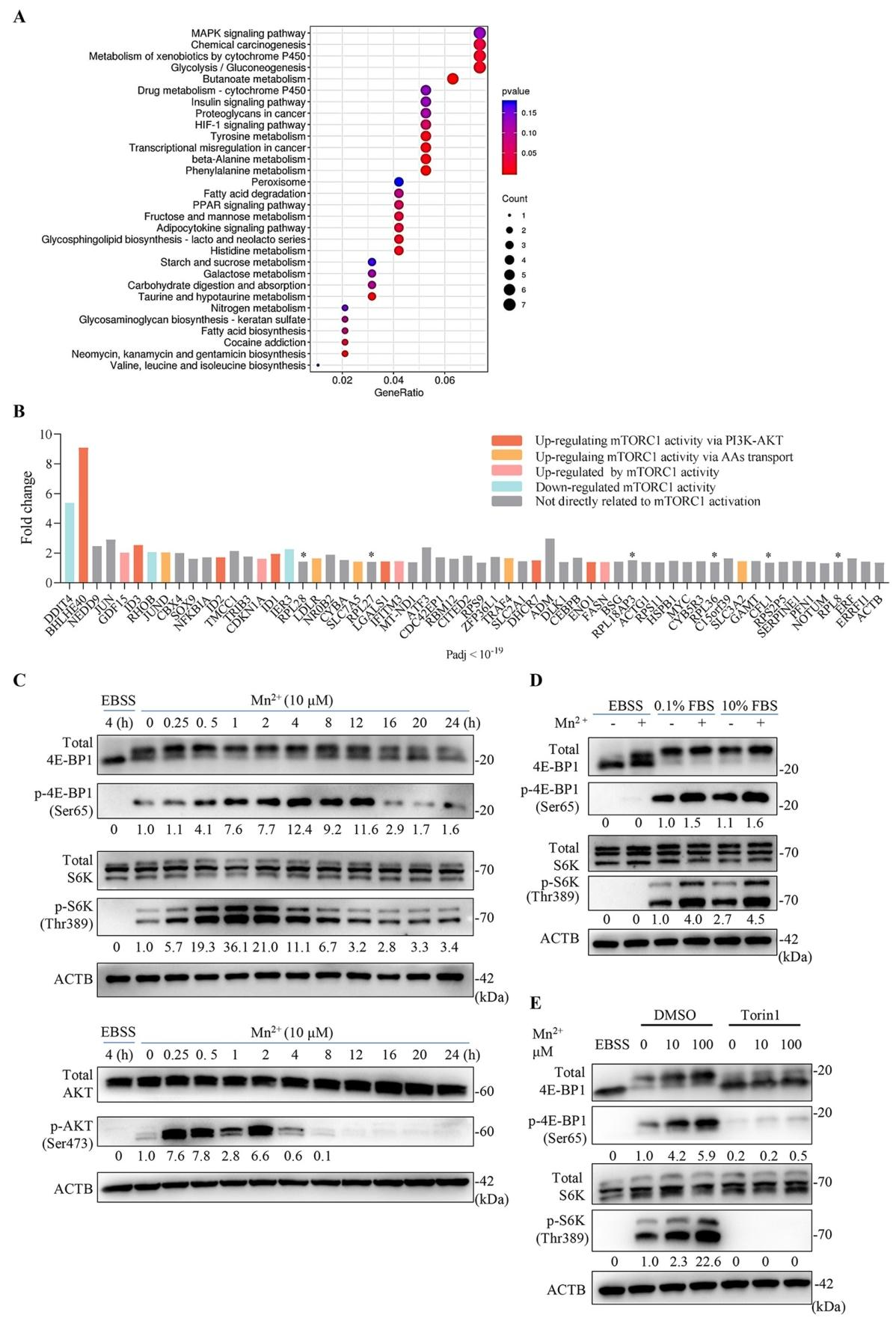
图2:Mn²⁺在营养充足条件下激活 mTORC1 通路
RNA-seq 显示,MnCl₂处理后差异基因富集于 mTORC1 相关代谢通路(图 2A、B);免疫印迹证实,MnCl₂可快速激活 mTORC1 下游靶点 p-S6K(1-2 h 达峰)和 p-4E-BP1(持续 8 h),同时诱导 AKT 磷酸化(图 2C)。氨基酸剥夺(EBSS 饥饿)可完全阻断 Mn²⁺对 mTORC1 的激活,而血清饥饿无影响;mTORC1 抑制剂 Torin1 可逆转该激活效应(图 2D、E),表明 Mn²⁺依赖氨基酸信号激活 mTORC1。
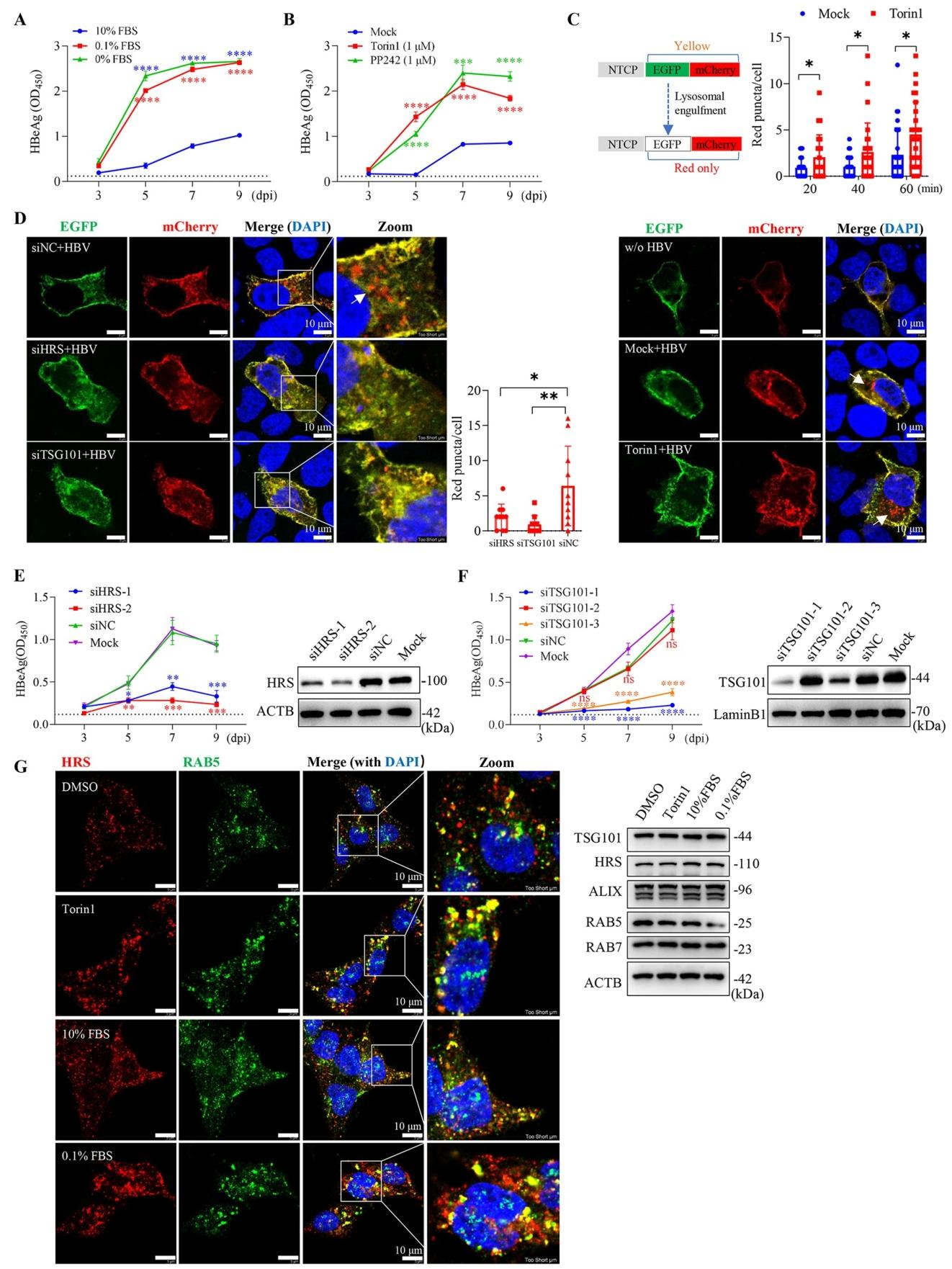
图3:mTORC1 失活促进 HBV 感染
血清饥饿或 Torin1/PP242 抑制 mTORC1 后,HBeAg 分泌和 HBc 表达显著升高(P<0.001)(图 3A、B);NTCP-EGFP-mCherry 融合蛋白实验显示,Torin1 可加速 HBV 诱导的 NTCP 内吞及酸性内体定位(红色 puncta 增多)(图 3C)。沉默 ESCRT 复合体亚基 HRS 或 TSG101,可阻断 NTCP 内吞和 HBV 感染(图 3D、E、F);Torin1 处理或血清饥饿可促进 HRS 与早期内体标记 RAB5 共定位(图 3G),证实 mTORC1 通过调控 ESCRT 介导的内吞转运影响 HBV 感染。
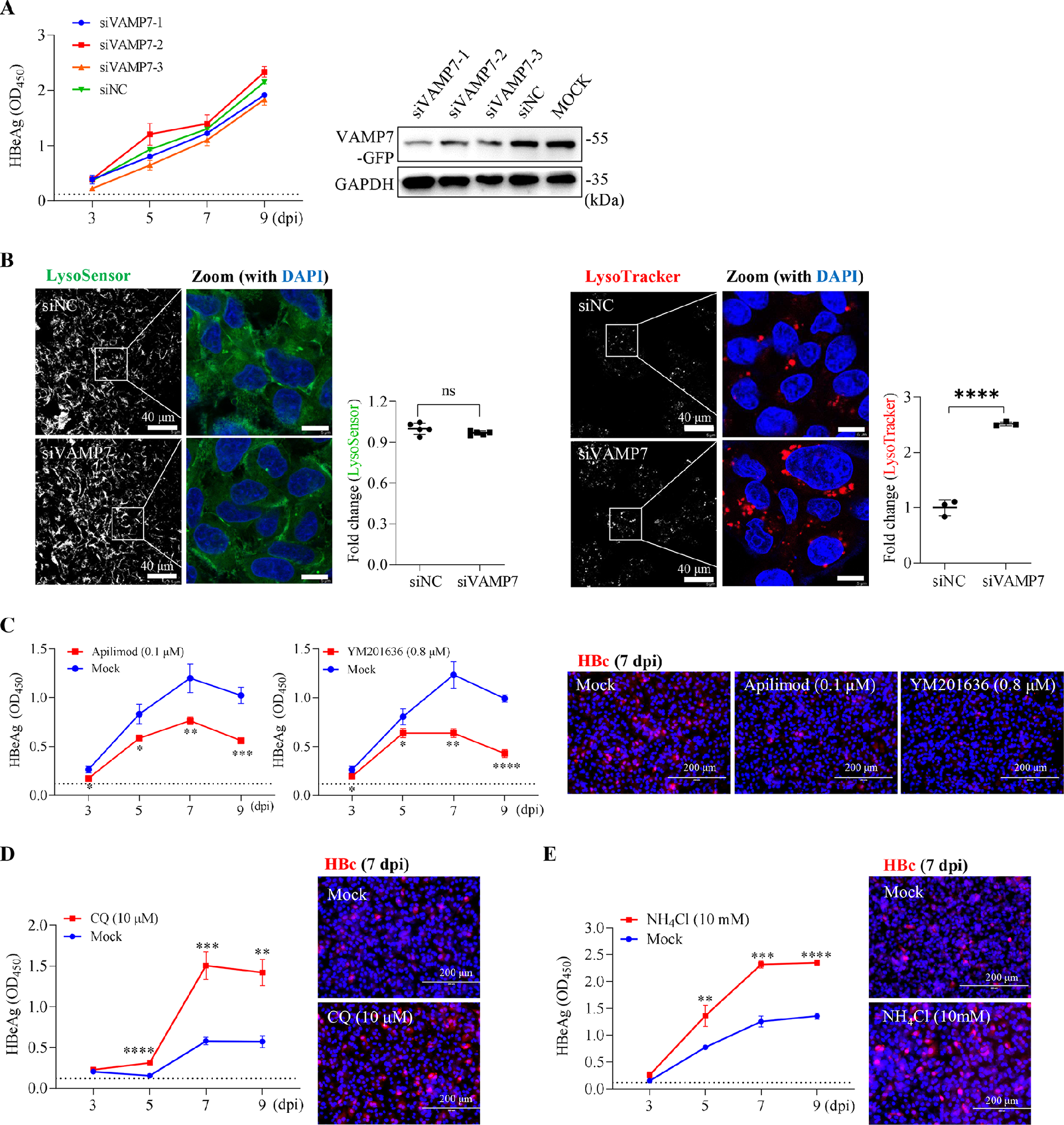
图4:HBV 感染不需要内体 - 溶酶体融合
沉默溶酶体融合关键蛋白 VAMP7 或 STX7,可阻断晚期内体 - 溶酶体融合(LysoSensor 阳性结构减少),但不影响 HBV 感染(图 4A、B);PIKfyve 抑制剂(Apilimod、YM201636)抑制溶酶体 “分离” 过程,反而显著抑制 HBV 感染(图 4C);溶酶体抑制剂(氯喹 CQ、NH₄Cl、BafA1)升高内体 pH,可显著增强 HBV 感染(图 4D、E)。表明 HBV 无需溶酶体融合即可完成感染,溶酶体酸性环境反而不利于病毒存活。
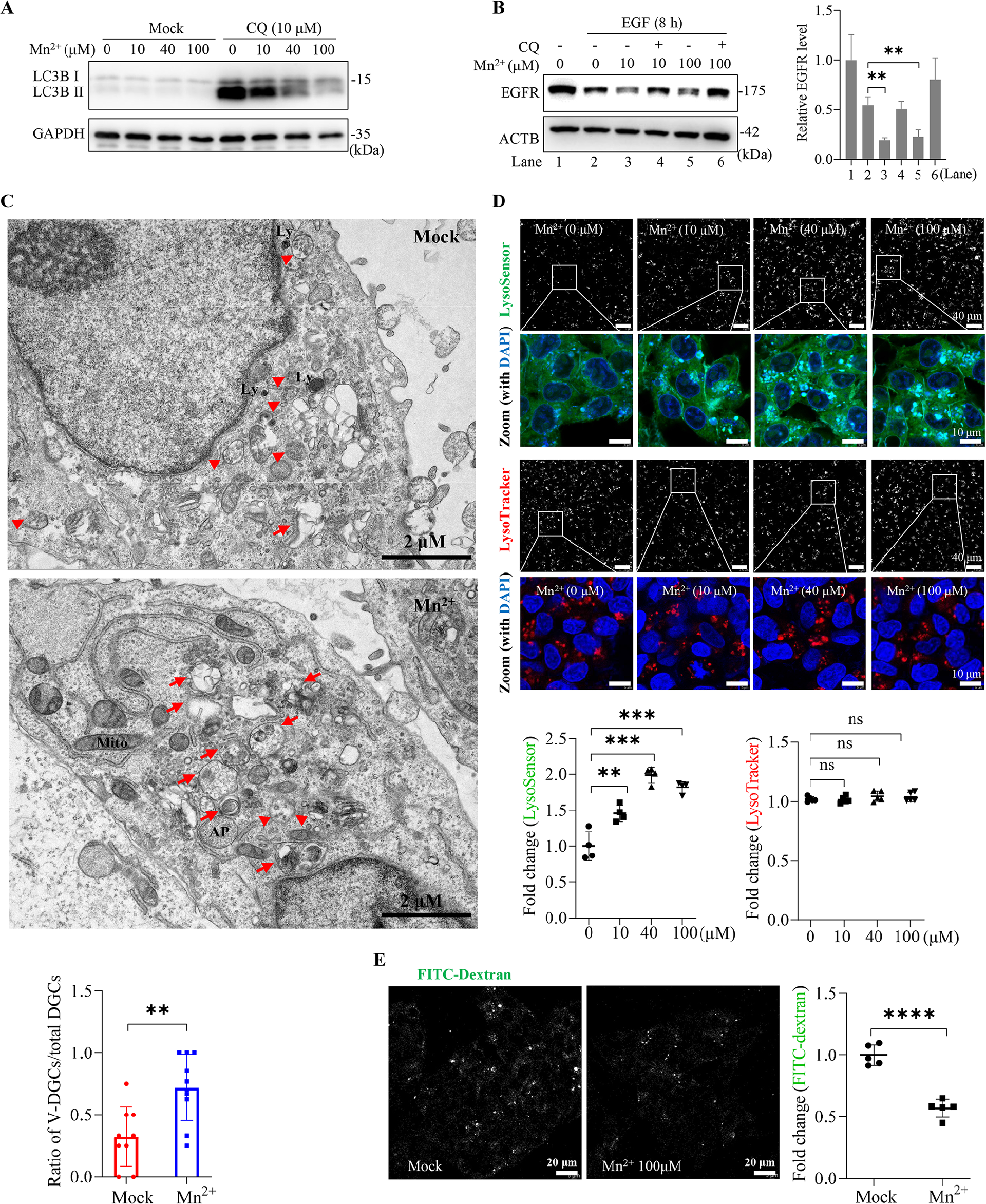
图5:Mn²⁺增强溶酶体活性及酸化
MnCl₂可剂量依赖性逆转氯喹诱导的 LC3-II 积累,促进 EGFR 降解(图 5A、B);电镜显示,MnCl₂处理后细胞内空泡样降解结构(v-DGCs)增多(图 5C);LysoSensor 探针检测显示,MnCl₂显著升高溶酶体酸度(荧光增强),而 LysoTracker(泛酸性结构标记)无明显变化(图 5D);FITC - 葡聚糖实验证实,MnCl₂处理后溶酶体淬灭效应增强,进一步验证溶酶体酸化(图 5E)。此外,MnCl₂不影响 LAMP1 和组织蛋白酶 D(CTSD)表达,表明其不促进溶酶体新生,仅增强现有溶酶体功能。
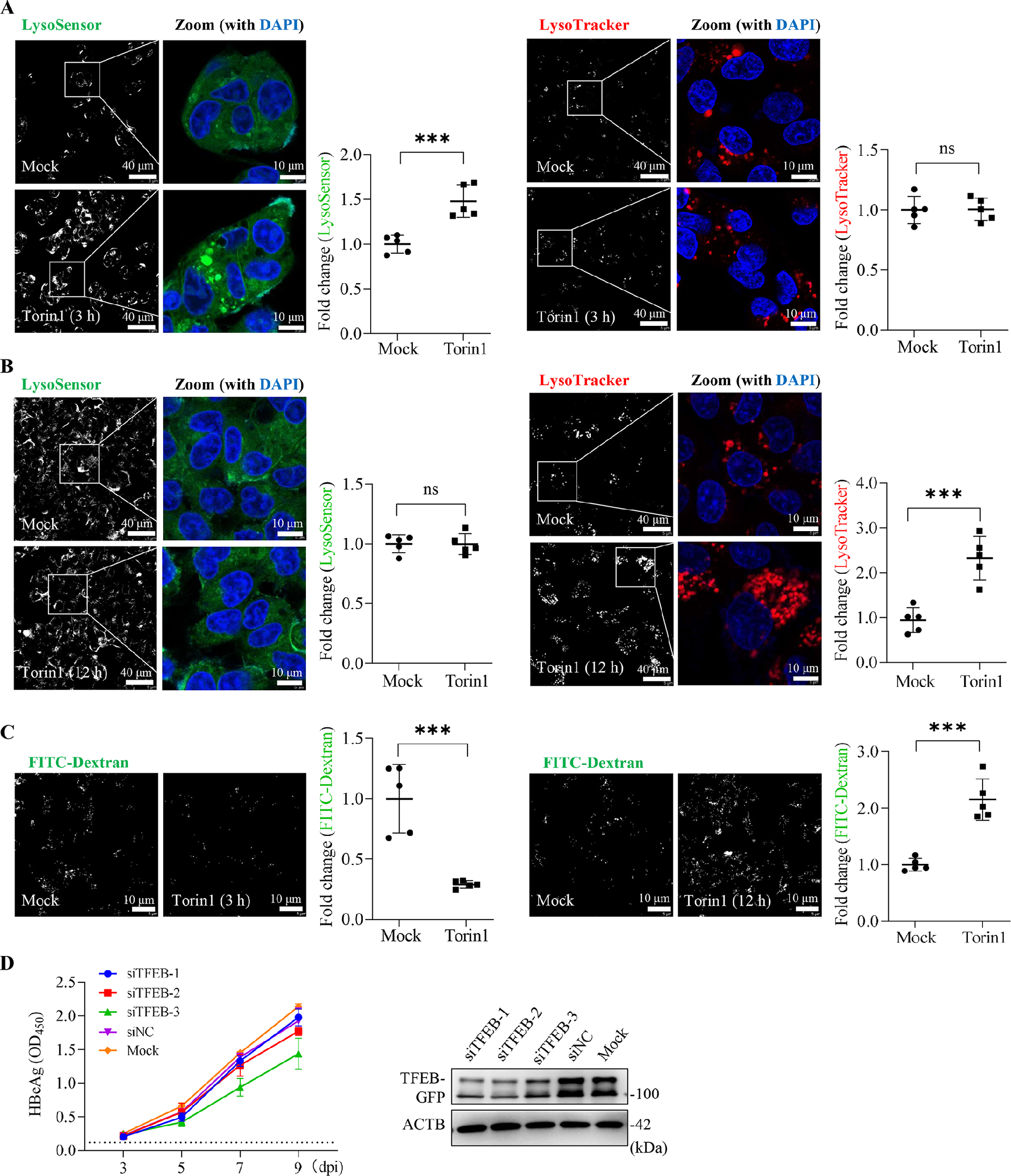
图6:持续抑制 mTORC1 导致溶酶体功能障碍
Torin1 处理 3 h 时,LysoSensor 荧光增强(溶酶体酸化);处理 12 h 后,LysoTracker 荧光升高但 LysoSensor 无变化,FITC - 葡聚糖淬灭效应减弱(图 6A、B、C),表明持续 mTORC1 抑制会耗尽溶酶体功能。沉默溶酶体新生关键转录因子 TFEB,不影响 HBV 感染(图 6D),证实 mTORC1 通过调控溶酶体功能而非新生影响 HBV 感染。
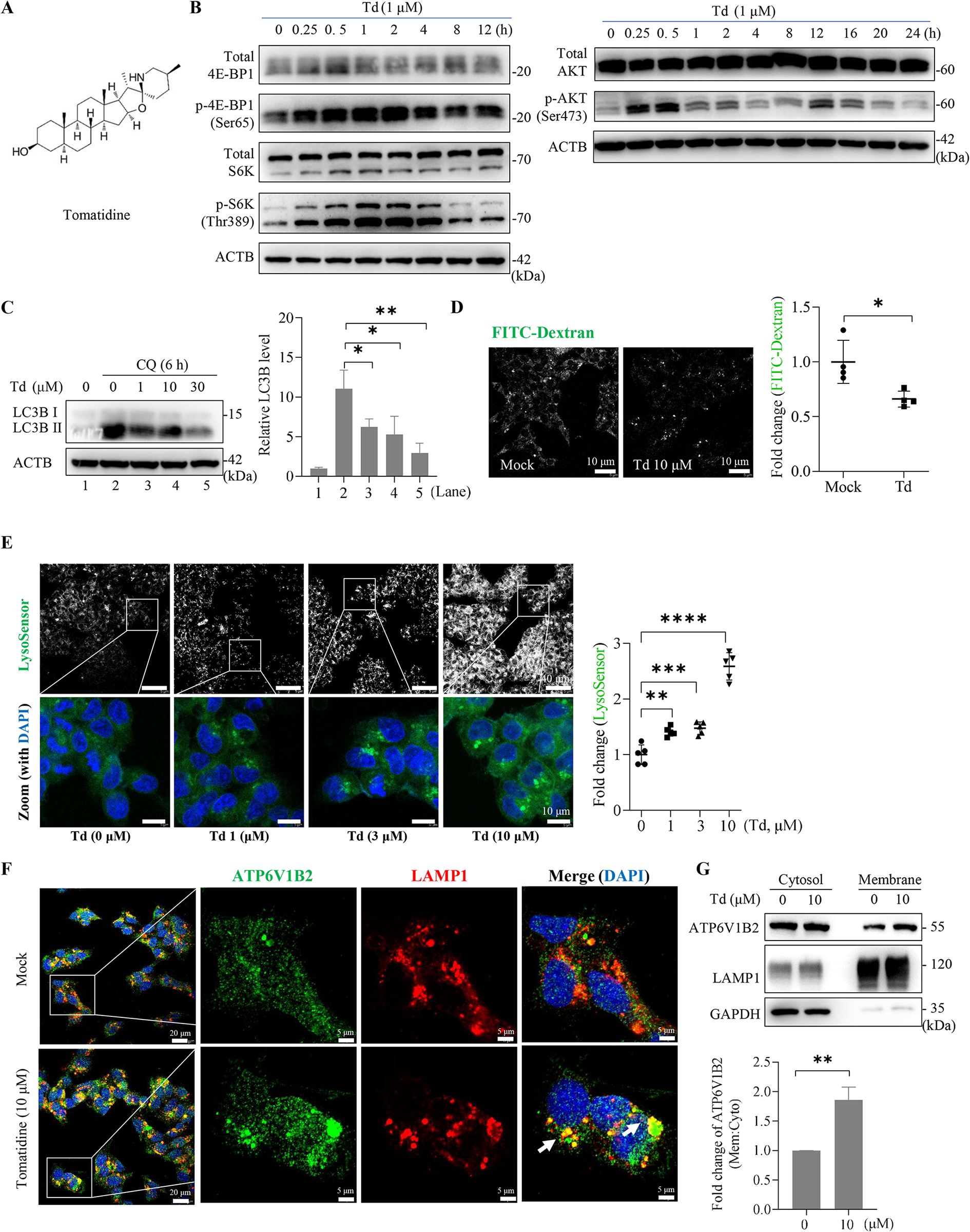
图7:番茄碱模拟 Mn²⁺激活 mTORC1 并增强溶酶体酸化
番茄碱(Td)可激活 mTORC1(p-S6K、p-4E-BP1 升高)和 AKT 磷酸化(图 7B),剂量依赖性逆转氯喹诱导的 LC3-II 积累(图 7C);LysoSensor 探针和 FITC - 葡聚糖实验显示,番茄碱显著增强溶酶体酸化(图 7D、E)。机制上,番茄碱可促进溶酶体 v-ATPase 复合体(V₁亚基 ATP6V1B2 与 V₀亚基)组装,增强质子泵活性(图 7F、G),而 Mn²⁺无此效应,表明两者增强溶酶体功能的机制存在差异。
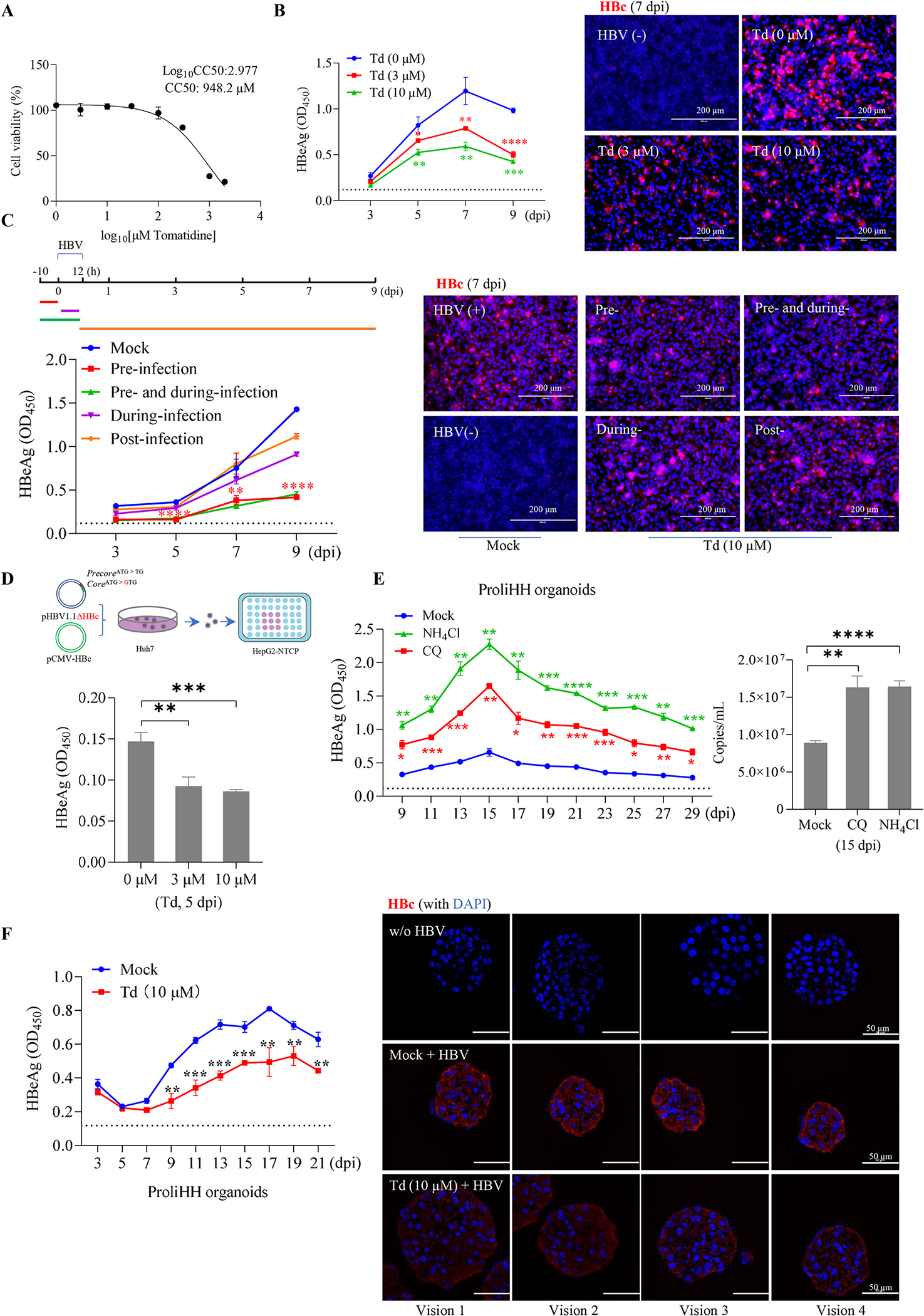
图8:番茄碱在细胞和类器官中抑制 HBV 感染
番茄碱细胞毒性低(CC₅₀=948.2 μM),3-10 μM 可显著降低 HepG2-NTCP 细胞的 HBeAg 分泌和 HBc 表达(P<0.001),感染前预处理效果最优(图 8A、B、C);对复制缺陷型 HBV 重组病毒也有抑制作用,证实其作用于感染早期(图 8D)。在 ProliHH 类器官中,溶酶体抑制剂(CQ、NH₄Cl)可增强 HBV 感染,而番茄碱可显著抑制 HBeAg 分泌和 HBc 表达,且类器官体积更大(图 8E、F),证实其在接近生理环境的模型中仍有效。
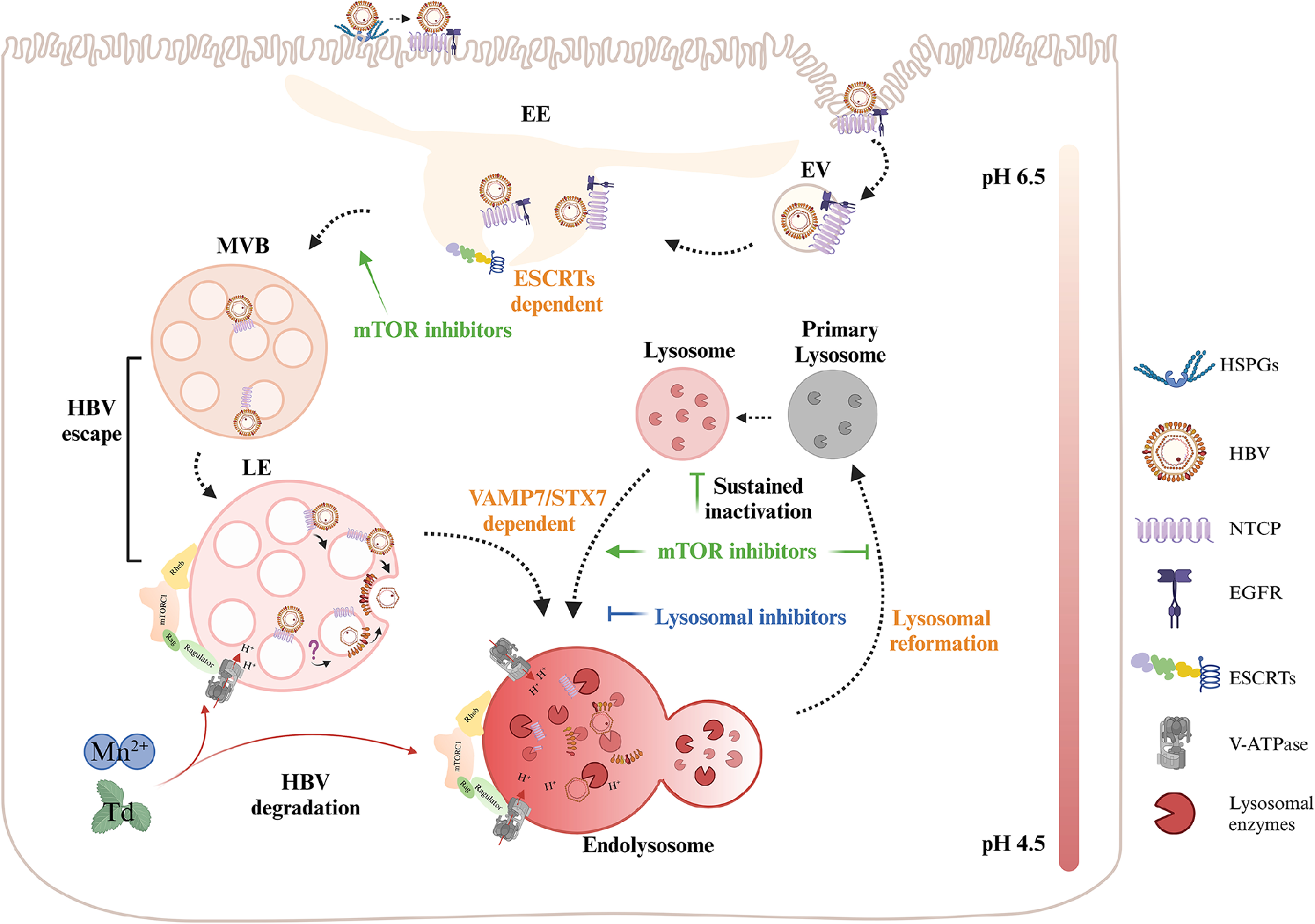
图9:HBV 早期感染调控机制示意图
HBV 与 NTCP 结合后,通过 ESCRT 复合体介导内吞进入晚期内体,病毒从晚期内体直接逃逸至胞质(无需溶酶体融合);Mn²⁺或番茄碱激活 mTORC1,增强溶酶体酸化和降解功能,破坏病毒逃逸;持续抑制 mTORC1 会导致溶酶体功能耗竭,加速内体转运,促进 HBV 感染(图 9)。
本研究首次揭示溶酶体活性是 HBV 早期感染的关键调控靶点:1)Mn²⁺和天然产物番茄碱通过激活 mTORC1 通路,增强溶酶体酸化和降解功能,抑制 HBV 新发感染;2)HBV 内吞后依赖 ESCRT 复合体进入晚期内体,从晚期内体直接逃逸至胞质,无需内体 - 溶酶体融合;3)mTORC1 失活会导致溶酶体功能障碍,加速内体转运,反而促进 HBV 感染;4)番茄碱作为安全的天然化合物,在肝细胞类器官中仍具有抗病毒活性,为 HBV 治疗提供新候选分子。该研究明确了溶酶体在 HBV 感染中的负向调控作用,为开发靶向溶酶体功能的抗病毒策略奠定基础。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:靶向 B7-H3 的嵌合抗原受体 T 细胞在结直肠癌类器官和肝异种移植模型中的显著细胞毒性研究
下一篇:GL261 Red-FLuc 和 TRP-mCherry-FLuc 小鼠胶质母细胞瘤的荧光引导切除术