常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2026-01-14 17:07:16 细胞资源库平台 访问量:53
结直肠癌(CRC)是全球第三大常见癌症及第二大癌症相关死亡原因,约 50% 的患者会发生不可治愈的远处转移,现有靶向治疗和免疫治疗对晚期患者的疗效有限。CAR-T 细胞疗法在血液肿瘤中疗效显著,但在实体瘤中因缺乏特异性肿瘤抗原、肿瘤浸润不足等问题应用受限。B7-H3(CD276)作为免疫检查点分子,在多种实体瘤中高表达,且与肿瘤进展和免疫逃逸相关,被认为是 CRC 的潜在治疗靶点。本研究旨在开发靶向 B7-H3 的 CAR-T 细胞疗法,通过体外和体内实验验证其对转移性 CRC 的疗效及转化潜力。
来自南方科技大学、北京大学深圳医院的团队在《British Journal of Cancer》期刊发表了题为The pronounced cytotoxic effects of chimeric antigen receptor T cells targeting B7-H3 in organoids and liver xenografts derived from colorectal cancer patients的研究。
靶点验证:通过免疫组化(IHC)和流式细胞术分析 170 例 CRC 患者肿瘤组织及细胞系中 B7-H3 的表达;
CAR-T 构建:利用抗 B7-H3 单链抗体(scFv)构建含 CD28 共刺激域的 B7-H3 CAR-T,以 CD19 CAR-T 为对照;
体外实验:评估 B7-H3 CAR-T 对 CRC 细胞系(SW620、HCT116 等)和患者来源类器官(PDOs)的细胞毒性及细胞因子(IFN-γ、IL-2、TNF-α)释放;
体内实验:建立 CRC 细胞系异种移植模型(HT29、HCT116)和患者来源异种移植(PDX)肝转移模型,通过生物发光成像、超声监测肿瘤生长,评估 CAR-T 的抗肿瘤效果及生存延长作用;
机制探索:对 PDX 肿瘤组织进行 RNA-seq,分析差异基因及富集通路。
B7-H3 在 CRC肿瘤组织中显著高表达,170 例患者的 IHC 结果显示肿瘤组织 B7-H3 的免疫反应评分(IRS)显著高于癌旁组织,且 5 种 CRC 细胞系(SW620、HCT116 等)均高表达 B7-H3;
体外实验中,B7-H3 CAR-T 对 CRC 细胞系和 PDOs 均表现出剂量依赖性细胞毒性,E:T 比例 2:1 时杀伤效果最显著,同时释放高浓度 IFN-γ、IL-2 和 TNF-α,而 CD19 CAR-T 无明显杀伤作用;
体内异种移植模型中,B7-H3 CAR-T 显著抑制 HT29 和 HCT116 细胞的转移,66.67% 的小鼠在观察终点无肿瘤残留,且生存期显著延长(HT29 模型生存率 57% vs 对照组 0%),无明显肝肾功能损伤;
PDX 肝转移模型中,B7-H3 CAR-T 使 50%(8/16)的小鼠达到完全缓解,肿瘤组织出现大量细胞死亡和炎症细胞浸润,RNA-seq 显示免疫相关通路(如干扰素信号、TCR 信号)显著激活。
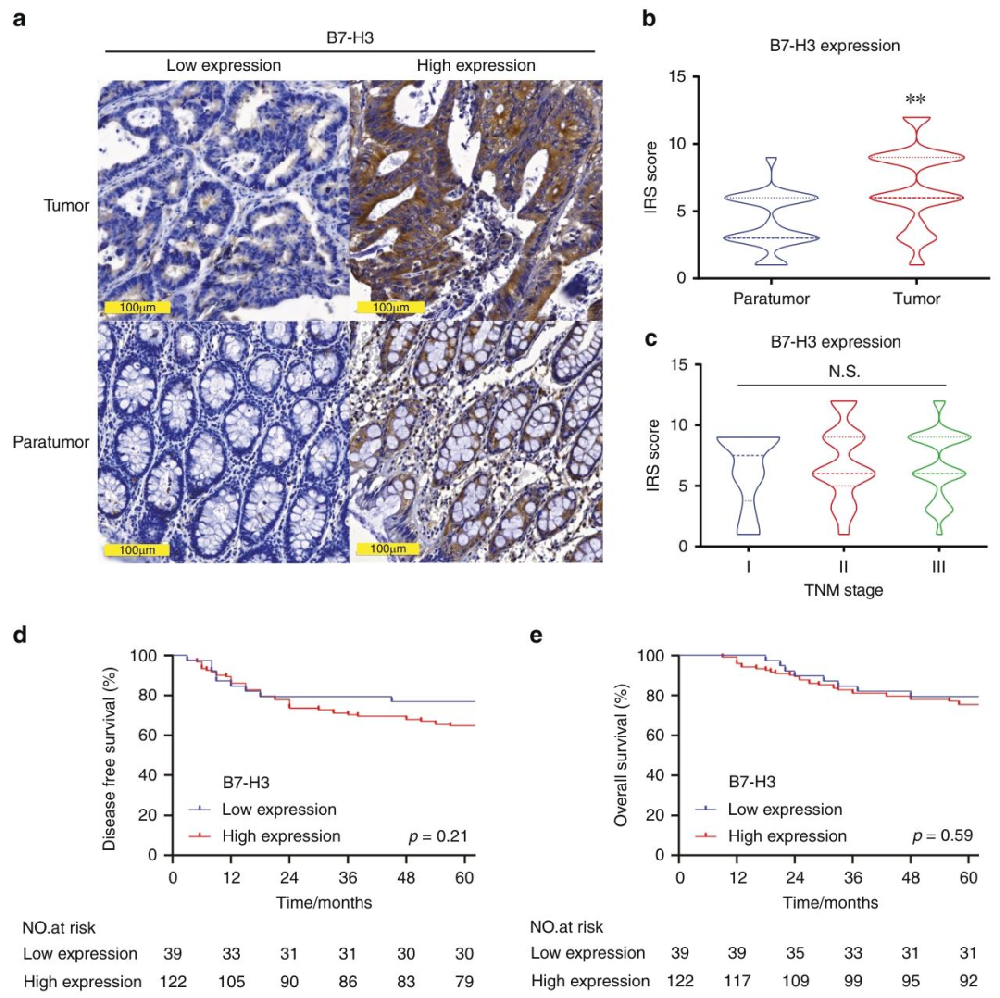
图 1:B7-H3 在 CRC 中的高表达
内容:(A)CRC 肿瘤和癌旁组织的 B7-H3 IHC 染色代表性图像,肿瘤组织呈棕褐色阳性染色,癌旁组织染色较弱,比例尺 100μm;(B)肿瘤与癌旁组织的 IRS 评分对比,肿瘤组织显著更高(p<0.01);(C)不同 TNM 分期中 B7-H3 的 IRS 评分,组间无显著差异(N.S.);(D-E)Kaplan-Meier 曲线显示 B7-H3 高 / 低表达组的无病生存率和总生存率,组间无显著差异(p=0.21、p=0.59)。

图 2:B7-H3 CAR-T 在体外靶向 CRC 细胞
内容:(A)流式细胞术检测 5 种 CRC 细胞系的 B7-H3 表达,均呈高阳性;(B-C)不同 E:T 比例(1:2、1:1、2:1)共培养后,B7-H3 CAR-T 组的存活肿瘤细胞数量显著少于 CD19 CAR-T 组,且随 E:T 比例升高杀伤增强;(D-F)ELISA 检测显示 B7-H3 CAR-T 组释放的 IFN-γ、IL-2、TNF-α 浓度显著高于对照组,以 SW620 和 HCT116 细胞共培养组最明显。
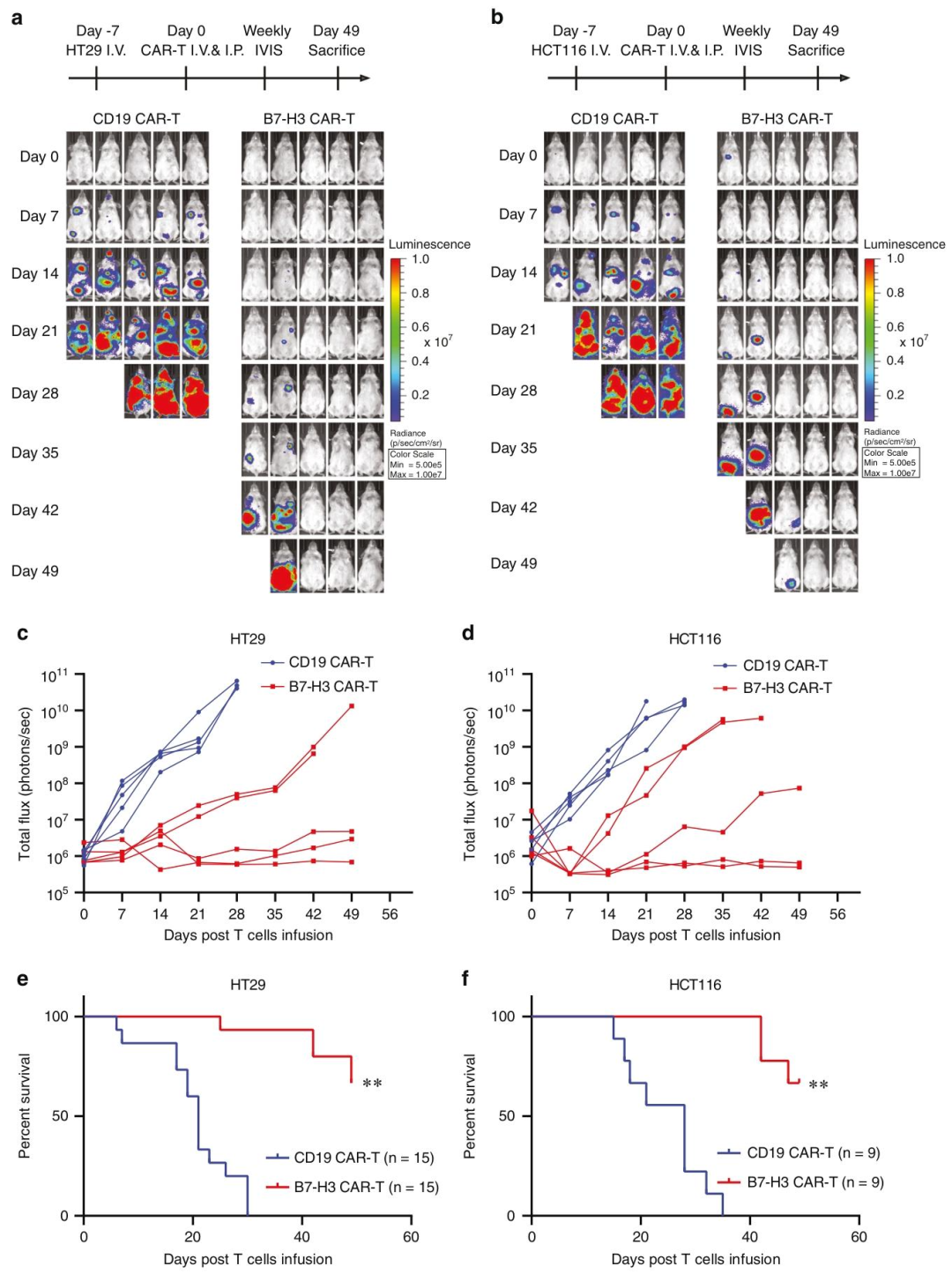
图 3:B7-H3 CAR-T 抑制体内转移性 CRC
内容:(A-B)HT29 和 HCT116 细胞静脉接种的转移模型治疗方案(第 7 天静脉 + 腹腔注射 CAR-T)及生物发光成像,B7-H3 CAR-T 组随时间荧光信号逐渐减弱,对照组持续增强;(C-D)肿瘤总通量(光子 / 秒)动力学曲线,B7-H3 CAR-T 组显著低于对照组;(E-F)生存曲线显示 B7-H3 CAR-T 组小鼠生存期显著延长(p<0.01)。
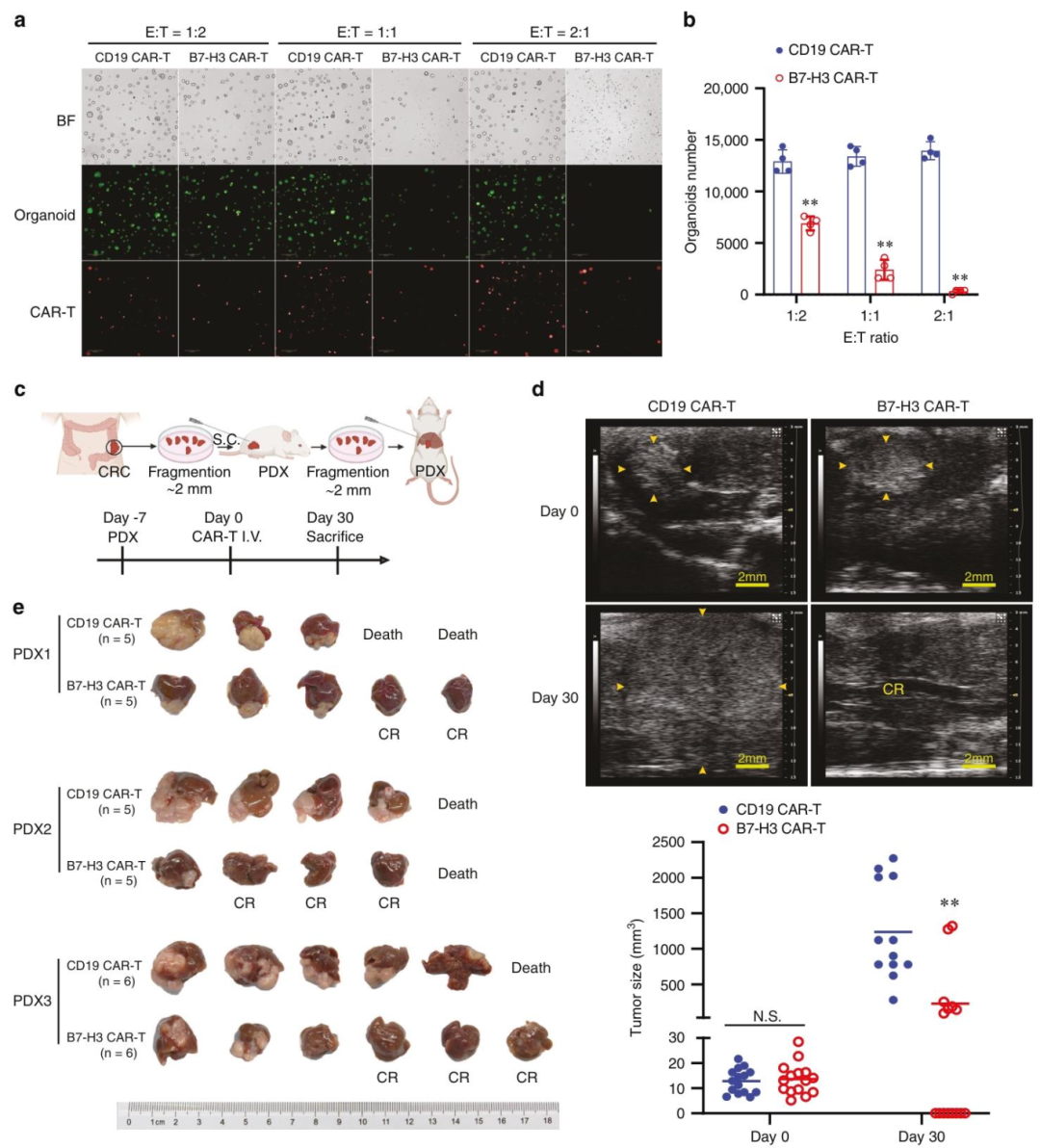
图 4:B7-H3 CAR-T 靶向患者来源模型
内容:(A-B)CRC PDOs 与 CAR-T 共培养的免疫荧光图像(绿色为活类器官,红色为 CAR-T 细胞)及定量,B7-H3 CAR-T 组残留类器官数量随 E:T 比例升高显著减少;(C)PDX 肝转移模型构建流程:肿瘤组织皮下接种→肝内移植→CAR-T 静脉注射;(D)超声成像显示 B7-H3 CAR-T 组肝内肿瘤体积显著小于对照组,完全缓解率 50%;(E)治疗后小鼠肝脏及肿瘤照片,B7-H3 CAR-T 组肿瘤明显缩小或消失。
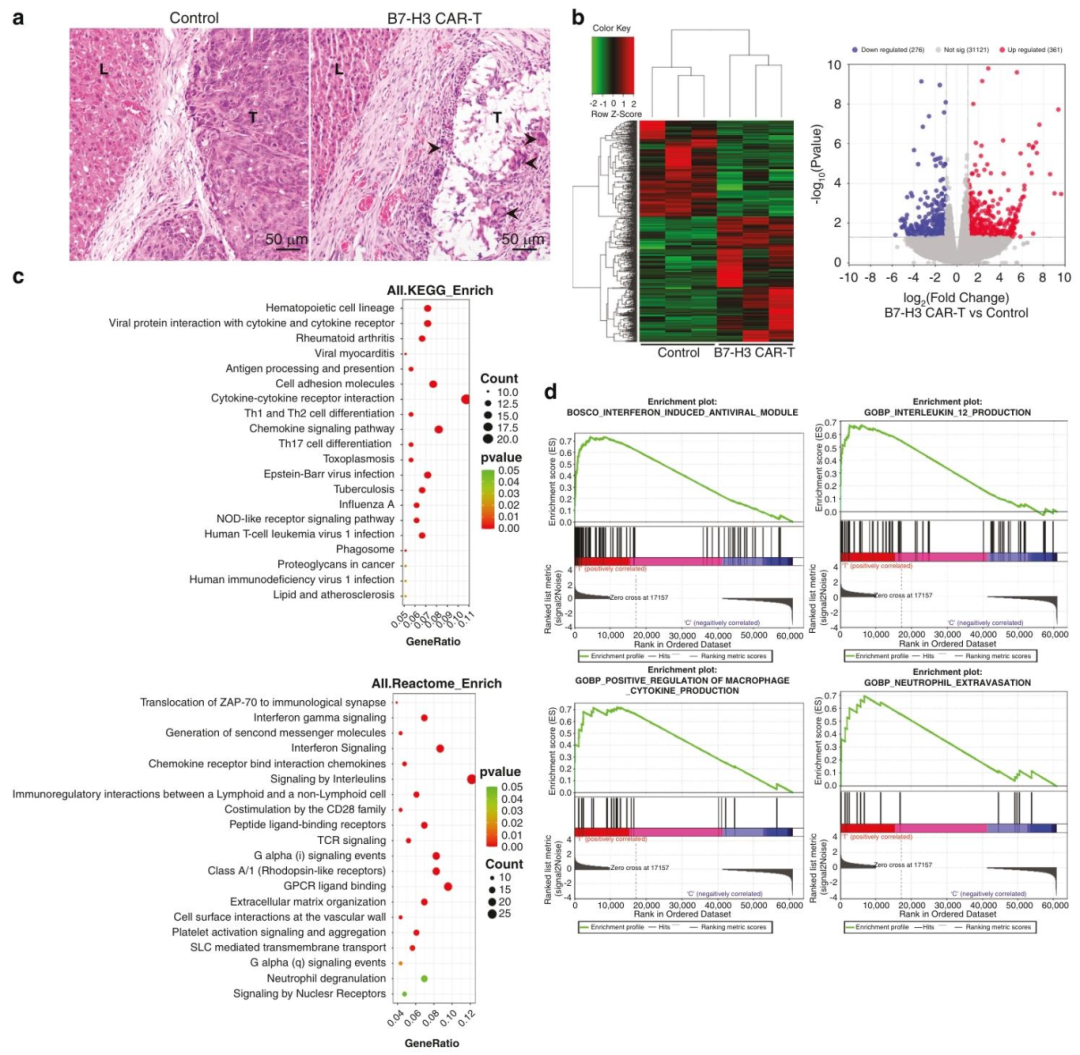
图 5:B7-H3 CAR-T 治疗后的组织学和基因表达变化
内容:(A)PDX 肝转移肿瘤的 HE 染色,B7-H3 CAR-T 组可见大量坏死、空腔样改变及多核巨细胞浸润,对照组肿瘤结构完整;(B)RNA-seq 的差异基因热图和火山图,红色为上调基因,蓝色为下调基因,共 600 余个差异基因;(C)KEGG 和 Reactome 富集分析,显示免疫相关通路(如抗原呈递、细胞因子受体互作)显著富集;(D)GSEA 分析显示干扰素诱导抗病毒模块、IL-12 产生等免疫相关通路被激活。
本研究证实 B7-H3 在 CRC 中高表达,是 CAR-T 疗法的有效靶点。B7-H3 CAR-T 在体外对 CRC 细胞系和 PDOs 有剂量依赖性杀伤作用,体内能显著抑制转移灶生长、延长生存期,且在 PDX 肝转移模型中实现 50% 完全缓解。机制上,其通过激活干扰素、TCR 等免疫相关通路增强抗肿瘤免疫。该研究为转移性 CRC 提供了新的治疗策略,局限性包括动物模型与临床的差异及长期安全性未明确,未来需结合临床样本验证疗效。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:间充质干细胞来源外泌体通过抑制 Th17 分化减轻人肝多谱系类器官和 Mdr2-/- 小鼠的胆管周围纤维化研究
下一篇:全球首个转基因非人灵长类模型问世,肝脏表达 hNTCP 赋予 HBV 易感性