常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2026-01-04 09:00:52 细胞资源库平台 访问量:8
支持细胞(SCs)是生精小管关键体细胞,兼具生殖支持与免疫调节功能,在生殖研究、再生医学中价值显著。美国德克萨斯理工大学团队在《Methods in Molecular Biology》(2025, 2954:163-182)发表方案:详述新生猪、青春期小鼠/大鼠SCs分离、培养及小鼠肾包膜下移植流程,解决多物种 SCs 方案不统一问题,为相关研究提供可靠工具。
本研究旨在建立猪与啮齿类SCs分离、培养及移植的标准化protocol。方法:新生猪/小鼠/大鼠睾丸经酶解(胶原酶 + 胰酶)、纯化获取 SCs,培养为聚集体后移植到小鼠肾包膜下,WT1 免疫组化验证存活。结果:猪每睾丸获 20-30 万 SCs,小鼠每睾丸获 1 万 SCs,纯度>90%,移植后存活≥8天。结论:方案高效可重复,适用于生殖生物学与再生医学研究。
SCs核心功能包括构建血睾屏障、调控精子发生、分泌 TGF-β/IDO 构建免疫耐受微环境,近年在糖尿病/神经疾病移植、男性避孕中应用潜力大。但不同物种 SCs 分离方案差异大,缺乏统一标准,导致实验重复性低。本研究针对新生猪与青春期啮齿类,建立标准化流程,填补技术缺口。
1.材料准备:供体为 1-5 天新生猪、19-22 天 C57BL/6 小鼠、18 天 Lewis 大鼠,受体为 6-8 周龄 BALB/c 小鼠;试剂含解离液(pH7.4)、HBSS/DMEM/Ham’s F10 培养基、胶原酶 V(1mg/mL)、胰酶(1mg/mL)、DNase I(400U/mL);设备包括摇床水浴锅、离心机(308×g/860×g)、显微操作仪等,均符合伦理与无菌规范。
2.新生猪 SCs 分离:睾丸经 70% 乙醇清洗、冷 HBSS 冰浴后,去除鞘膜与附睾,切碎为 0.5-1mm³ 小块;加 25mL 胶原酶 37℃摇床(90RPM)消化 10 分钟,HBSS 终止后 308×g 离心清洗;加解离液重悬,加胰酶 + DNase I 再消化 10 分钟,500μm 滤网过滤纯化,计数后按需求培养为聚集体(Ham’s F10+10% FCS)或单层(DMEM+10% FCS)。
3.小鼠 / 大鼠 SCs 分离:动物麻醉后腹腔切口获取睾丸,20 只小鼠睾丸 / 管,加 25mL 胶原酶 37℃消化 7 分钟,后续胰酶处理、过滤纯化步骤同猪 SCs,培养方式一致,仅酶解时间适配啮齿类睾丸特性。
4.SCs 移植流程:培养 48 小时的 SCs 聚集体离心浓缩,用 PE-50 导管吸入并 Liga 夹封口;受体小鼠麻醉后左侧腹部切口暴露左肾,27G 针头划开肾包膜,硅化玻璃探针挑出间隙,注入 SCs pellet 后烧灼封口,缝合肌肉与皮肤,术后注射丁丙诺啡护理,1-8 天取肾用 WT1 免疫组化验证存活。
Fig1:新生猪睾丸处理与切碎
该图展示新生猪睾丸分离关键步骤:左图为去除睾丸鞘膜与附睾的操作,中图为去包膜后的睾丸实质,右图为用无菌钝头剪刀将睾丸切碎为 0.5-1mm³ 小块(置于冷 HBSS 中),切碎过程约 10 分钟,确保组织块可通过 10mL 移液管,为后续均匀酶解奠定基础。
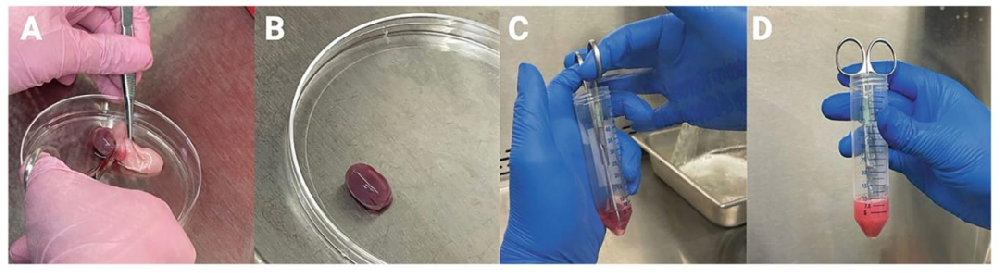
Fig2-3:新生猪 SCs 酶解过程观察
Fig2 呈现胶原酶消化 6 分钟时生精小管开始分离,10 分钟时小管完全脱离间质,胰酶消化 10 分钟后出现单细胞;Fig3 对比消化前束状生精小管、胶原酶消化 5 分钟后松散小管及胰酶消化 10 分钟后的单细胞悬液(20× 放大),明确两步酶解的最优时长,避免消化不足或过度损伤细胞。
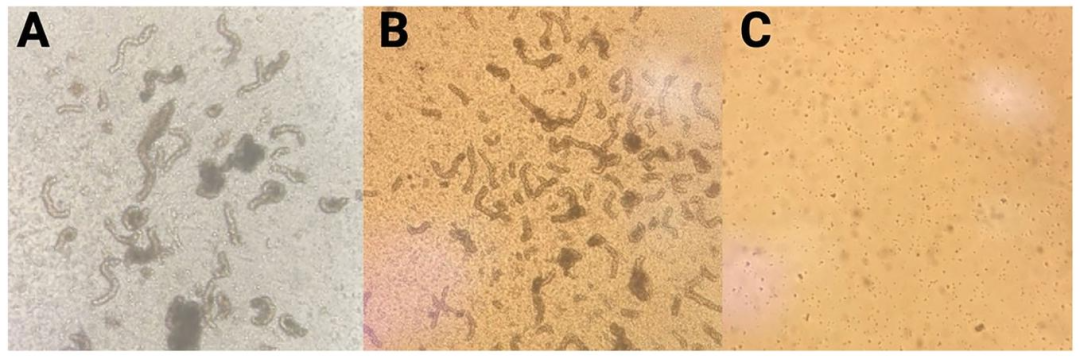
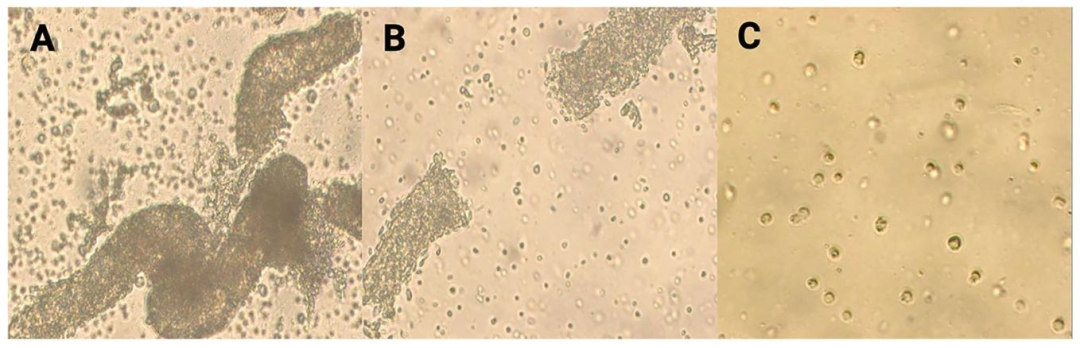
Fig4:SCs 过滤纯化
该图展示用 500μm 无菌滤网纯化 SCs 的操作:先将滤网固定于过滤架并密封,再将酶解后的细胞悬液通过滤网,去除未消化组织与 DNA 团块,确保收集的单细胞悬液纯度,为后续培养减少杂质干扰。
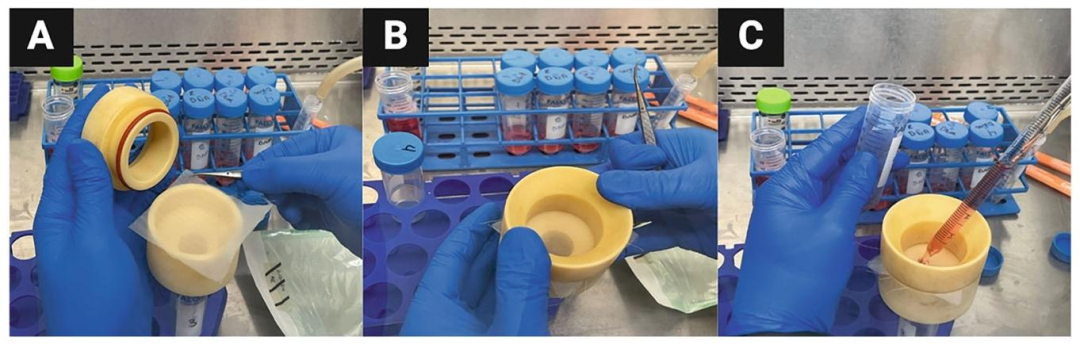
Fig5:啮齿类动物睾丸收集
该图记录小鼠 / 大鼠睾丸获取流程:左图为麻醉后腹腔垂直切口(从盆腔到胸骨),中图为将睾丸转移至含冷 HBSS 的离心管(20 只小鼠睾丸 / 管),右图为将睾丸切碎为 1mm³ 小块,操作适配啮齿类睾丸体积小的特点,确保与猪 SCs 分离流程的可对比性。
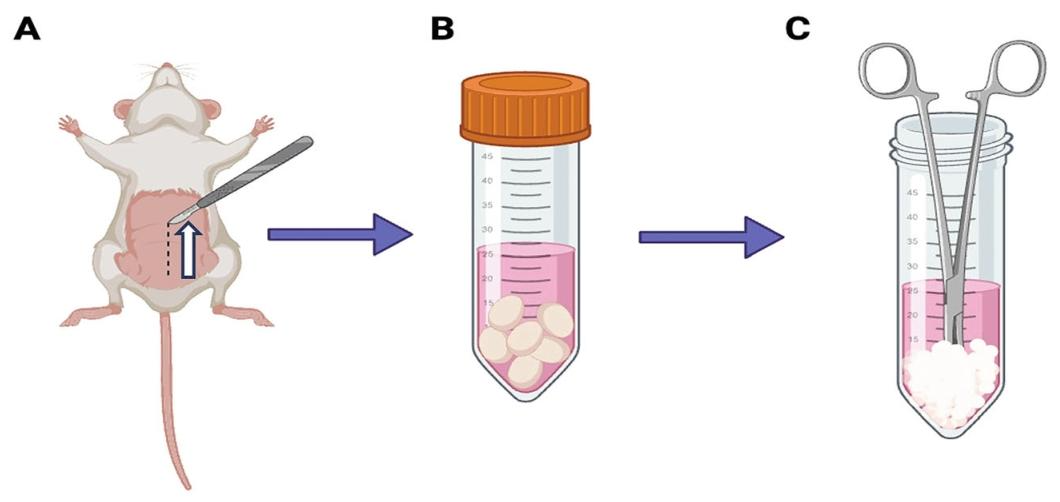
Fig6:SCs 培养形态
该图显示不同物种 SCs 的培养形态:小鼠 SCs 在非组织培养板形成聚集体(移植用),新生猪 SCs 聚集体结构紧密,小鼠聚集体石蜡切片 H&E 染色可见细胞密集,新生猪 SCs 在组织培养板形成单层贴壁细胞,证实 SCs 可按实验需求灵活培养。
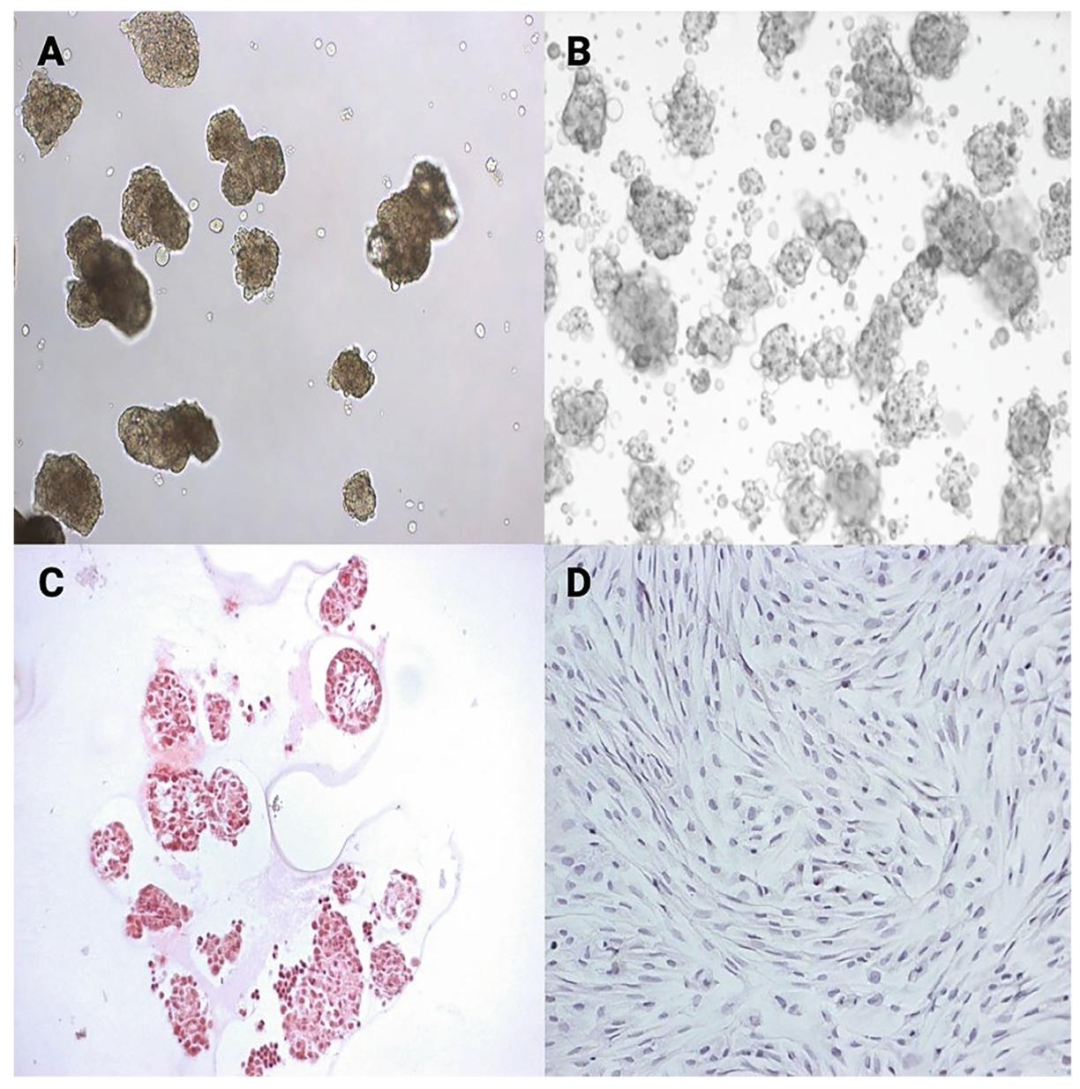
Fig7-8:移植前 SCs 准备
Fig7 为 1.5mL 离心管开盖置于培养箱,让 SCs 聚集体自然沉降;Fig8 展示用显微操作仪将 SCs pellet 吸入 PE-50 导管,Liga 夹封口后固定于离心机,离心 5-10 分钟形成致密 pellet,确保移植时细胞浓度适宜,减少液体体积对肾包膜间隙的压力。


Fig9-11:小鼠肾包膜下移植步骤
Fig9 完整呈现移植操作:拉出肾脏、27G 针头划开包膜、硅化玻璃探针挑出间隙、注入 SCs、烧灼封口、缝合肌肉与皮肤;Fig10 为硅化玻璃探针特写,其光滑表面避免包膜损伤;Fig11 展示移植操作台布局(显微操作仪 + 含 SCs 的导管),保证操作精准无菌。
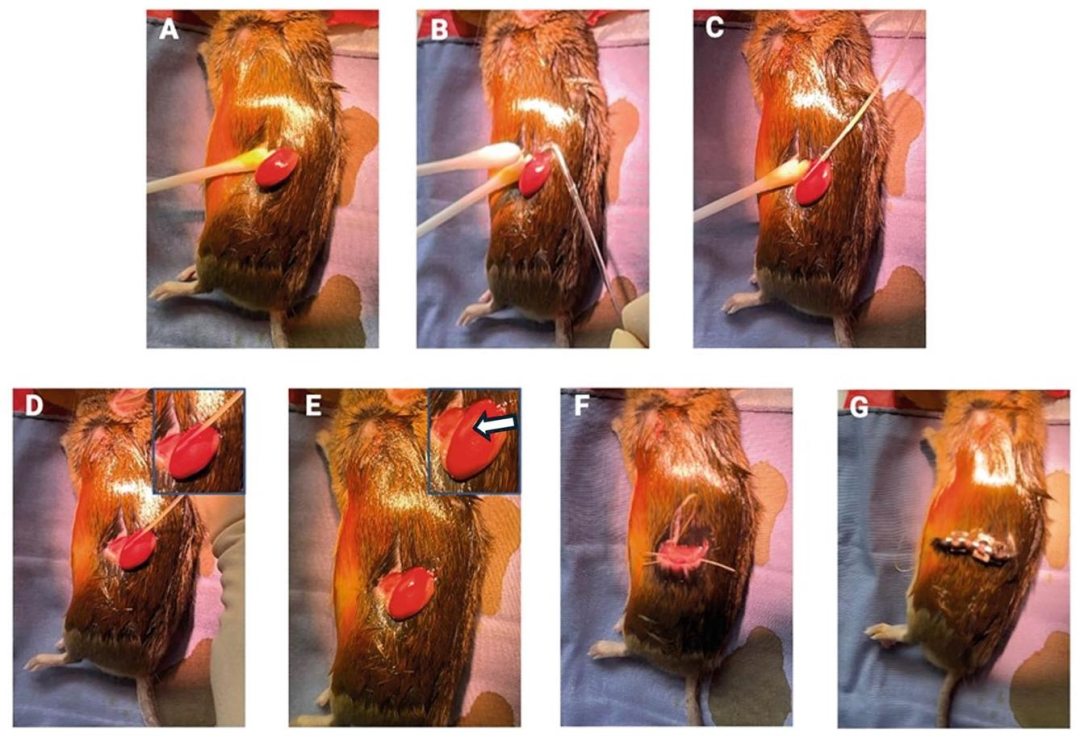


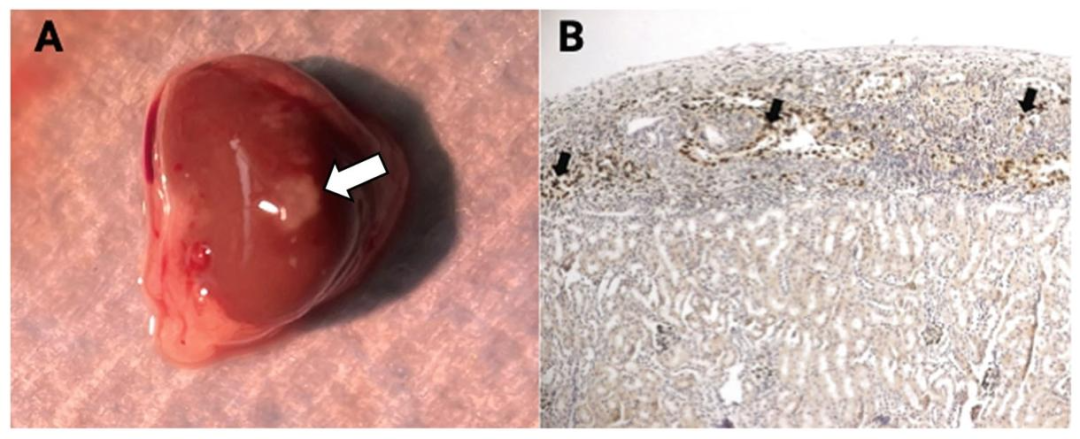
Fig12:移植后 SCs 存活验证
该图为移植后检测结果:左图为移植 1 天的新生猪 SCs 移植物(肾包膜下白色团块),右图为移植 8 天的小鼠 SCs 移植物,WT1 免疫组化(深棕色箭头)证实 SCs 存活,验证移植流程的可靠性与 SCs 的体内存活能力。
本方案核心优势:1. 覆盖新生猪与青春期小鼠 / 大鼠,统一多物种 SCs 分离参数;2. SCs 可灵活培养为聚集体(移植)或单层(体外实验),移植后存活≥8 天;3. 明确关键步骤(酶解时间、过滤孔径、离心转速),重复性高。该方案为 SCs 在生殖研究、再生医学中的应用提供标准化工具,推动异种移植与基因工程 SCs 研究发展。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:猪视网膜色素上皮(RPE)单眼原代培养方案:为年龄相关性黄斑变性(AMD)研究提供标准化模型
下一篇:人原代肝细胞与干细胞衍生肝细胞样细胞(HLCs)表征标准化方案