常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2026-01-03 17:35:24 细胞资源库平台 访问量:18
年龄相关性黄斑变性(AMD)是工业化国家致盲的首要原因,可靠的视网膜色素上皮(RPE)细胞模型是 AMD 机制研究与药物研发的关键。传统模型(如 ARPE-19 细胞系、小鼠 RPE、混合猪 RPE 培养)存在分化不足、结构差异大或遗传异质等缺陷。德国基尔大学 Philipp Dörschmann 团队在《BioMed》(2025, 5:7)发表优化方案:以屠宰场废弃猪眼为材料,建立 “单眼单孔” 培养模式(一只猪眼的 RPE 接种至 12 孔板一孔),通过优化死后时间(PMT)、培养板涂层及血清含量,获得遗传同质、功能稳定的 RPE 细胞,符合 3R 原则,为 AMD 研究提供接近人类 RPE 的标准化模型。
本研究旨在建立猪 RPE 单眼原代培养的标准化方案,解决传统混合培养的遗传异质性问题。方法:1. 取 5-6 月龄猪眼(清晰 / 浑浊),测试 2、4、6h 死后时间(PMT),胶原 I/IV、聚 - D - 赖氨酸(PDL)等 5 种涂层,1%/5%/10% 血清含量;2. 经胰酶消化、Percoll 梯度纯化 RPE,接种后检测细胞数量、融合率、形态,Western blot(RPE65/CLDN19)、流式细胞术(CD45/CD11b)鉴定纯度,TEER 测屏障功能。结果:4-5h PMT 细胞活力最高,PDL 涂层融合最快(7 天融合率 100%)且 RPE65 表达最高,5% 血清可维持细胞功能且降低成本。结论:该方案可高效制备遗传同质的猪 RPE,为 AMD 研究提供可靠体外模型。
RPE 是视网膜外层屏障的核心,参与营养运输、光感受器代谢,其功能异常是 AMD 的核心病理环节。现有 RPE 模型存在明显局限:1. 细胞系(如 ARPE-19)缺乏分化特征,屏障功能弱;2. 小鼠眼为夜行性结构,RPE 多核比例高、紧密连接成分不同,与人类差异大;3. 传统猪 RPE 培养混合多眼细胞,遗传异质导致实验重复性差。此外,猪眼与人类眼解剖、遗传相似度高(如 cones 类型、紧密连接 Claudin 种类),且为屠宰场废弃物,符合 3R 原则(减少动物实验)。但此前缺乏单眼猪 RPE 培养方案,无法模拟个体遗传背景,因此亟需建立标准化单眼培养方法,填补 AMD 研究的模型缺口。
1.材料与模型准备:采用 5-6 月龄 Deutsche Landrasse 猪眼(屠宰场废弃物,2-6h PMT),培养板用 10μg/mL PDL(硼酸盐缓冲液配制)包被≥1h;制备专用培养基(基础培养基:DMEM/F12+1% 非必需氨基酸 + 11mM 丙酮酸 + 1% 抗生素,加 1%/5%/10% FBS;胶原酶消化缓冲液含胶原酶 D、TLCK、DNase I,现配现用)。
2.RPE 分离与纯化:猪眼经碘伏消毒、冷 PBS 灌流后,解剖去除角膜、晶状体、玻璃体,剥离视网膜;RPE 用 0.25% 胰酶孵育 10min,再用胰酶 - EDTA 孵育 35min,机械吹打收集细胞;Percoll 梯度(37% 等渗 Percoll)1200×g 离心 30min(无刹车),吸取底部细胞团纯化 RPE。
3.培养与维护:纯化细胞以 5×10⁵ cells / 孔接种至 PDL 包被 12 孔板,37℃ 5% CO₂培养;前 3 天每日换液(含对应血清的培养基),之后每周两次;测试不同 PMT(2/4/6h)、涂层(胶原 I/IV、PDL、层粘连蛋白、纤连蛋白、无涂层)、血清含量(1%/5%/10%)对培养的影响。
4.鉴定与功能检测:免疫荧光染色 Iba1(RPE 标志物)、TMEM119(特异性标志物)排除星形胶质细胞(GFAP)/ 神经元(NeuN)污染;流式细胞术检测 CD45/CD11b/P2RY12 鉴定纯度;Western blot 检测 RPE65(视觉循环蛋白)、CLDN19(紧密连接蛋白);TEER 仪测跨上皮电阻(屏障功能);ELISA 检测 VEGF 分泌(AMD 相关因子)。
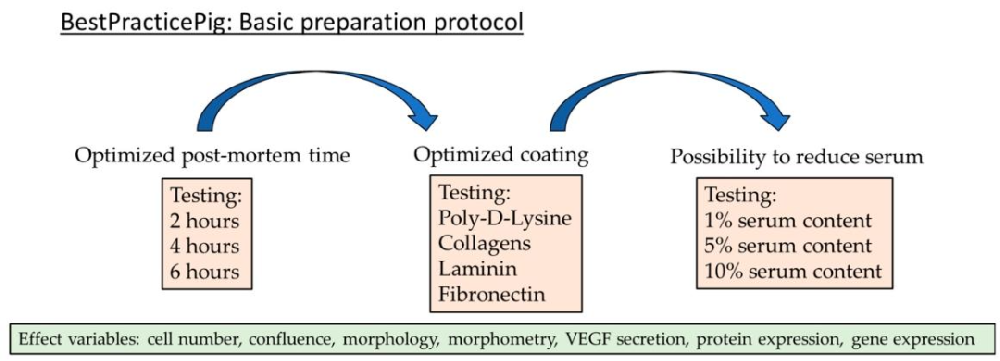
Fig1:实验设计流程图
该图概述研究整体框架:以 “单眼单孔” 猪 RPE 培养为核心,聚焦三大关键参数优化 —— 死后时间(2/4/6h)、培养板涂层(5 种类型)、培养基血清含量(1%/5%/10%),通过细胞数量、融合率、形态、VEGF 分泌、基因 / 蛋白表达(RPE65/CLDN19)多维度评估效果。明确单孔细胞来自单眼,保证孔内遗传同质、孔间遗传异质,模拟人类个体差异,为实验重复性与生物学相关性奠定基础。
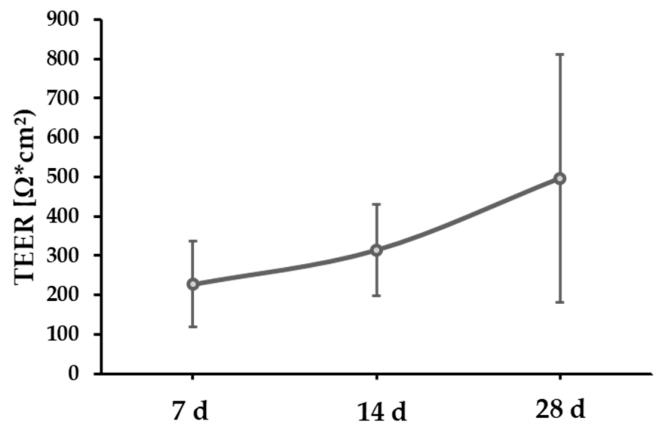
Fig2:单眼 RPE 的屏障功能(TEER 检测)
该图为 RPE 接种于 Transwell 膜后的跨上皮电阻(TEER)变化:培养 7 天 TEER 为 228±110 Ω・cm²,14 天升至 315±116 Ω・cm²,28 天达 497±315 Ω・cm²,随培养时间显著升高且数值稳定。高 TEER 值证明单眼 RPE 可形成紧密连接结构,具备生理屏障功能,验证该模型能复现体内 RPE 的外层血 - 视网膜屏障作用,满足 AMD 研究中 RPE 屏障功能评估的核心需求。
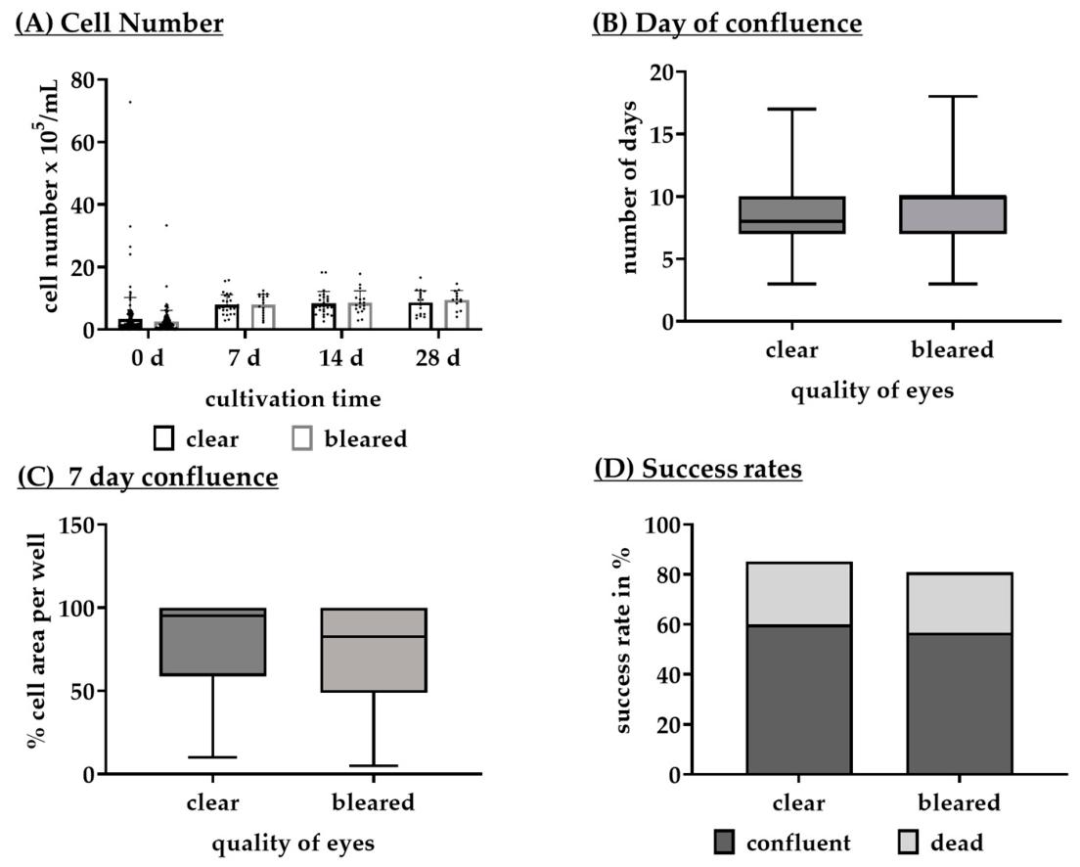
Fig3:眼质量(清晰 vs 浑浊)对培养的影响
该图对比 “清晰眼”(角膜 / 晶状体透明)与 “浑浊眼”(屠宰后热损伤致浑浊)的培养差异:清晰眼 7 天融合率(95.00%±40.00%)高于浑浊眼(82.50%±50.00%),达到 95%-100% 融合的时间(8.00±3.00 天)短于浑浊眼(10.00±3.00 天),但两者细胞数量(7-28 天均为 7.9×10⁵-9.5×10⁵ cells/mL)、存活率(清晰眼 25.26% 死亡,浑浊眼 24.11% 死亡)无显著差异。结果表明眼浑浊不影响细胞活力,但清晰眼培养效率更高,为实验材料筛选提供明确标准。
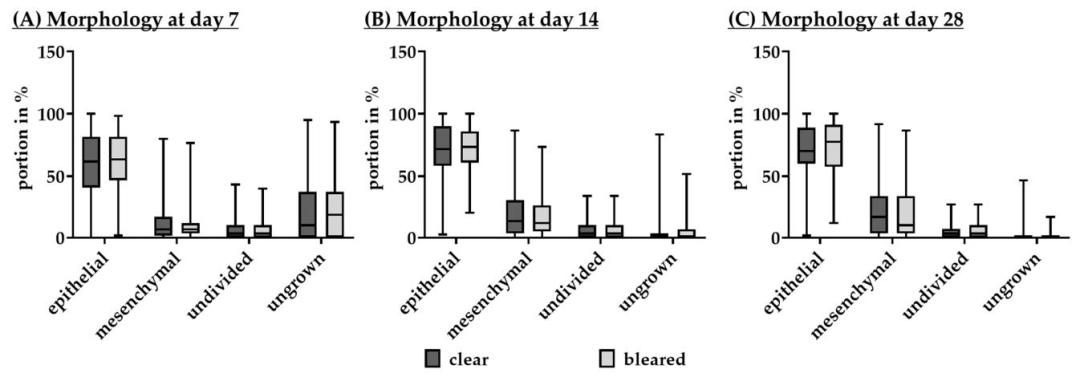
Fig4:眼质量对 RPE 形态的影响
该图为清晰眼与浑浊眼 RPE 培养 7、14、28 天的形态分析:7 天时清晰眼上皮细胞比例(61.67%±40.00%)略低于浑浊眼(63.33%±34.17%),无生长区域(10.00%±36.67%)少于浑浊眼(18.33%±36.67%);14-28 天两者上皮细胞比例均升至 70%-77%,无生长区域降至 0%,间充质细胞比例稳定在 10%-16%。整体形态无显著差异,进一步证实眼质量仅影响培养效率,不改变 RPE 终末形态与分化特征。
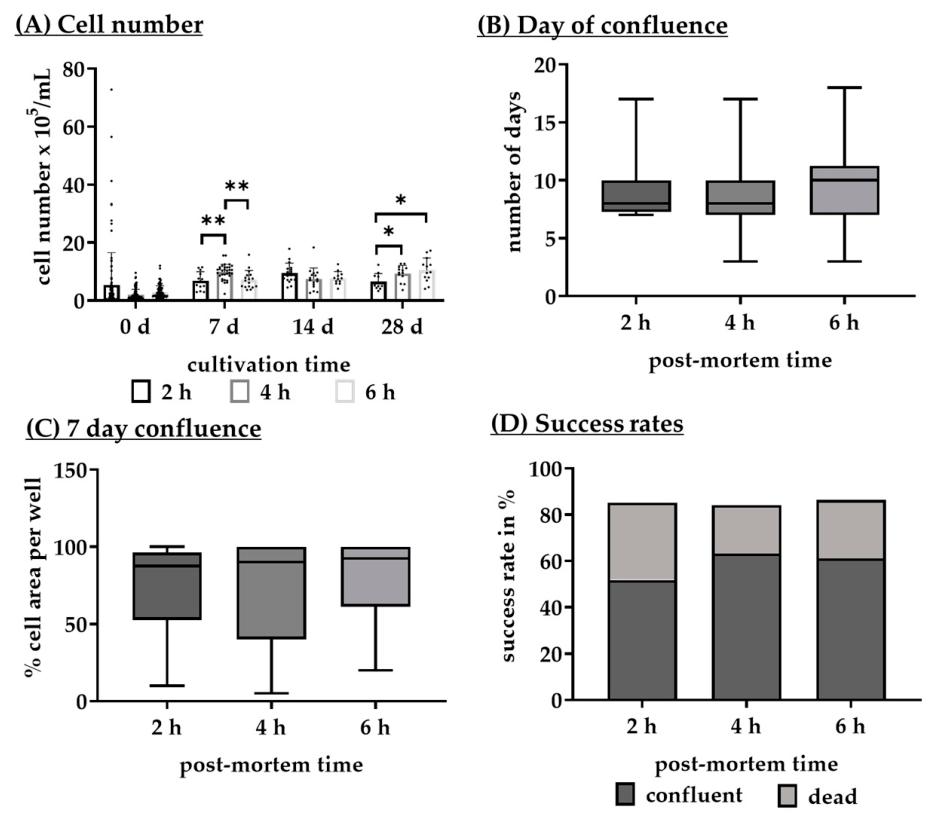
Fig5:死后时间(PMT)对 RPE 培养的影响
该图系统对比 2、4、6h PMT 的培养效果:4h PMT 7 天细胞数量(9.85±2.69×10⁵ cells/mL)显著高于 2h(6.81±3.10×10⁵ cells/mL)和 6h(7.19±3.17×10⁵ cells/mL);上皮细胞比例(78.33%±37.50%)显著高于 2h(58.34%±33.76%)和 6h(63.33%±36.67%),无生长区域(1.67%±26.67%)显著低于 2h(18.34%±33.34%)和 6h(8.33%±35.84%);4h PMT 融合率(63.19%)高于 2h(51.85%)和 6h(61.11%)。结果明确 4-5h 是最优 PMT,兼顾细胞活力、分化效率与实验操作便利性(符合屠宰场到实验室的运输时间)。
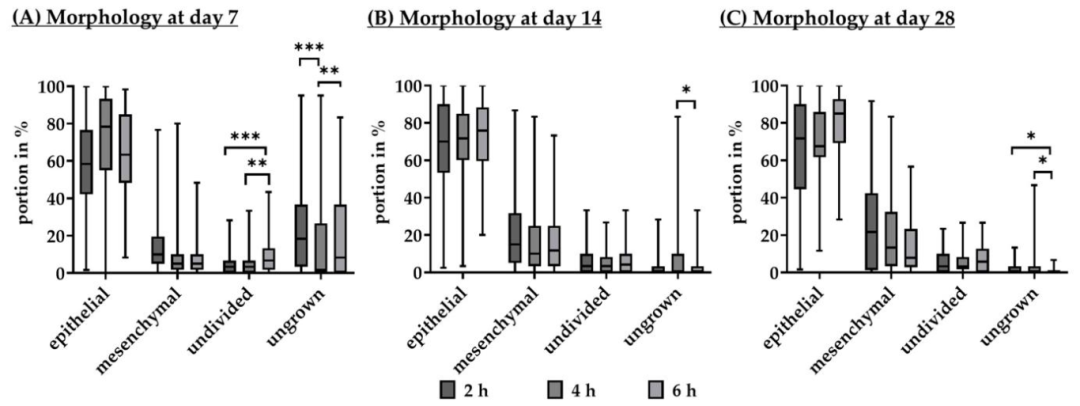
Fig6:PMT 对 RPE 形态与肌动蛋白结构的影响
该图为不同 PMT 下 RPE 形态及肌动蛋白(actin)结构:7 天时 4h PMT 上皮细胞占比最高(78.33%),2h PMT 未分化细胞占比高(3.33%),6h PMT 间充质细胞占比高(13.33%);28 天荧光染色显示,2h PMT 肌动蛋白结构评分(4.00±2.50,0 = 紊乱,5 = 生理态)高于 4h(3.50±3.00)和 6h(3.00±2.50),但 2h PMT 细胞存活率低(仅 33.33% 成功培养)。综合判断 4h PMT 最优 —— 虽肌动蛋白结构略逊于 2h,但细胞存活率与分化效率显著更优,更适合实验应用。
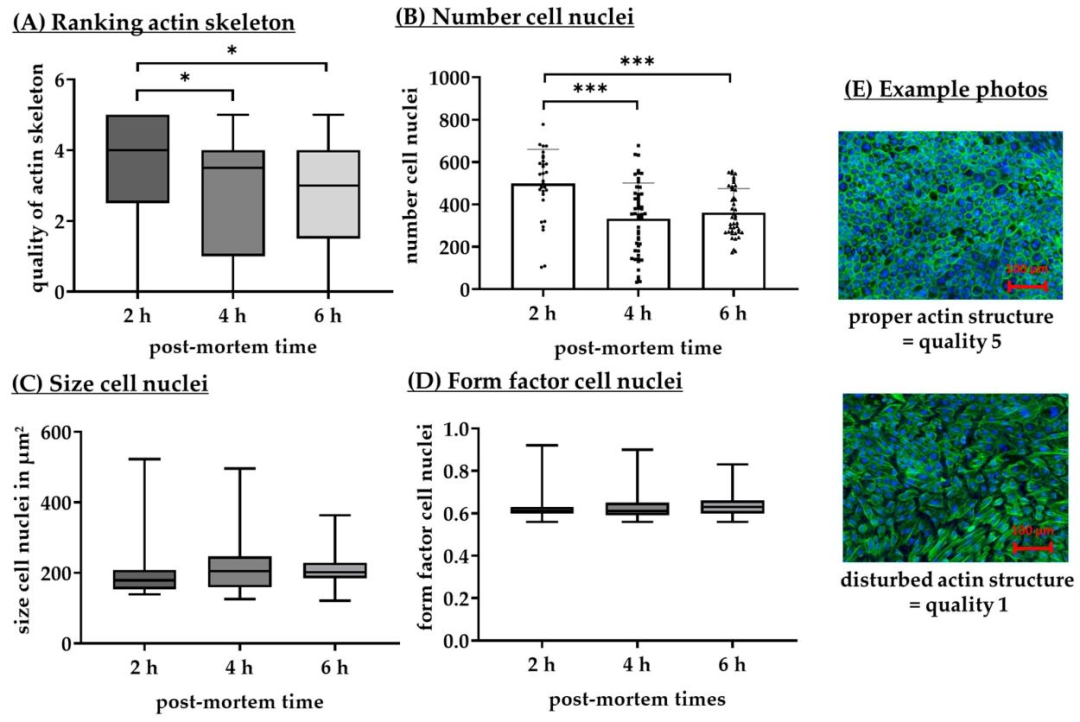
Fig7:PMT 对 RPE 细胞核参数的影响
该图通过 Fiji 软件分析不同 PMT 下 RPE 细胞核特征:2h PMT 细胞核数量(499.20±161.08 个 / 视野)显著高于 4h(333.02±168.42 个)和 6h(361.07±114.30 个),但细胞核大小(600±200 μm²)、形态因子(0.6-0.7,接近六边形)无显著差异。结合 Fig6 结果,2h PMT 虽细胞密度高,但存活率低,4h PMT 在细胞密度与存活间达到平衡,进一步支撑 4h PMT 的最优选择。
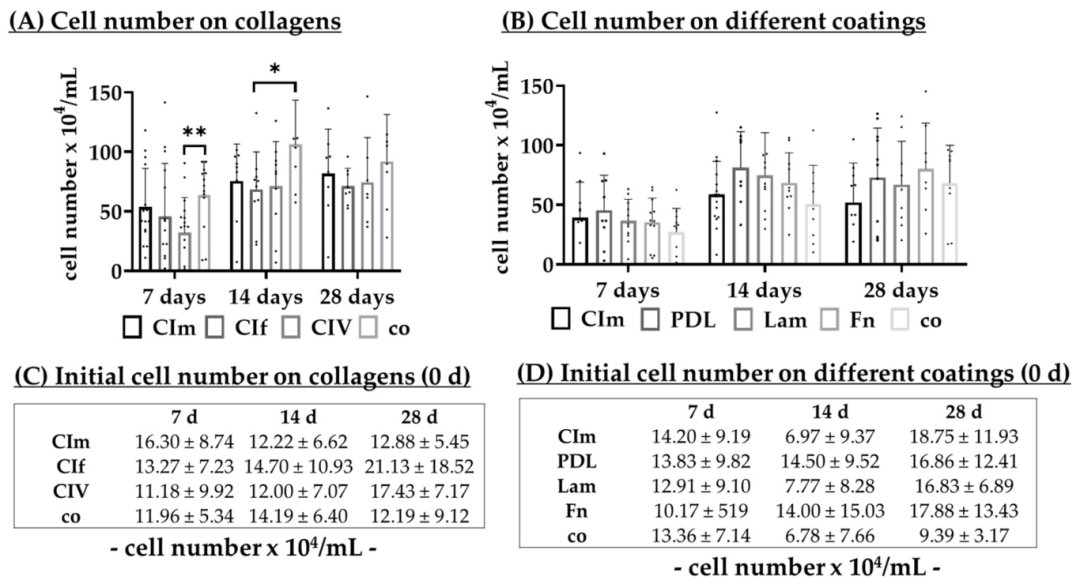
Fig8:不同涂层对 RPE 细胞数量的影响
该图对比 5 种涂层(胶原 I/IV、PDL、层粘连蛋白、纤连蛋白、无涂层)的 RPE 细胞增殖:7-14 天时 PDL 涂层细胞数量最高(7 天 45.28×10⁴ cells/mL,14 天 81.31×10⁴ cells/mL),显著高于胶原 I(7 天 39.20×10⁴ cells/mL)、层粘连蛋白(7 天 36.73×10⁴ cells/mL);28 天纤连蛋白细胞数量(80.31×10⁴ cells/mL)略高于 PDL(73.09×10⁴ cells/mL),但 PDL 涂层细胞形态更均一。结果表明 PDL 涂层更利于 RPE 早期增殖与形态维持,为后续融合与分化奠定基础。
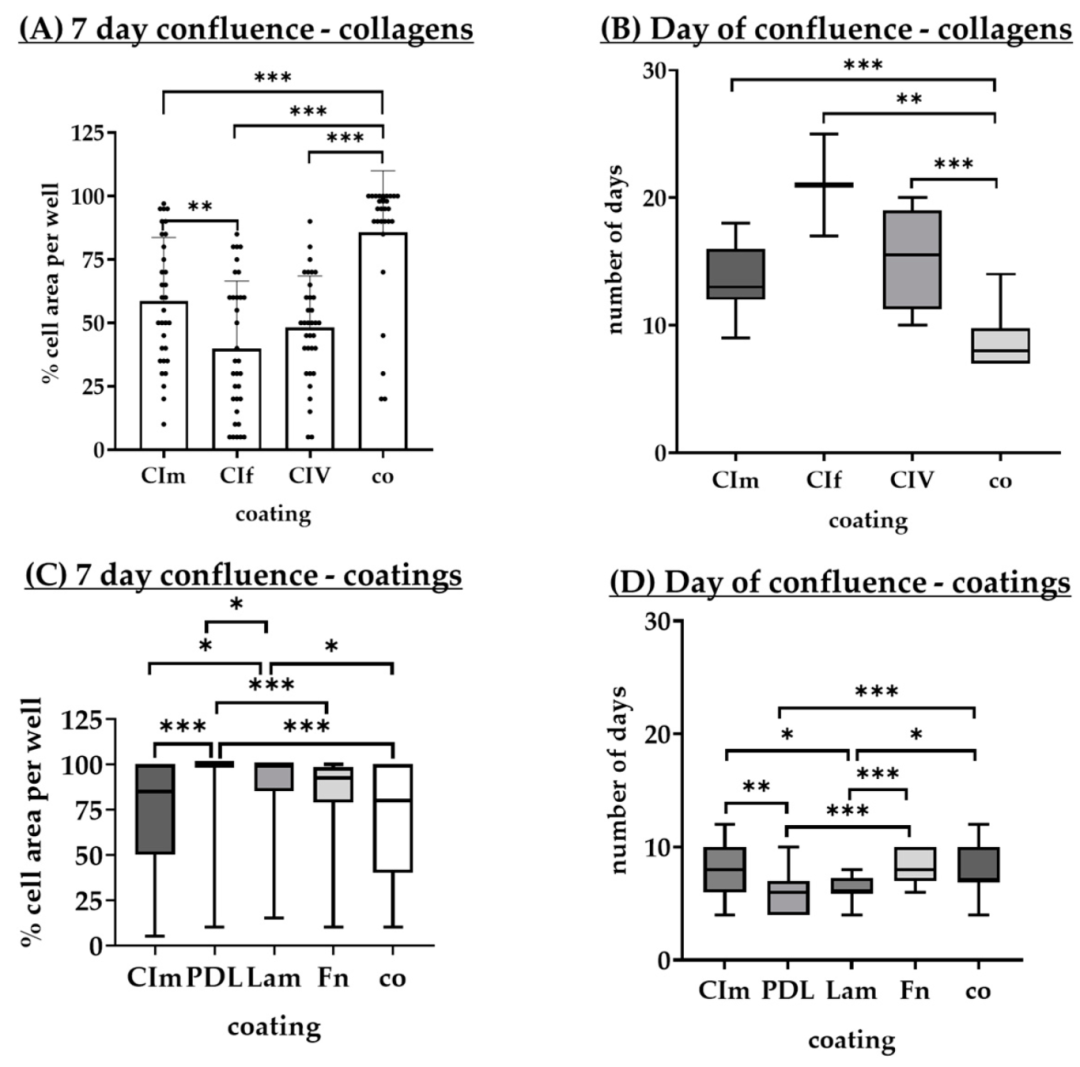
Fig9:不同涂层对 RPE 融合的影响
该图聚焦涂层对 RPE 融合率与融合时间的影响:7 天融合率方面,PDL 涂层最高(中位数 100%±0%),显著高于胶原 I(58.66%±25%)、无涂层(80%±60%);达到 95%-100% 融合的时间,PDL 最短(中位数 6.00±3.00 天),显著快于胶原 I(13.00±4.00 天)、纤连蛋白(8.00±3.00 天)。结合 Fig8 细胞数量数据,PDL 涂层在增殖与融合效率上均最优,可缩短实验周期至 7-10 天。
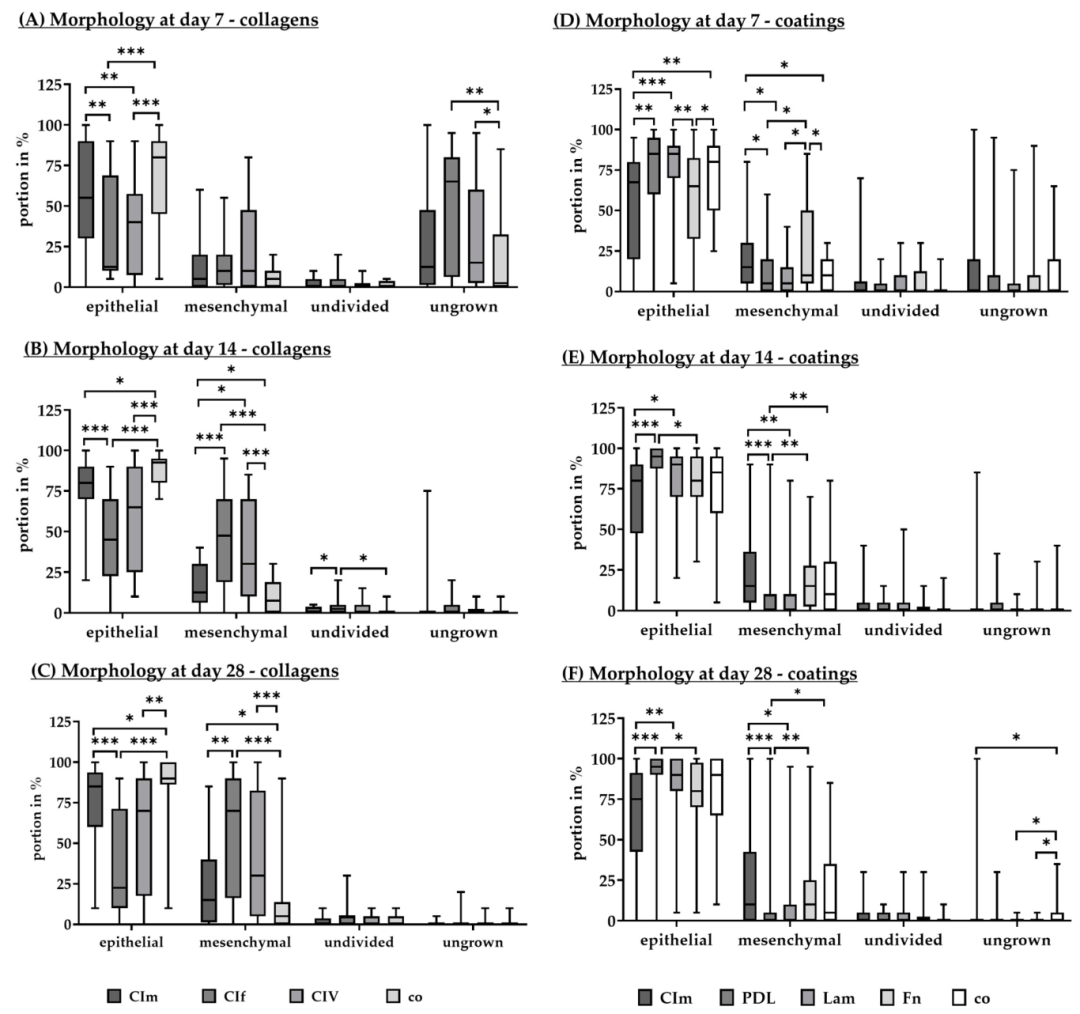
Fig10:不同涂层对 RPE 形态的影响
该图为 5 种涂层下 RPE 培养 7、14、28 天的形态分析:PDL 涂层 7 天上皮细胞比例(85.00%±35.00%)高于胶原 I(67.50%±60.00%)、纤连蛋白(65.00%±50.00%);14-28 天 PDL 上皮细胞比例升至 90%-95%,间充质细胞比例降至 0%-5%,无生长区域消失;而胶原 I 涂层 28 天仍有 22.50%±61.30% 间充质细胞。结果证实 PDL 涂层可抑制 RPE 上皮 - 间充质转化(EMT),维持上皮细胞特性,符合 AMD 研究中 RPE 功能评估需求。
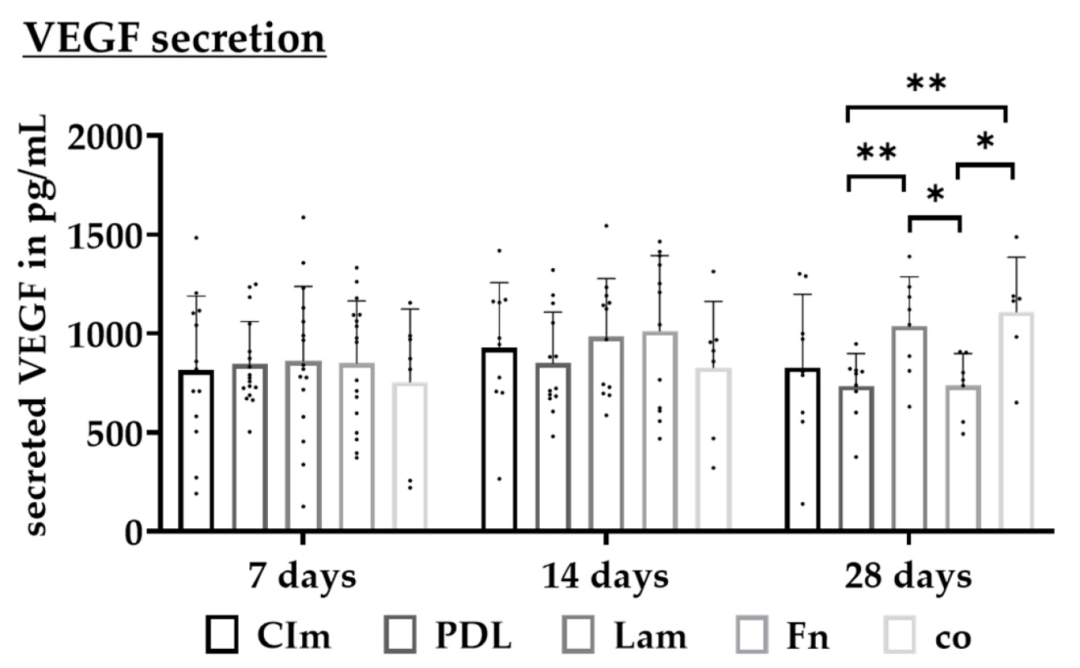
Fig11:不同涂层对 RPE VEGF 分泌的影响
该图为 ELISA 检测不同涂层下 RPE 分泌 VEGF 的水平:28 天时无涂层组 VEGF 最高(1109.33±276.78 pg/mL),PDL 组最低(735.33±164.03 pg/mL),层粘连蛋白组居中(1038.50±248.47 pg/mL);7-14 天各组 VEGF 无显著差异。结合 AMD 病理 ——VEGF 过高与湿性 AMD 相关,PDL 涂层下 RPE VEGF 分泌更接近生理水平,说明该涂层可维持 RPE 正常分泌功能,避免异常 VEGF 干扰实验结果。
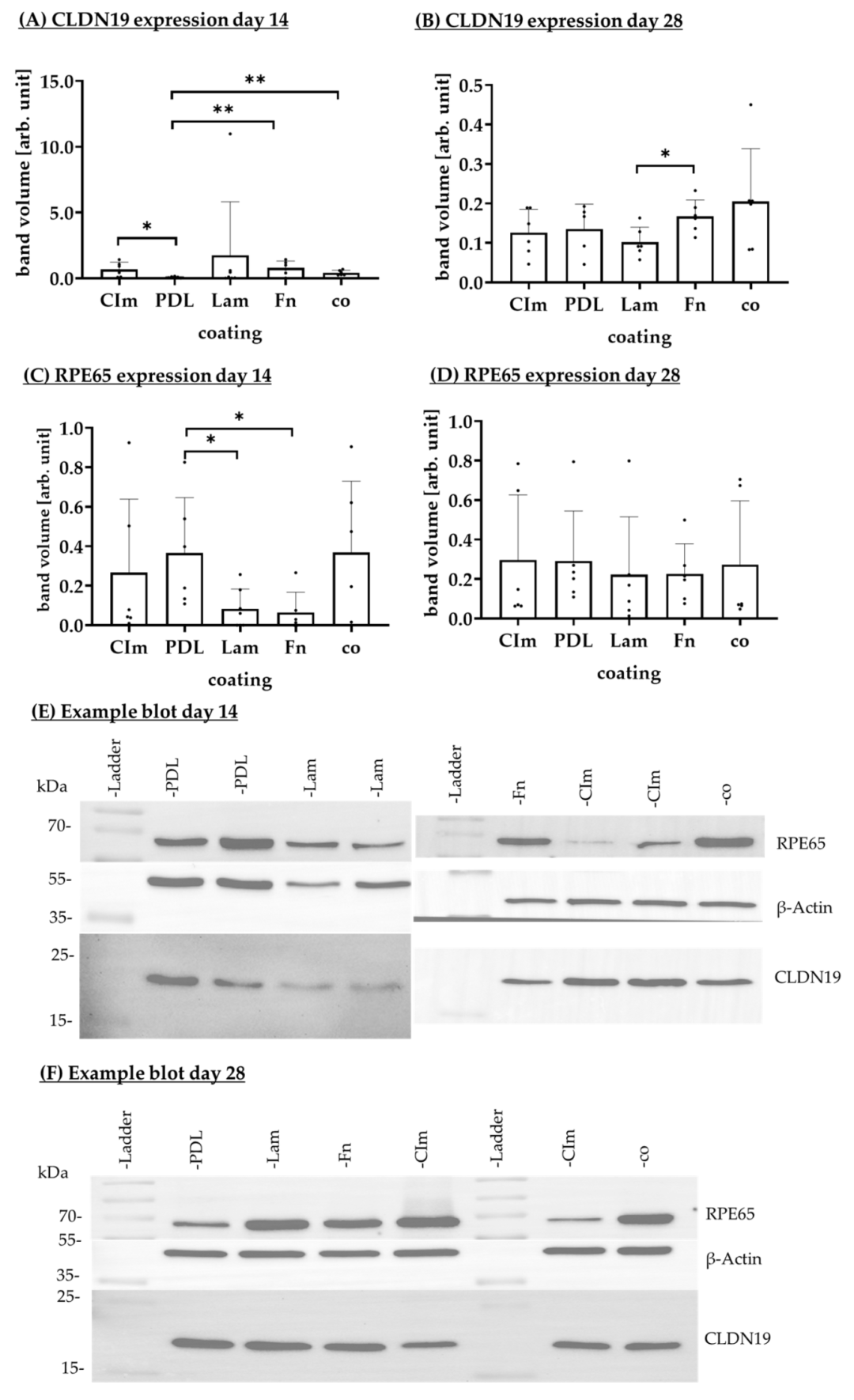
Fig12:不同涂层对 RPE 蛋白表达的影响
该图为 Western blot 检测 RPE65(视觉循环核心蛋白)与 CLDN19(紧密连接蛋白)的表达:14 天时 PDL 涂层 RPE65 表达(0.37±0.28 arb. unit)显著高于层粘连蛋白(0.08±0.10 arb. unit)、纤连蛋白(0.06±0.10 arb. unit);28 天 PDL 涂层 CLDN19 表达(0.14±0.06 arb. unit)与无涂层(0.20±0.13 arb. unit)无显著差异,但显著高于层粘连蛋白(0.10±0.04 arb. unit)。结果证实 PDL 涂层可促进 RPE 分化(RPE65 高表达)并维持紧密连接(CLDN19 稳定),是保证 RPE 功能的关键。
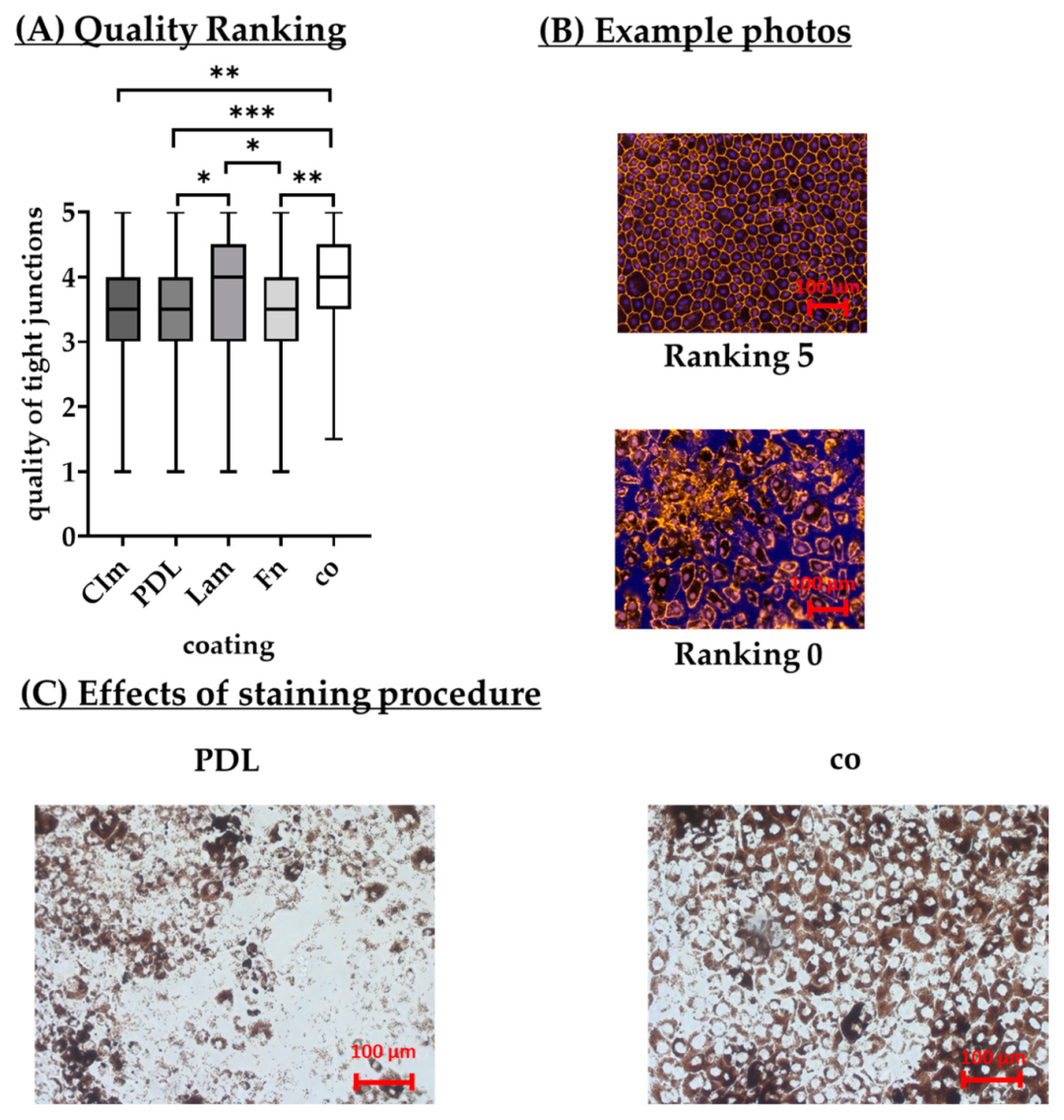
Fig13:不同涂层对 RPE 紧密连接形态的影响
该图为免疫荧光染色 CLDN19(紧密连接标志物)的结果:28 天时无涂层与层粘连蛋白组紧密连接评分(4.00±1.00-1.50)高于 PDL 组(3.50±1.00),但 PDL 组细胞经染色后无脱落,而无涂层组有 15% 细胞脱落;CellProfiler 分析显示,PDL 组细胞面积(303.10 μm²)、周长(75.28 μm)最接近标准值(324.25 μm²、76.02 μm)。结果表明 PDL 涂层虽紧密连接评分略低,但细胞稳定性更高,且形态参数更接近生理 RPE,适合长期实验。
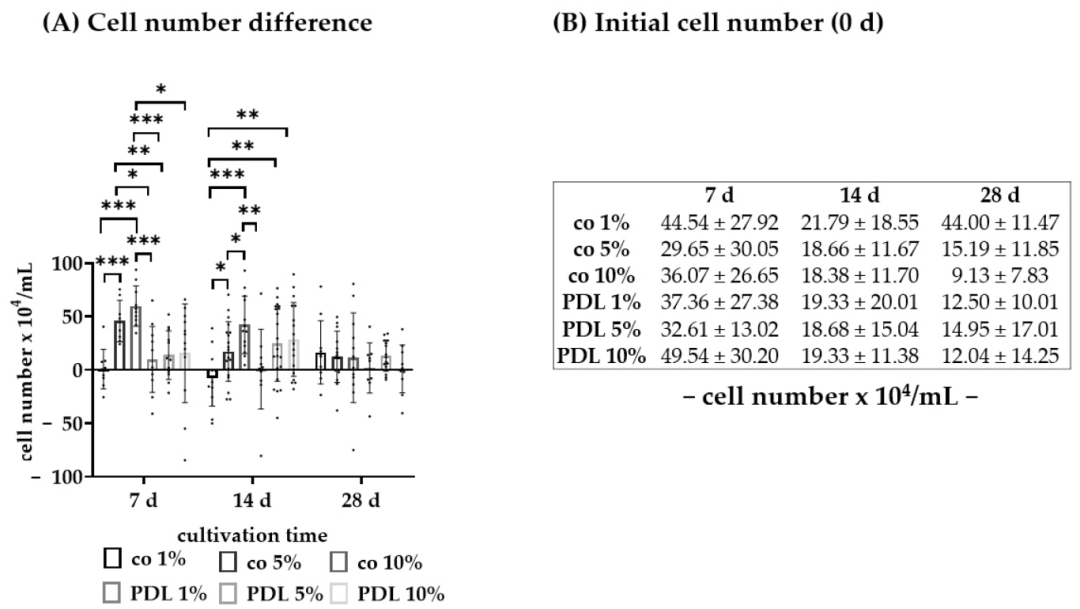
Fig14:不同血清含量对 RPE 细胞数量的影响
该图对比 PDL 涂层下 1%/5%/10% 血清的细胞数量变化:7 天时无涂层 + 10% 血清细胞数最高(59.73±17.85×10⁴ cells/mL),PDL+1% 血清最低(9.82±29.48×10⁴ cells/mL);14 天时无涂层 + 10% 血清仍最高(42.15±25.90×10⁴ cells/mL),PDL+1% 血清最低(0.80±35.41×10⁴ cells/mL);28 天各组细胞数无显著差异。结果表明高血清(10%)促进早期增殖,但 28 天后差异消失,为后续血清含量优化提供依据。
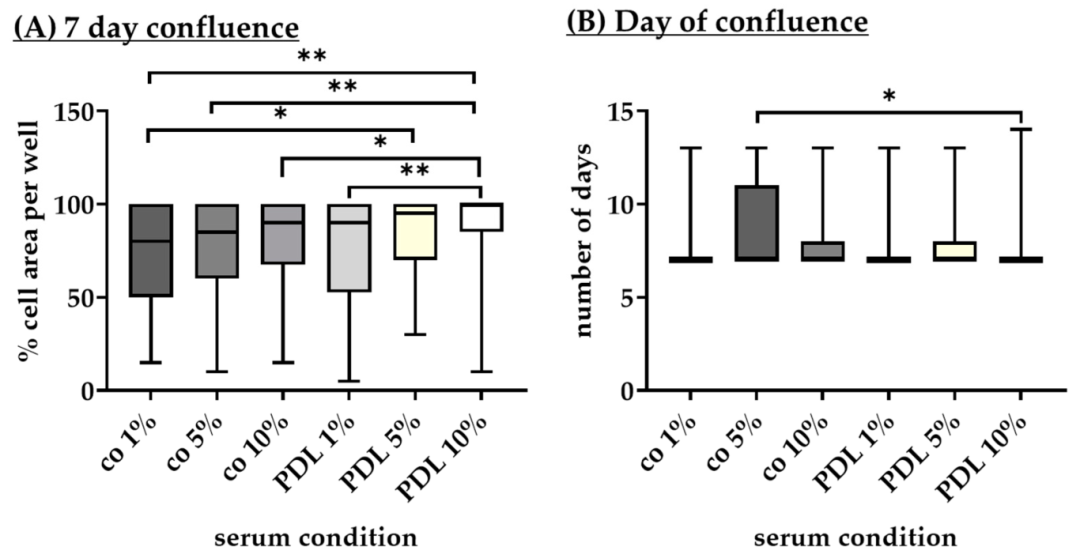
Fig15:不同血清含量对 RPE 融合的影响
该图为血清含量对 RPE 融合率与融合时间的影响:7 天融合率方面,PDL+10% 血清最高(100%±15%),PDL+5% 血清次之(95%±22.5%),两者无显著功能差异;PDL+1% 血清最低(90%±45%);所有组达到 95%-100% 融合的时间均为 7.00 天,仅无涂层 + 5% 血清的四分位距(3.75 天)略宽。结果证实 5% 血清可替代 10% 血清,在保证融合效率的同时降低 FBS 成本与批次差异干扰。
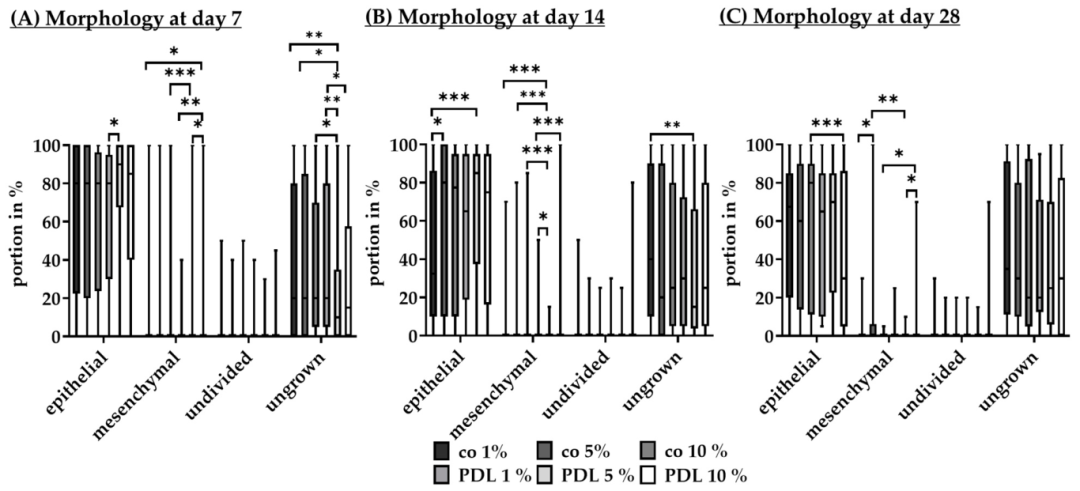
Fig16:不同血清含量对 RPE 形态的影响
该图为血清含量对 RPE 形态的影响:7 天时 PDL+5% 血清上皮细胞比例(90.00%±32.50%)显著高于 PDL+1% 血清(80.00%±65.00%),与 PDL+10% 血清(85.00%±35.00%)无差异;14 天时无涂层 + 1% 血清上皮细胞比例(32.50%±72.25%)显著低于无涂层 + 5% 血清(80.00%±90.00%);28 天各组上皮细胞比例均达 70%-90%。结果表明 5% 血清可维持 RPE 上皮形态,避免 1% 血清导致的分化不足,同时无 10% 血清的过度增殖问题。
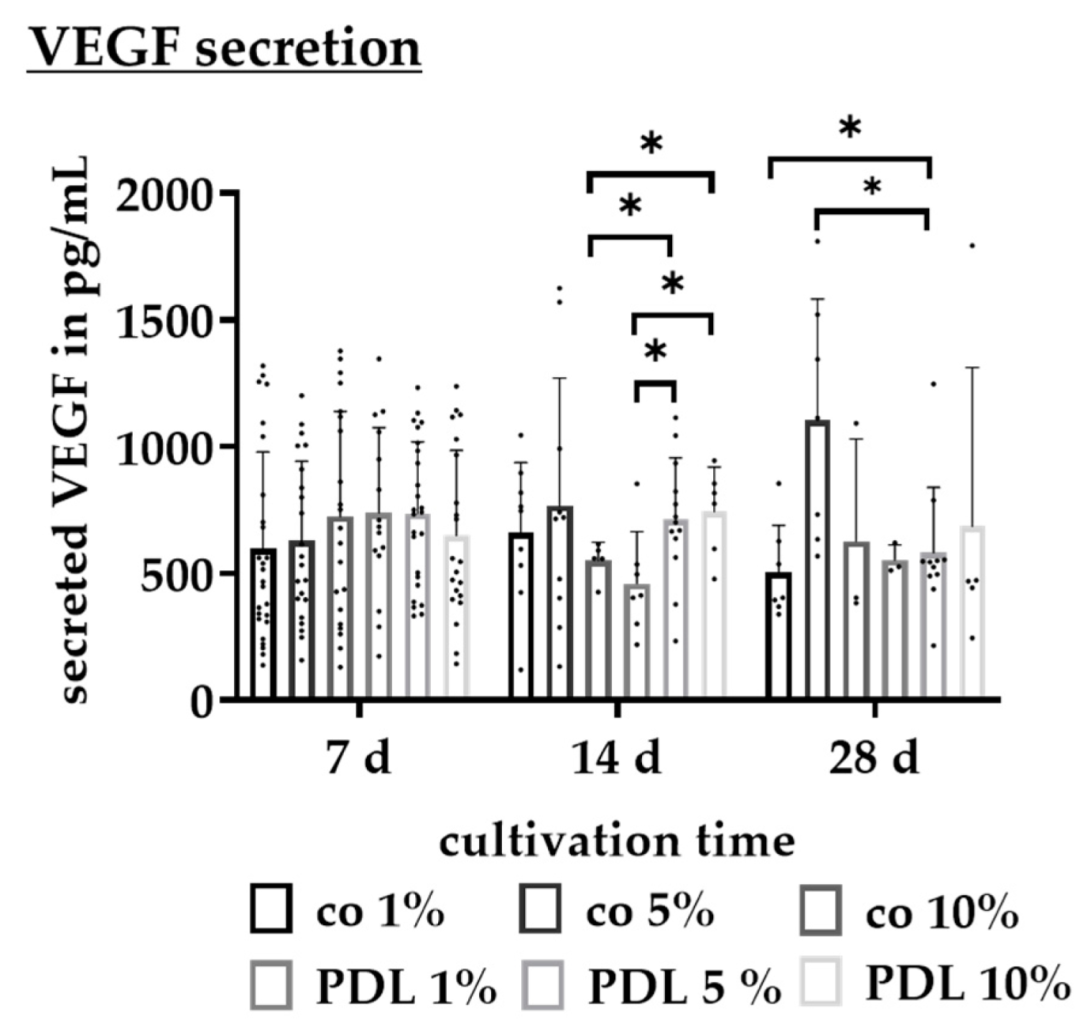
Fig17:不同血清含量对 RPE VEGF 分泌的影响
该图为 ELISA 检测血清含量对 VEGF 分泌的影响:28 天时无涂层 + 5% 血清 VEGF 最高(1104.05±443.52 pg/mL),PDL+5% 血清居中(582.12±246.00 pg/mL),PDL+1% 血清最低(504.27±171.99 pg/mL);14 天时 PDL+10% 血清 VEGF(754.21±158.56 pg/mL)显著高于 PDL+1% 血清(460.74±189.28 pg/mL)。结合 AMD 病理,PDL+5% 血清下 VEGF 分泌更接近生理水平,避免高血清导致的异常分泌,适合 AMD 相关机制研究。
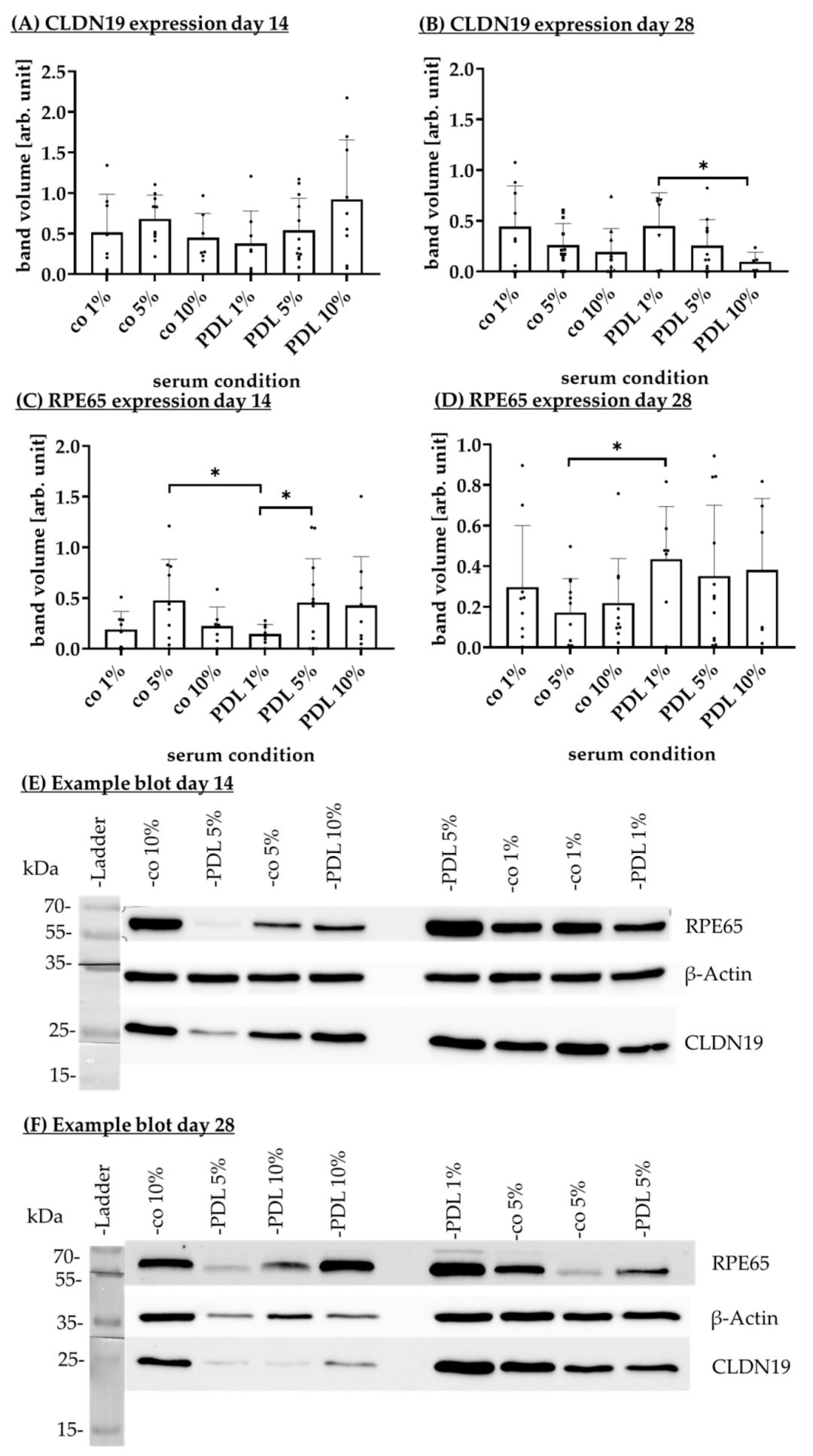
Fig18:不同血清含量对 RPE 蛋白表达的影响
该图为 Western blot 检测血清含量对 RPE65/CLDN19 的影响:14 天时 PDL+5% 血清 RPE65 表达(0.45±0.43 arb. unit)显著高于 PDL+1% 血清(0.14±0.09 arb. unit),与 PDL+10% 血清(0.43±0.48 arb. unit)无差异;28 天时 PDL+1% 血清 CLDN19 表达(0.45±0.33 arb. unit)显著高于 PDL+10% 血清(0.10±0.09 arb. unit),PDL+5% 血清居中(0.25±0.26 arb. unit)。结果证实 5% 血清可平衡 RPE 分化(RPE65)与紧密连接(CLDN19)功能,是最优血清浓度。
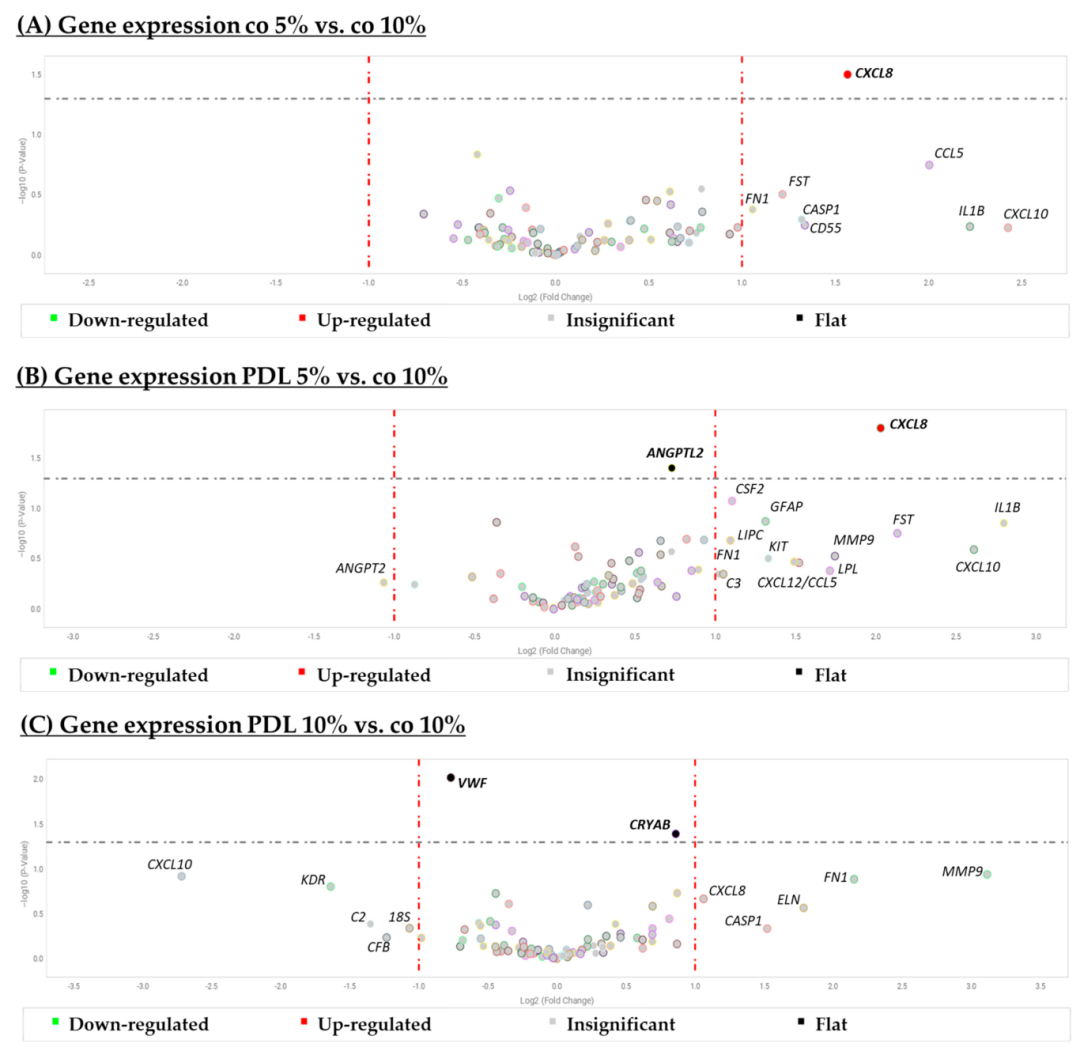
Fig19:不同条件下 RPE 基因表达的火山图
该图为 qPCR 检测 “PDL / 无涂层 + 5%/10% 血清” 组合的基因表达差异:与 “无涂层 + 10% 血清”(标准组)相比,PDL+5% 血清组 CXCL8(促炎因子)显著上调(Rq=4.084,p=0.016),ANGPTL2(血管调节因子)轻微上调(Rq=1.657,p=0.039);PDL+10% 血清组 CRYAB(抗凋亡因子)轻微上调(Rq=1.815,p=0.040),VWF(血管因子)轻微下调(Rq=0.587,p=0.010);无其他显著差异基因。结果表明 5% 血清 + PDL 涂层仅微调关键功能基因,不改变 RPE 整体基因特征,进一步验证该条件的可靠性。
本研究完整建立了猪 RPE 单眼原代培养的标准化方案,核心优化参数与验证结果如下:1. 死后时间:4-5h 为最优,平衡细胞活力(存活率 63.19%)与分化效率(上皮细胞占比 78.33%);2. 培养涂层:PDL 涂层最优,7 天融合率达 100%,RPE65 表达最高(0.37 arb. unit),且抑制上皮 - 间充质转化;3. 血清含量:5% 血清可替代 10% 血清,维持 RPE65(0.45 arb. unit)与 CLDN19(0.25 arb. unit)稳定表达,降低成本与异常 VEGF 分泌。该方案具备三大核心价值:①遗传同质(单眼单孔),模拟人类个体差异;②功能完整(高 TEER、生理 VEGF 分泌),接近人类 RPE;③符合 3R 原则(利用屠宰场废弃猪眼)。为 AMD 的 RPE 功能异常、药物筛选、遗传机制研究提供标准化体外模型,填补传统模型的技术缺口。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:老年小鼠小胶质细胞原代培养方法:为衰老神经生物学研究提供新型工具