常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-12-29 09:02:04 细胞资源库平台 访问量:21
英文标题:Glucose starvation mimetic aldometanib removes immune barriers permitting mice with hepatocellular carcinoma to live to normal ages
中文标题:葡萄糖饥饿模拟药物醛米坦尼通过移除免疫屏障使肝癌小鼠活至正常寿命
发表期刊:《Cell Research》
影响因子:25.7
作者单位:
厦门大学、福建医科大学、福建省肿瘤医院、河南大学等
作者信息:
Chen-Song Zhang, Jingfeng Liu, Sheng-Cai Lin
1.肿瘤代谢异常与免疫抑制的关系
肿瘤组织及其旁组织的代谢紊乱可导致免疫抑制,促进肿瘤发展。代谢干预作为治疗策略尚未取得显著成效。
2.AMPK在代谢调节中的作用
AMPK是代谢稳态的关键调控因子,通过调节合成代谢与分解代谢平衡影响肿瘤微环境。
3.醛米坦尼的作用机制
醛米坦尼通过靶向溶酶体相关醛缩酶模拟葡萄糖饥饿状态,激活溶酶体AMPK,调节代谢平衡,但此前其在肿瘤治疗中的作用尚未明确。
4.研究创新点
首次证实醛米坦尼通过激活AMPK重塑肿瘤免疫微环境,促进CD8⁺ T细胞浸润,实现非细胞毒性的肿瘤抑制,使肝癌小鼠存活至正常寿命。
1.肝癌模型构建
DEN-HFD诱导的肝癌模型
MYC;Trp53⁻/⁻ 肝癌模型
Hepa1-6原位移植瘤模型
患者来源肝癌细胞移植模型
2.药物处理与剂量优化
醛米坦尼通过饮用水给药,剂量为50–150 mg/L,持续处理至小鼠自然死亡或实验终点。
3.免疫细胞分析与流式细胞术
通过流式细胞术分析肿瘤组织中CD8⁺ T细胞、Treg、巨噬细胞、树突状细胞等免疫细胞亚群。
4.细胞死亡与增殖检测
TUNEL检测肿瘤细胞凋亡
Ki-67染色评估增殖活性
免疫印迹检测凋亡与焦亡标志物
5.代谢与信号通路分析
AMPK、mTORC1通路活性检测
代谢物水平测定(ATP、ADP、AMP)
6.免疫细胞清除与功能验证
使用CD8⁺ T细胞清除抗体验证其在醛米坦尼抗肿瘤作用中的必要性。
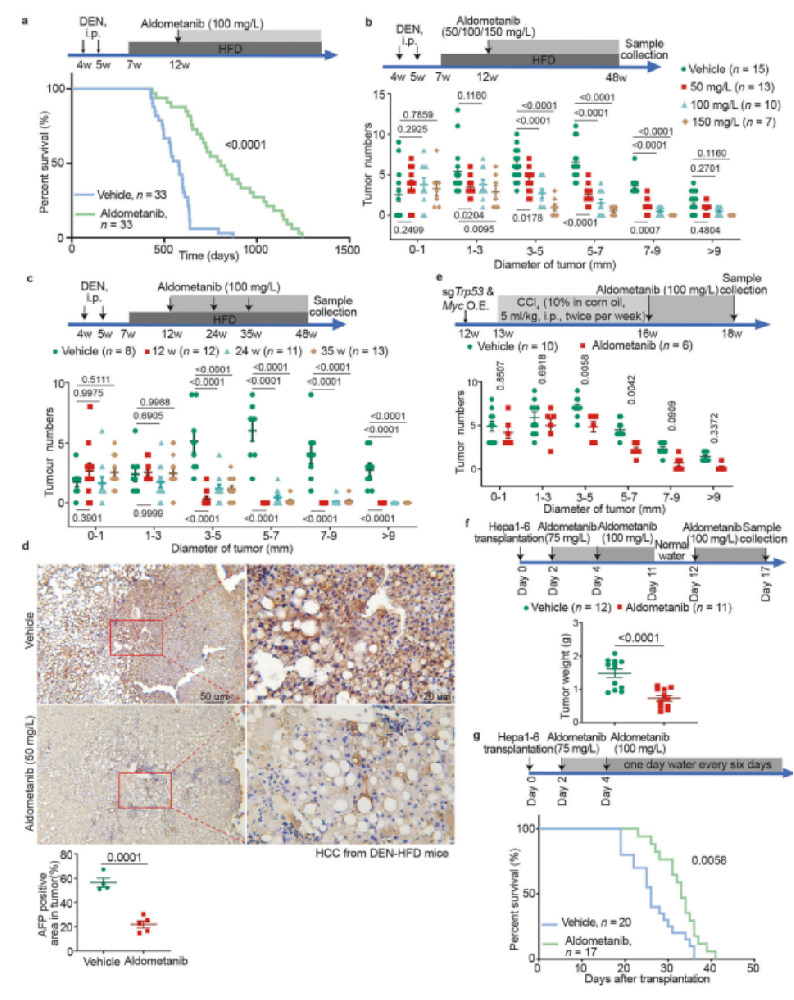
图1 Aldometanib抑制 HCC
a. 经Aldometanib治疗,携带肝细胞癌(HCC)的小鼠存活到了与正常小鼠相近的年龄。对4周龄的野生型C57BL/6小鼠,每周进行一次腹腔注射二乙基亚硝胺(DEN),持续2周,2周后开始喂食高脂饮食(HFD)。从12周龄起,这些小鼠在饮用水中接受100 mg/L的Aldometanib。携带HCC小鼠的寿命通过Kaplan - Meier曲线呈现(补充信息中的统计分析,表S1也有相关内容)。接受Aldometanib处理的DEN - HFD小鼠平均生存时长为805天,与我们38以及其他研究者确定的正常健康小鼠796天的生存时长相近。42
b. Aldometanib可抑制DEN - HFD小鼠中HCC的生长。采用与a相同的方法,用DEN和HFD诱导小鼠产生HCC。从12周龄开始,在饮用水中给予小鼠50 mg/L、100 mg/L或150 mg/L的Aldometanib,并在48周龄时收集组织样本(上图展示)。每个剂量组的肿瘤数量按大小/直径分类统计,分为0 - 1 mm、1 - 3 mm、3 - 5 mm、5 - 7 mm、7 - 9 mm和>9 mm的肿瘤(下图呈现,数据以均值±标准误表示,n值表示每种条件下使用的小鼠数量,标注在各图中,P值通过双因素方差分析后进行Tukey检验计算得出)。
c. Aldometanib对晚期HCC有有效的抑制作用。同样采用a中的方法,用DEN和HFD诱导小鼠产生HCC。从12周、24周或35周龄开始,通过饮用水给予小鼠100 mg/L的奥多替尼(上图所示)。每个奥多替尼给药时间点不同尺寸/直径类别的肿瘤数量如图所示(下图呈现,数据以均值±标准误表示,n值代表各起始年龄组的小鼠数量,标注在各图中,P值通过双因素方差分析后进行Tukey检验计算得出)。
d. 奥多替尼能抑制DEN - HFD小鼠的甲胎蛋白(AFP)水平。按照b部分的方法制备奥多替尼处理组与未处理组的DEN - HFD小鼠的HCC组织,并进行AFP的免疫组化(IHC)染色。不同放大倍数下的代表性图像如上图所示,计算得出的HCC组织中AFP阳性区域的百分比显示于下图(均值±标准误,每组治疗组n = 4(溶剂对照)或5(奥多替尼),P值通过双侧Student's t检验计算得出)。
e. 奥多替尼可抑制MYC;Trp53−/−小鼠的HCC。对12周龄的野生型BALB/c小鼠,通过尾静脉水动力注射携带靶向Trp53的sgRNA质粒(用于敲除)以及Myc过表达质粒。一周后,小鼠每周两次腹腔注射四氯化碳,持续3周(上图所示)。从16周龄开始,通过饮用水给予小鼠100 mg/L的奥多替尼。第18周时对小鼠实施安乐死,不同尺寸/直径类别的肿瘤数量如图所示(下图呈现,数据以均值±标准误表示,每组样本量标注在各图中,P值通过双因素方差分析结合Sidak检验计算得出)。
f. 阿来替尼可减小源自Hepa1 - 6肝癌细胞的原位异体移植瘤的体积。将Hepa1 - 6细胞移植到C57BL/6小鼠左肝叶形成原位异体移植瘤。移植后第2天开始,通过饮用水途径给予小鼠阿来替尼治疗15天(上图所示)。第17天对小鼠实施安乐死,并测量原位异体移植瘤的重量。
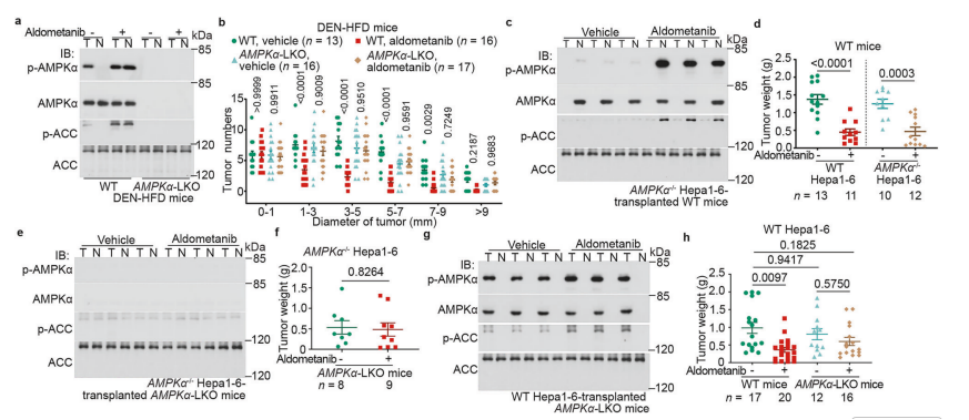
图2 AMPK 在para- HCC 中对醛美替尼诱导的 HCC 抑制起主导作用
a,b 在肝脏中,AMPK的缺失导致醛美替尼对肝细胞癌(HCC)的抑制效果失效。实验采用DEN和HFD诱导C57BL/6小鼠(包括肝脏特异性AMPKα敲除小鼠,即AMPKα-LKO,以及野生型小鼠)产生HCC,随后按照图1a所示方法用醛美替尼进行治疗。治疗结束后,检测了肝脏中AMPK的活性(a)以及不同大小/直径类别的肿瘤数量(b;数据以均值±标准误表示,n值代表小鼠数量,并在每个图表中标注;P值通过双因素方差分析后,采用Tukey检验计算得出)。
c–h 宿主肝脏中的AMPK在醛美替尼抑制HCC原位异体移植过程中发挥关键作用。实验将野生型(c,d)或AMPKα-LKO C57BL/6小鼠(e,f)移植了野生型(g,h)或AMPKα−/−(c–f)Hepa1-6细胞,并按照图1f的方法用醛美替尼进行治疗。治疗后,测定了AMPK的活化水平(c,e,g)和肿瘤重量(d,f,h)(数据以均值±标准误表示,n值代表小鼠数量,并在每个图表中标注;P值通过双侧Student's t检验(d,f)或双因素方差分析后进行Tukey检验计算(h)得出)。本实验重复进行了三次。
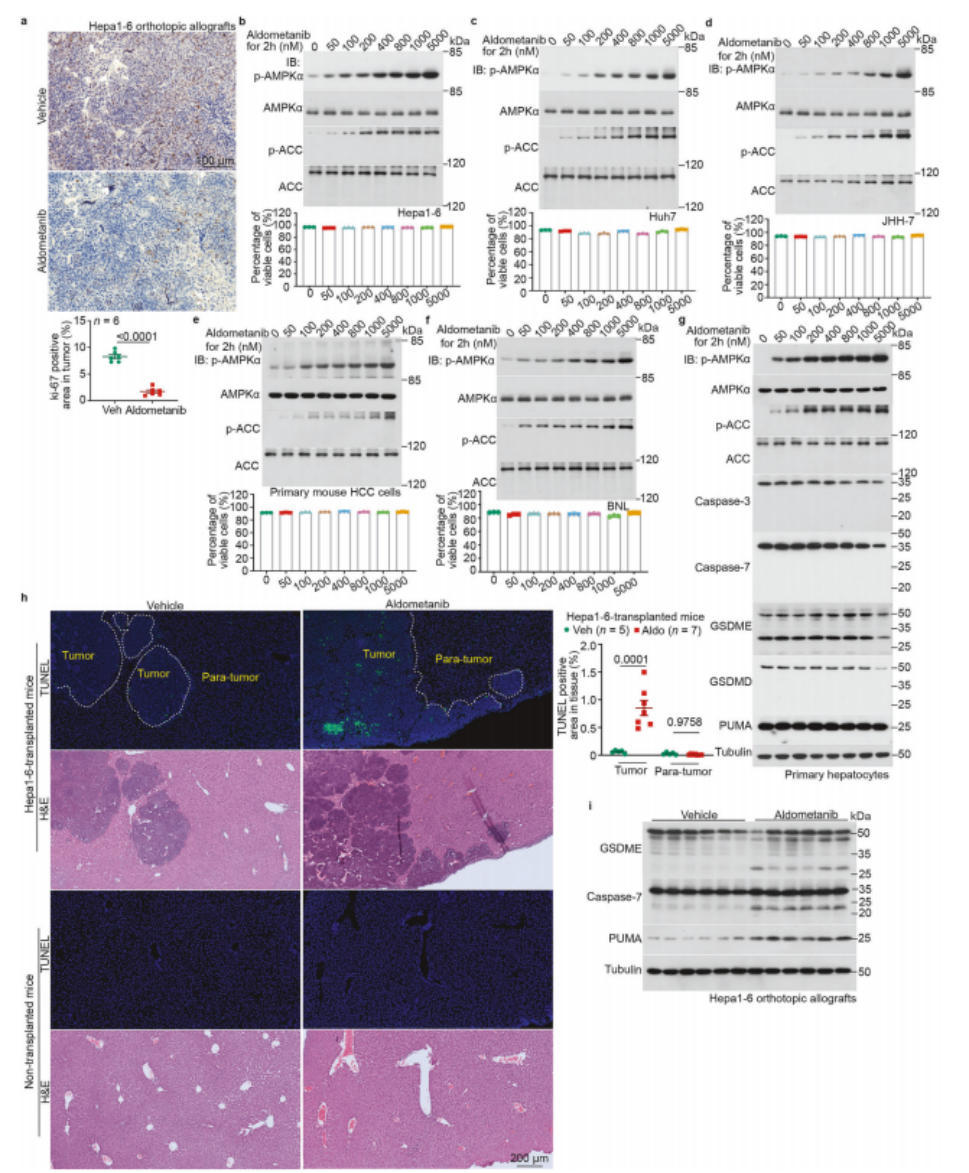
图3 阿来替尼在体内特异性诱导 HCC 组织细胞毒性
a 阿来替尼成功缩减了源自Hepa1-6细胞的HCC原位异体移植物的体积。实验中,对源自Hepa1-6细胞的HCC原位异体移植物切片进行了Ki-67的免疫组化(IHC)染色,如图1f展示。上图呈现了具有代表性的图像,下图则展示了HCC组织中Ki-67阳性区域的百分比(数据以均值±标准误表示,每种处理方式下n=6只小鼠,P值通过双侧Student's t检验计算得出)。比例尺设定为100 μm。
b–g 阿来替尼在培养的肝细胞中未显现出细胞毒性。实验涵盖了多种肝细胞类型,包括小鼠HCC细胞系Hepa1-6(b)、人HCC细胞系Huh7(c)和JHH-7(d)、原代小鼠HCC细胞(e)、正常小鼠肝细胞系BNL(f)以及原代小鼠肝细胞(g)。这些细胞均用指定浓度的阿来替尼处理了2小时。通过流式细胞术(b–f;门控策略详见补充信息图S7d,代表性密度图见补充信息图S7e–i;数据以均值±标准误表示,每种条件下n=3个生物学重复)计算了存活细胞的百分比(通过从总细胞计数中扣除早期凋亡、晚期凋亡和坏死性凋亡细胞得出)。同时,上图b–f中还展示了AMPK激活的免疫印迹,以及g中凋亡和焦亡的标志物。
h,i 阿来替尼诱导了HCC组织内的细胞死亡。实验对来自Hepa1-6细胞的同种异体移植HCC组织进行了TUNEL检测(h;左图为代表性图像,右图为肿瘤或旁肿瘤组织中TUNEL阳性区域的百分比,以均值±标准误表示;n值代表小鼠数量,标注于每幅图中,P值通过双因素方差分析后进行Tukey检验计算得出)。或进行了凋亡和焦亡标志物的免疫印迹(i)。比例尺为200 μm。本实验重复执行了三次。
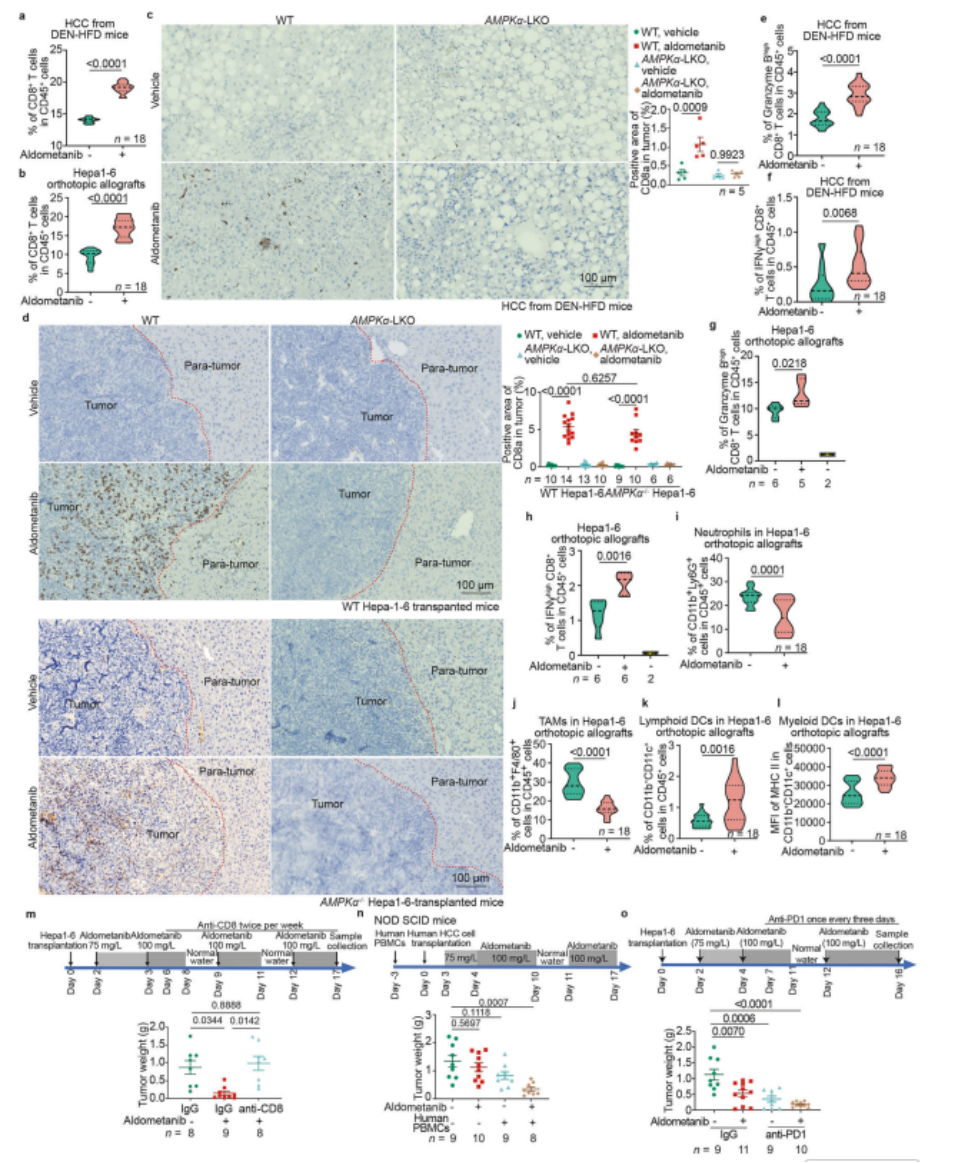
图4 阿来替尼诱导CD8+ T细胞浸润肿瘤
a,b 阿来替尼能够增强CD8+ T细胞在HCC组织中的浸润。对于DEN-HFD小鼠(a;制备细节见补充信息图S8a,于40周龄收集)或Hepa1-6来源的同种异体移植瘤(b;制备详情见补充信息图S8b,于移植后第10天收集),其HCC组织经I型胶原酶消化后,分别使用CD8a-Alexa Fluor 488、CD4-APC和CD45-PerCP-Cy5.5(a)或CD8a-APC和CD45-Alexa Fluor 488(b)抗体对CD8+ T细胞进行标记。随后,通过流式细胞术对染色细胞进行分析,以量化CD8+ T细胞的数量。数据以小提琴图形式呈现,其中下和上虚线分别代表第一和第三四分位数,中心虚线代表中位数,下和上限则分别表示最小和最大分数。所有后续小提琴图均遵循此格式。实验共包含n=18个样本,每组6只小鼠,P值通过双侧Student's t检验(b)或经Welch校正的双侧Student’s t检验(a)计算得出。关于流式细胞术分析的门控策略,请参考补充信息图S8a(a)和b(b),以及补充信息图S8c(a)和d(b)中的代表性密度图。
b,d 阿来替尼诱导CD8+ T细胞浸润HCC组织的过程依赖于AMPK。对HCC野生型或AMPKα-LKO DEN-HFD小鼠的组织(c)或从野生型或AMPKα−/− Hepa1-6细胞移植到野生型或AMPKα-LKO小鼠中的同种异体移植物(d)进行了IHC染色,以检测CD8a。左图展示了代表性图像,右图则显示了肿瘤区域中CD8阳性区域的百分比(均值±标准误,n代表小鼠数量,标注于每图中;P值通过双因素方差分析后进行Tukey检验计算得出)。比例尺为100 μm。
醛米坦尼通过激活AMPK,重塑肿瘤免疫微环境,促进CD8⁺ T细胞浸润与活化。其抗肿瘤作用依赖于宿主肝组织中的AMPK活性,而非肿瘤细胞自身。醛米坦尼无直接细胞毒性,但在体内诱导肿瘤细胞死亡,延长肝癌小鼠生存至正常寿命。
该研究为代谢干预作为肿瘤治疗策略提供了新思路,可能使癌症成为一种可控的慢性疾病。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:Bdellovibrio 分子工具箱实现基因表达与蛋白分泌精准调控
下一篇:基于吡唑的大环激酶抑制剂的设计与合成及对 BMPR2 的靶向作用