常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-12-28 09:04:21 细胞资源库平台 访问量:40
乙肝病毒(HBV)感染是全球主要公共卫生问题之一,有超过2.5亿人慢性感染HBV。而其中有超三分之一的人口集中在我国,人数接近1亿人。NTCP工具细胞,特别是外源表达NTCP的肝癌细胞系如HepG2-NTCP和Huh7-NTCP,因其易操作、短周期、重现性佳的特点,在乙肝病毒(HBV)研究中扮演着至关重要的角色。这些细胞模型能够有效模拟HBV的感染过程,为研究HBV的生命周期、宿主限制因子、病毒复制以及药物筛选提供了一个强大而便捷的体外平台。它们不仅有助于揭示HBV感染的分子机制,如DDX3作为宿主限制因子阻碍cccDNA转录,GPC5作为附着因子在感染入胞过程中的作用,还能通过直接与NTCP相互作用或下调NTCP表达来筛选和验证抗病毒药物的活性,例如环孢菌素A及其衍生物、雷帕霉素及其衍生物等。此外,这些工具细胞还促进了对HBV宿主特异性分子的发现,为发展支持HBV感染的小动物模型提供了可能,这对于乙肝相关研究和药物开发具有重大意义。
英文标题:Role of sodium taurocholate cotransporting polypeptide (NTCP) in HBV-induced hepatitis: Opportunities for developing novel therapeutics
中文标题:牛磺胆酸钠共转运多肽 (NTCP) 在 HBV 诱导肝炎中的作用及新型治疗药物研发机遇
发表期刊:《Biochemical Pharmacology》
影响因子:5.6
作者单位:
1.Department of Pharmacology, College of Pharmaceutical Sciences, Zhejiang University of Technology, Hangzhou, China
2.Center for Clinical Pharmacy, Cancer Center, Department of Pharmacy, Zhejiang Provincial People’s Hospital (Affiliated People’s Hospital), Hangzhou Medical College, Hangzhou, Zhejiang, China
3.Key Laboratory of Endocrine Gland Diseases of Zhejiang Province, Hangzhou, China
作者信息:
Zhentao Zhang¹, Qi Zhang¹(共同第一作者), Yiwen Zhang²,³, Yutao Lou¹, Luqi Ge¹, Wanli Zhang¹,³*, Wen Zhang¹, Feifeng Song²,³*, Ping Huang²
乙型肝炎病毒(HBV)感染是全球性公共卫生难题,慢性感染易进展为肝硬化、肝细胞癌(HCC),给患者和社会带来沉重负担。HBV 入侵肝细胞依赖内吞作用,需硫酸乙酰肝素蛋白聚糖(HSPGs)、表皮生长因子受体(EGFR)及牛磺胆酸钠共转运多肽(NTCP)等蛋白参与,其中 NTCP 是 HBV 入侵的关键受体(同时兼具胆汁酸转运功能)。目前靶向 NTCP 的抗 HBV 抑制剂虽有较多报道,但仅少数具备低 IC₅₀值。本综述系统梳理 NTCP 的分子结构、表达调控机制、介导 HBV 入侵的分子通路,以及靶向 NTCP 的新型治疗药物研究进展,为抗 HBV 药物研发提供核心理论支撑与方向指引。
本研究为系统综述,通过全面检索 HBV 感染、NTCP 功能及抗 HBV 药物相关的基础与临床研究文献,整合 NTCP 的分子结构特征、转录与翻译水平调控机制、介导 HBV 入侵的关键步骤;归纳靶向 NTCP(胆汁酸类似物、肽类、FDA 批准药物等)、EGFR 及 HBV 本身的各类抗 HBV 药物的作用机制、活性数据(IC₅₀)及临床应用潜力;结合体外细胞实验、动物模型实验及部分临床研究数据,进行多维度分析与总结。
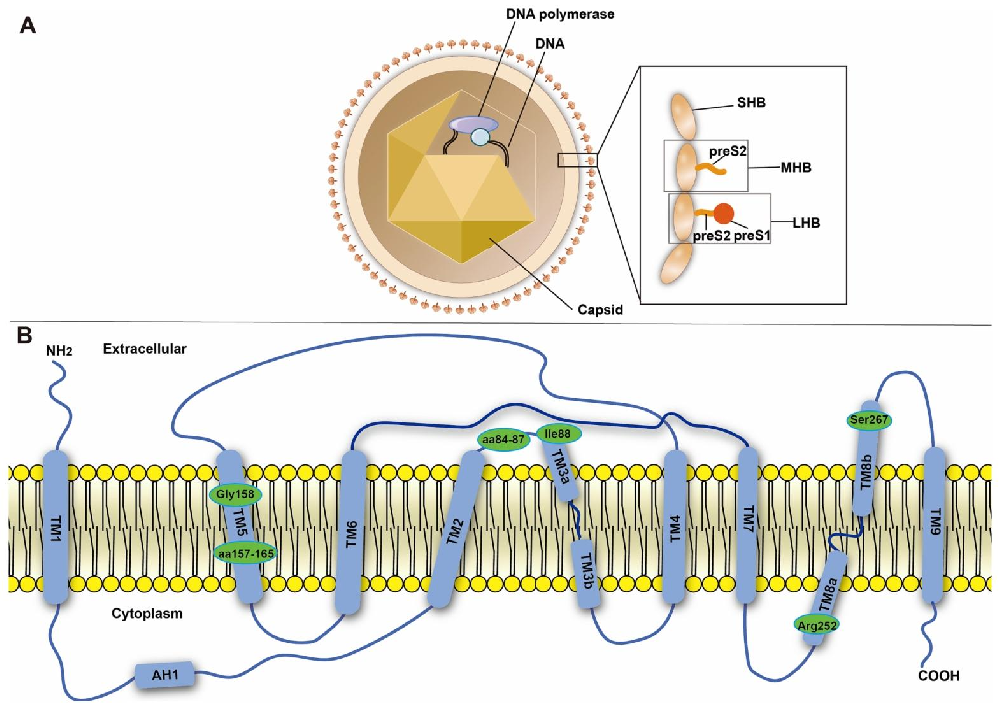
图 1:HBV 与 NTCP 的分子结构特征
该图明确 HBV 入侵的核心分子基础:图 1A 展示 HBV 结构,其包膜含大(LHBs)、中(MHBs)、小(SHBs)三种表面蛋白,三者共享 C 端 S 区,MHBs 额外含 preS2 区,LHBs 还具备 preS1 区;preS1 区 9-18 位氨基酸(NPLGFFPDHQ)是结合 NTCP 的关键序列,第 2 位甘氨酸的豆蔻酰化修饰可增强 HBV 感染性。图 1B 为 NTCP 结构,其含 9 个跨膜螺旋(TM1-TM9,TM3、TM8 分 a/b 亚型),157-165 位残基(KGIVISLVL)是 HBV 结合核心区域,G158 残基决定 HBV 物种感染特异性,S267F 突变可显著降低 HBV 感染易感性(健康人群突变频率 21%,HBV 感染者仅 6%)。
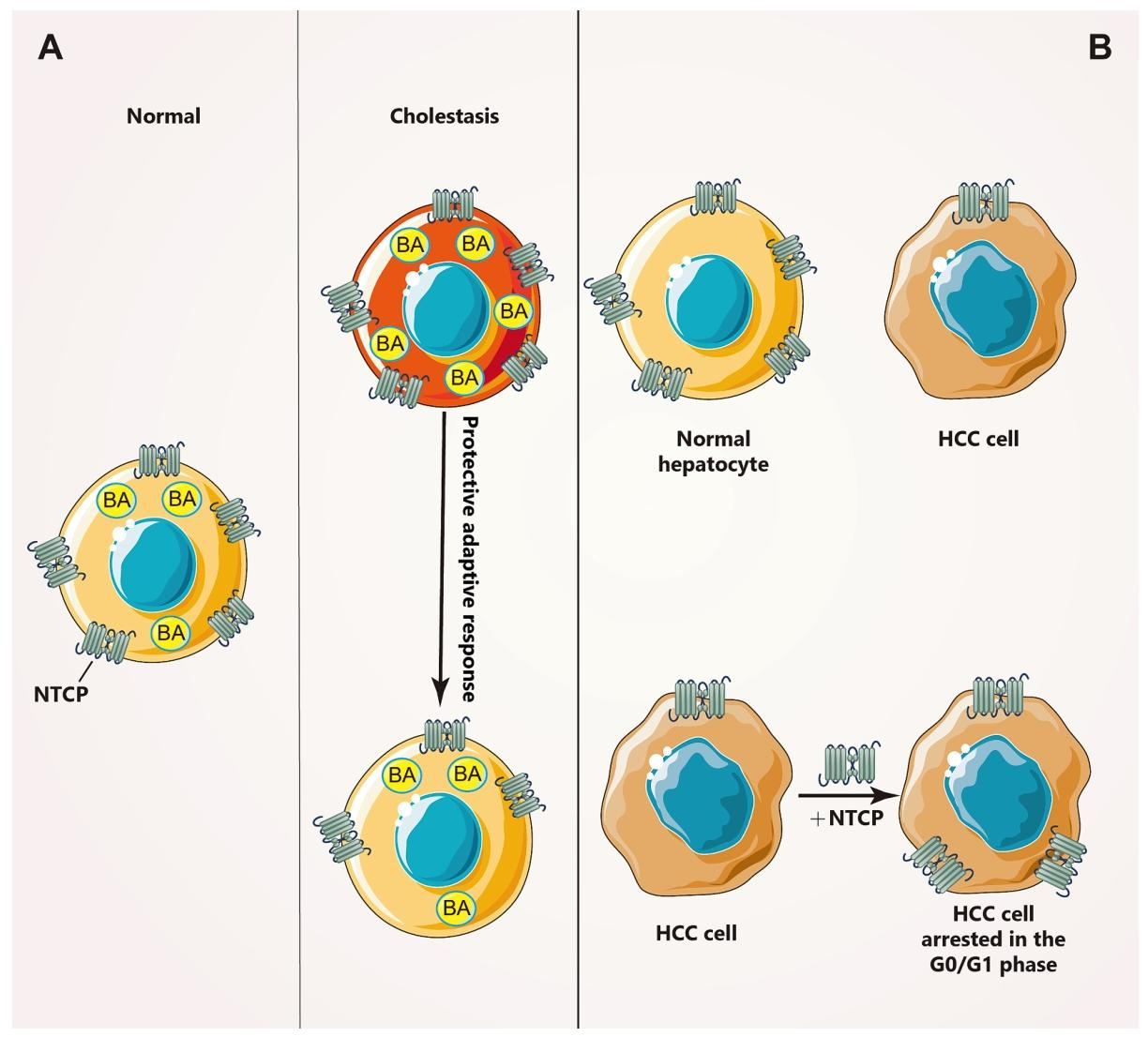
图 2:肝疾病中 NTCP 的表达变化规律
该图揭示 NTCP 与肝疾病的关联:图 2A 显示胆汁淤积时肝细胞 NTCP 表达水平降低约 41%,此为肝细胞应对胞内胆汁酸蓄积的保护性适应机制,可减少胆汁酸内流、降低细胞毒性。图 2B 表明肝癌细胞中 NTCP 表达显著下调,异位表达 NTCP 可使肝癌细胞停滞于 G0/G1 期;SLC10A1 基因 S267F 突变在健康人群中频率(16.4%-18.5%)高于肝癌患者(6.3%-13%),提示该突变可降低肝癌发病风险。
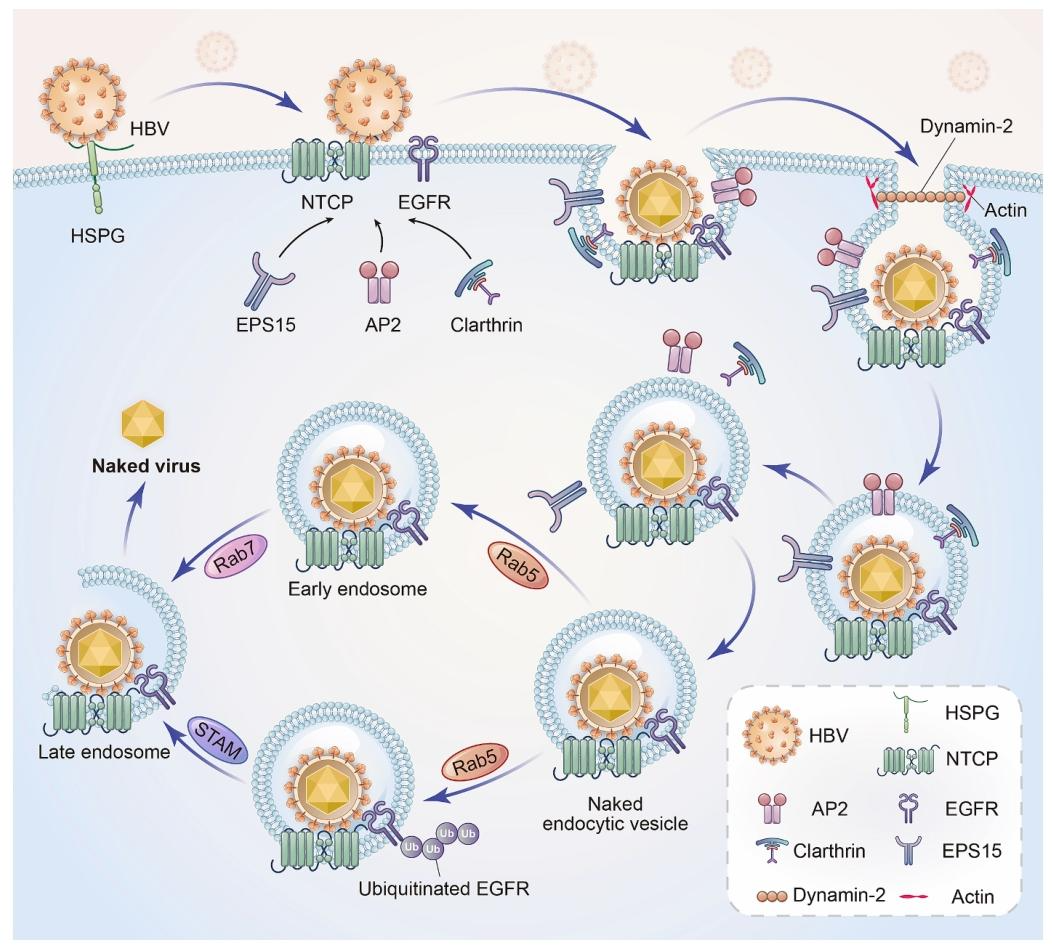
图 3:NTCP 介导 HBV 入侵肝细胞的分子机制
该图阐明 HBV 入侵的完整通路:HBV 先通过包膜蛋白 S 区抗原环的 Arg122、Lys141 与肝细胞表面 HSPGs 发生静电作用,实现低亲和力结合;随后 LHBs 的 preS1 区 9-18 位氨基酸与 NTCP 的 84-87 位环区特异性结合(Asn9 与 NTCP 的 Asn87 相邻);继而启动网格蛋白介导的内吞过程,需网格蛋白、AP-2、动力蛋白 - 2、EPS15 适配蛋白及肌动蛋白参与,完成包膜凹陷、囊泡切割与内体融合;内体运输阶段,Rab5 调控囊泡向早期内体转运,Rab7 介导向晚期内体 / 溶酶体转运;EGFR 作为共因子,其泛素化及信号转导适配分子可协调 HBV 在内体网络的运输,沉默 EGFR 可显著降低 HBV 感染效率。
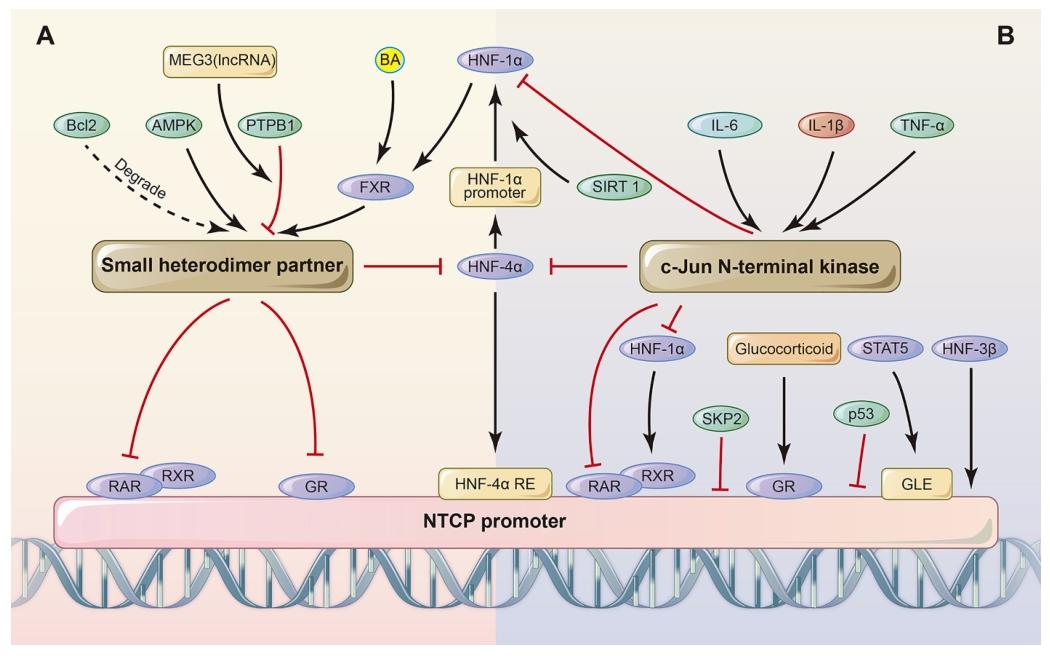
图 4:NTCP 的转录调控机制
该图解析 NTCP 表达的双重调控通路:
1.SHP 依赖通路:胆汁酸激活法尼酯 X 受体(FXR),上调小异二聚体伴侣(SHP);SHP 可直接抑制 RXR/RAR 异二聚体、糖皮质激素受体(GR)及肝细胞核因子(HNF-1α/4α),进而下调 NTCP 启动子活性;此外 MEG3 可招募 PTBP1 降低 SHP mRNA 稳定性,JNK、AMPK 可上调 SHP 转录,Bcl2 则会促进 SHP 降解。
2.SHP 非依赖通路:IL-1β/IL-6 等炎症因子激活 JNK,磷酸化 RXR 后抑制 RXR/RAR 复合物的核结合活性,从而下调 NTCP;TNF-α 可降低 HNF-1 的结合活性,STAT5 可直接结合 NTCP 启动子上调其表达,HNF-3β、p53、SKP2 则会抑制 NTCP 转录。
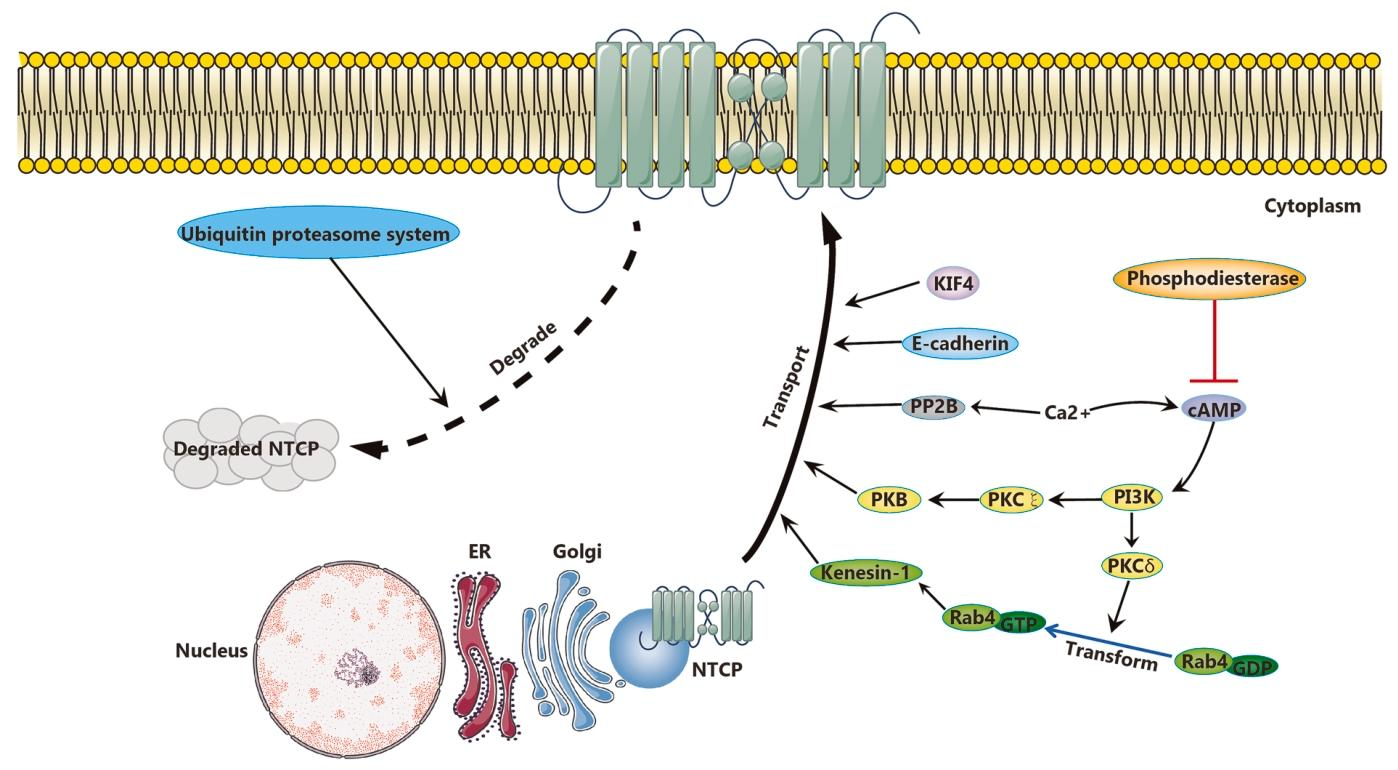
图 5:NTCP 细胞膜定位的调控机制
该图揭示 NTCP 功能发挥的亚细胞调控:cAMP 可通过 PI3K/PKB/PKCδ 轴激活 Rab4,借助驱动蛋白 - 1 促进 NTCP 向细胞膜转运,同时 cAMP 升高胞内 Ca²⁺浓度,激活钙调蛋白依赖的 PP2B,推动 NTCP 插入细胞膜;Ser226 的去磷酸化可增强 NTCP 的膜定位稳定性;KIF4 辅助 NTCP 从胞质向细胞膜运输;泛素 - 蛋白酶体系统(UPS)通过内质网相关降解(ERAD)介导成熟 NTCP 降解;E - 钙粘蛋白调控 NTCP 的膜分布,其表达降低会导致 NTCP 胞质聚集,进而影响 HBV 入侵。
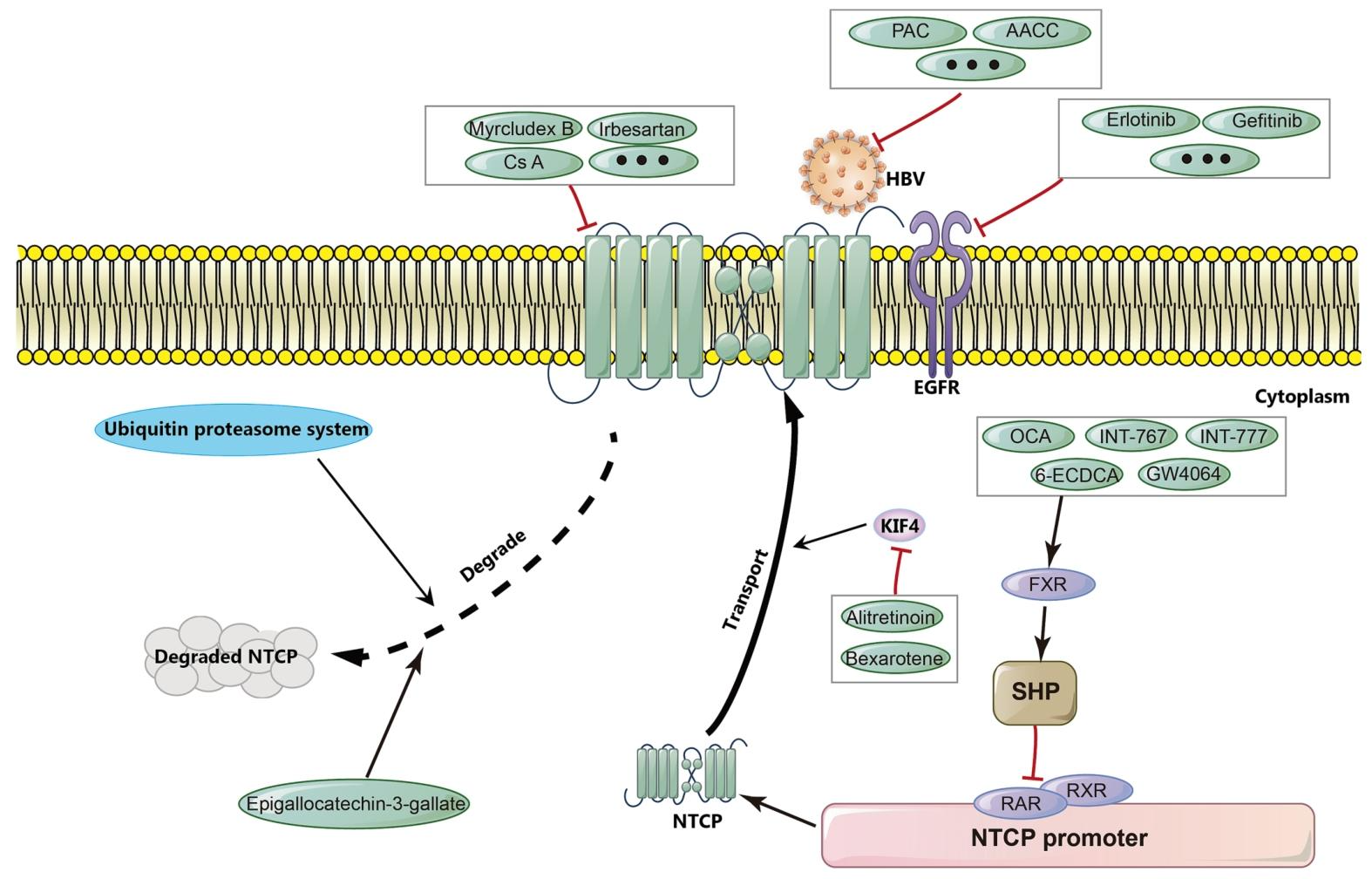
图 6:各类抗 HBV 药物的作用机制
该图归纳抗 HBV 药物的三大作用方向:
1.靶向 NTCP:胆汁酸类似物(INT-767)激活 FXR/TGR5、肽类(Myrcludex B)竞争性结合 NTCP、FDA 药物(环孢素 A)结合 NTCP 关键残基、天然提取物(姜黄素)及抗体(N6HB426-20)等,直接阻断 HBV 与 NTCP 的结合或抑制 NTCP 功能。
2.靶向 EGFR:厄洛替尼、吉非替尼等抑制剂可阻断 EGFR 的共因子功能,干扰 HBV 内吞运输。
3.靶向 HBV:原花青素(PAC)结合 HBV 大表面蛋白、FIT-039 抑制 HBV cccDNA 复制,直接抑制病毒生命周期。
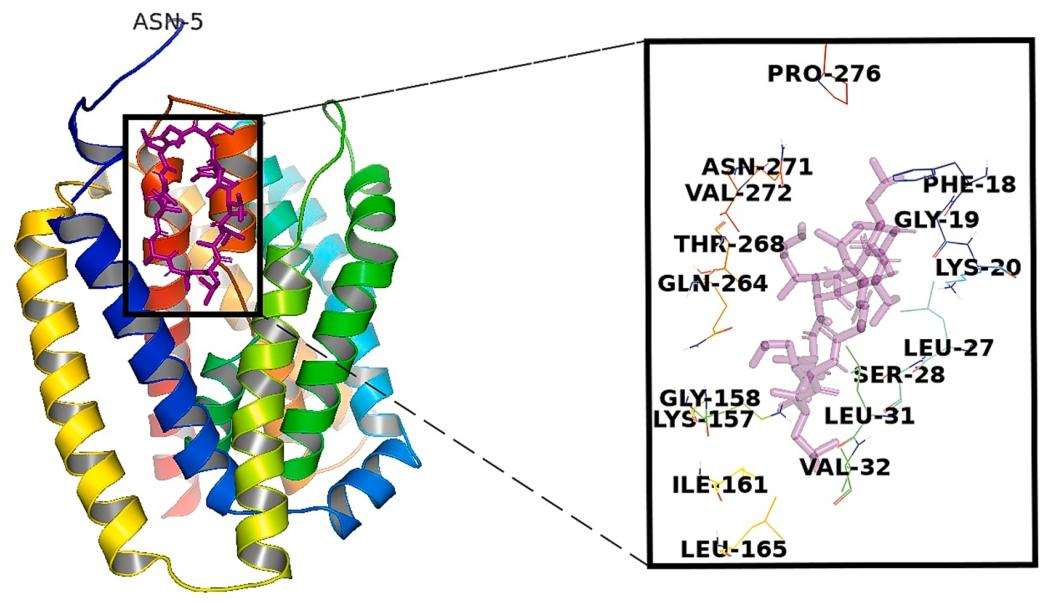
图 7:环孢素 A(CsA)与 NTCP 的相互作用模式
该图明确 CsA 的靶向结合位点:分子对接显示 CsA 可与 NTCP 的 157-165 位残基(Lys157、Gly158、Ile161、Leu165 等)结合,距离均小于 4Å,通过干扰 NTCP 与 preS1 的结合,实现对 HBV 入侵的抑制,其 IC₅₀值为 1.27μM。
本研究综述系统阐明了 NTCP 的分子结构、表达调控机制及介导 HBV 入侵的核心通路,同时全面梳理了三类抗 HBV 药物的研发进展:靶向 NTCP 的药物中,Myrcludex B(IC₅₀低至 pM 级)已进入临床研究,部分大环肽(WD1/WL4)可在不影响胆汁酸转运的前提下抑制 HBV;EGFR 抑制剂可阻断共因子功能,辅助降低 HBV 感染;直接靶向 HBV 的药物可精准干预病毒复制周期。目前多数抑制剂存在 IC₅₀值偏高的问题,且 NTCP 的 HBV 结合位点尚未完全明确,未来需进一步解析 NTCP 的精细结构与调控网络,开发兼具高活性与低副作用的新型抗 HBV 药物。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:靶向炎症核心枢纽 CEBPD!高通量筛选发现 BET/HDAC 抑制剂兼具表观调控与抗炎活性
下一篇:Bdellovibrio 分子工具箱实现基因表达与蛋白分泌精准调控