常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-12-25 09:00:41 细胞资源库平台 访问量:36
肿瘤转移是导致癌症患者预后不良的关键因素,其过程依赖肿瘤细胞与肿瘤微环境(TME)的复杂互作,尤其是肿瘤血管生成与肿瘤细胞的迁移侵袭。传统肿瘤类器官虽能模拟肿瘤结构和异质性,但缺乏功能性血管网络,难以重现肿瘤 - 血管动态互作及血管靶向治疗响应。现有血管化类器官模型多无法构建分级血管网络,限制了对肿瘤血管异质性及药物响应的研究。本研究开发了一种个性化血管化肿瘤类器官芯片(vascularized patient-derived tumor organoid-on-a-chip),通过构建肿瘤特异性分级微脉管系统,实现对肿瘤 - 血管动态互作的高分辨率实时观察,为评估转移风险和个性化治疗提供了新平台。
来自复旦大学、上海交通大学医学院等机构的 Yang Du、Yi-Ran Wang、Yan-Jun Liu、Fei Xavier Chen 团队在《Advanced Materials》期刊发表了题为“Personalized Vascularized Tumor Organoid-on-a-Chip for Tumor Metastasis and Therapeutic Targeting Assessment”的研究,该研究设计了包含 4 个独立功能单元的人类肿瘤血管周围微环境芯片(hTPV 芯片),通过压力稳定器优化凝胶加载,使内皮细胞和成纤维细胞自组装形成表达 VE - 钙粘蛋白和 CD31、具有中空管腔和灌注功能的分级血管网络(平均直径 16.6μm),共培养后可观察到肿瘤诱导的新生血管(无序、分支多)和原有血管网络(有序)形成的异质性脉管系统;研究发现高转移潜能骨肉瘤细胞(MNNG/HOS)可通过 Notch 通路诱导血管生成并向血管迁移,低转移潜能细胞(U2OS)无此现象,且患者来源肿瘤类器官(PDTO)实验显示转移性患者的 PDTO 血管生成能力和向血管迁移能力显著高于非转移性患者,与临床结果高度一致;此外,抗血管生成药物阿帕替尼可抑制肿瘤诱导的新生血管芽生但对成熟血管影响较小,模拟临床响应,RNA-seq 和 GSEA 分析证实 Notch 通路(如 NOTCH4、DLL4)是肿瘤细胞向血管迁移的关键调控通路。
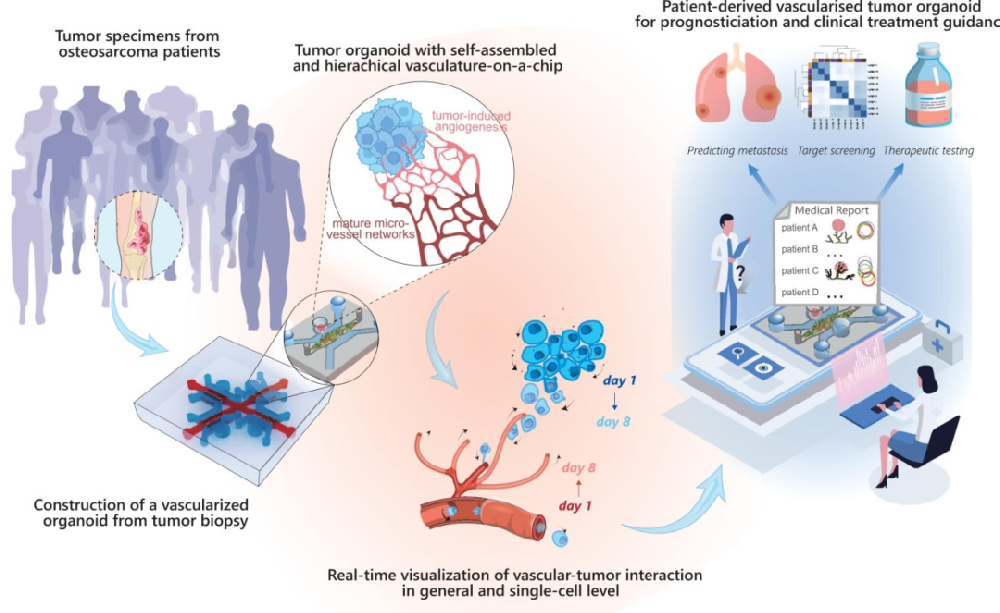
图1:血管化患者来源类器官研究示意图
内容:展示从骨肉瘤患者肿瘤样本构建 PDTO,在芯片上形成血管化类器官,通过实时观察肿瘤 - 血管互作,实现转移预测、靶点筛选和治疗测试的全流程。临床样本(患者 A-E)的 PDTO 行为与转移结果关联,验证模型的临床相关性。
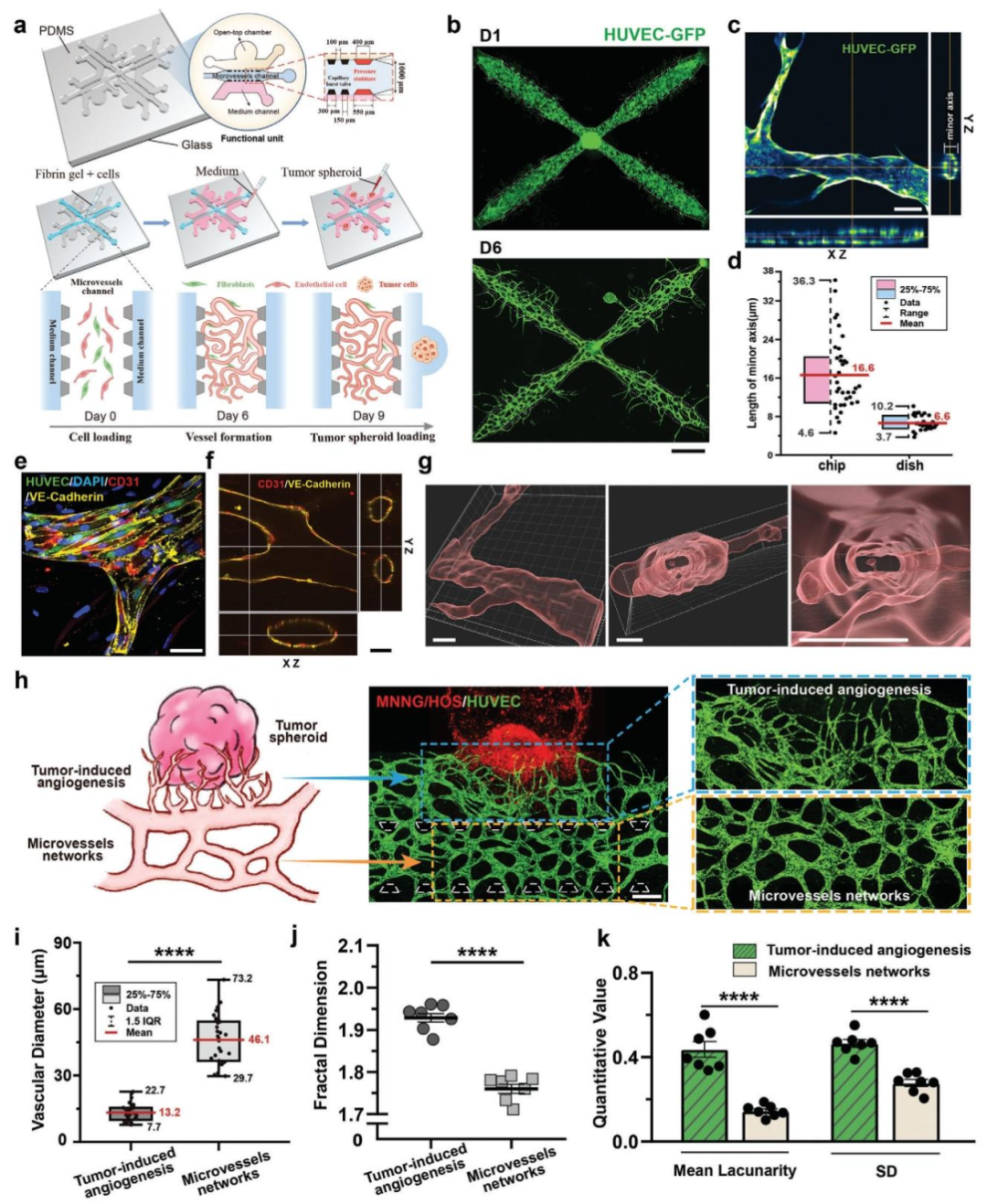
图2:hTPV 芯片构建肿瘤血管周围微环境
内容:芯片设计包含微血管通道(内皮细胞 GFP 标记)、肿瘤球加载室和培养基通道,第 6-9 天内皮细胞自组装形成分级血管(表达 VE - 钙粘蛋白和 CD31,具有中空管腔和灌注功能)。共培养肿瘤球后,观察到肿瘤诱导的新生血管(无序、分支多)和原有血管网络(有序),形成异质性脉管系统(新生血管直径更小,分形维数更高)。
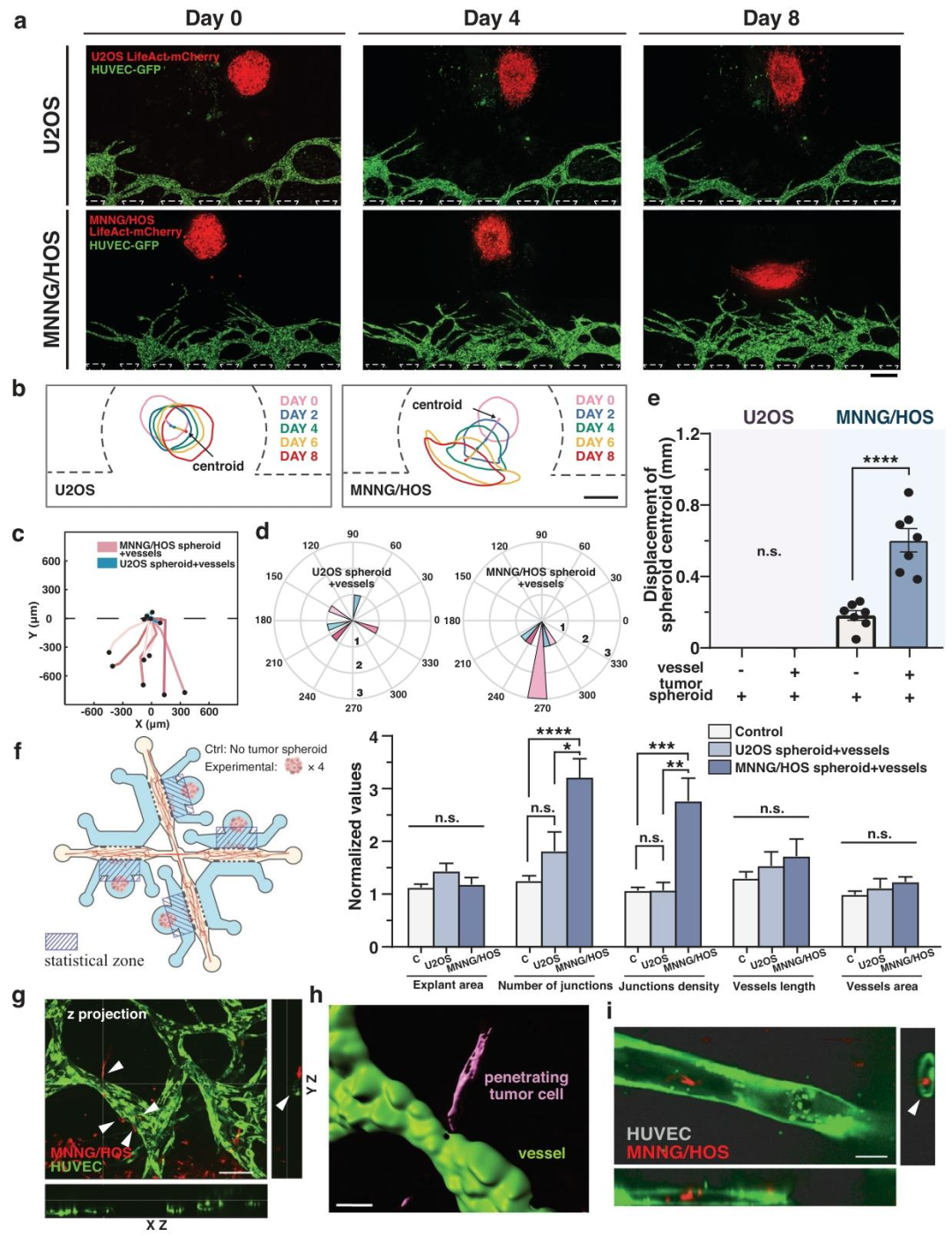
图3:不同转移潜能肿瘤细胞的血管互作差异
内容:高转移 MNNG/HOS 细胞球与血管互作密切,8 天内集体迁移距离达 600μm,诱导血管连接数和密度显著增加;低转移 U2OS 细胞球几乎不迁移,无明显血管生成。高转移细胞可沿血管爬行、穿透血管腔并在腔内迁移,最终外渗,模拟转移全流程。
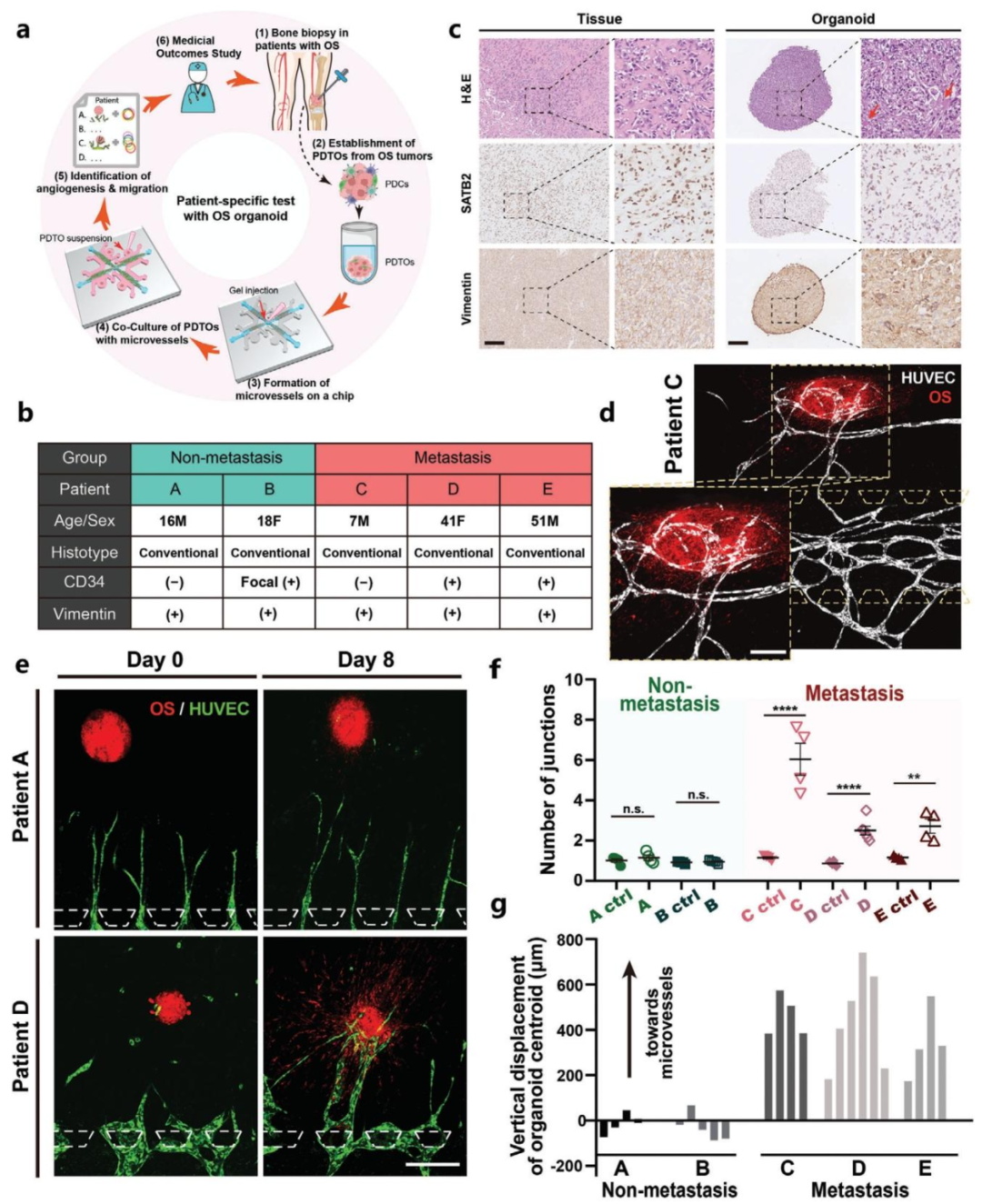
图4:PDTO 的转移潜能与临床结果关联
内容:从 5 例骨肉瘤患者(3 例非转移、2 例转移)构建 PDTO,HE 和免疫组化显示 PDTO 保留原发肿瘤特征(如骨基质形成、SATB2 和波形蛋白表达)。转移性 PDTO 可诱导血管生成(连接数增加 73.2%),并向血管定向迁移;非转移性 PDTO 无此现象,与患者临床转移状态完全一致。
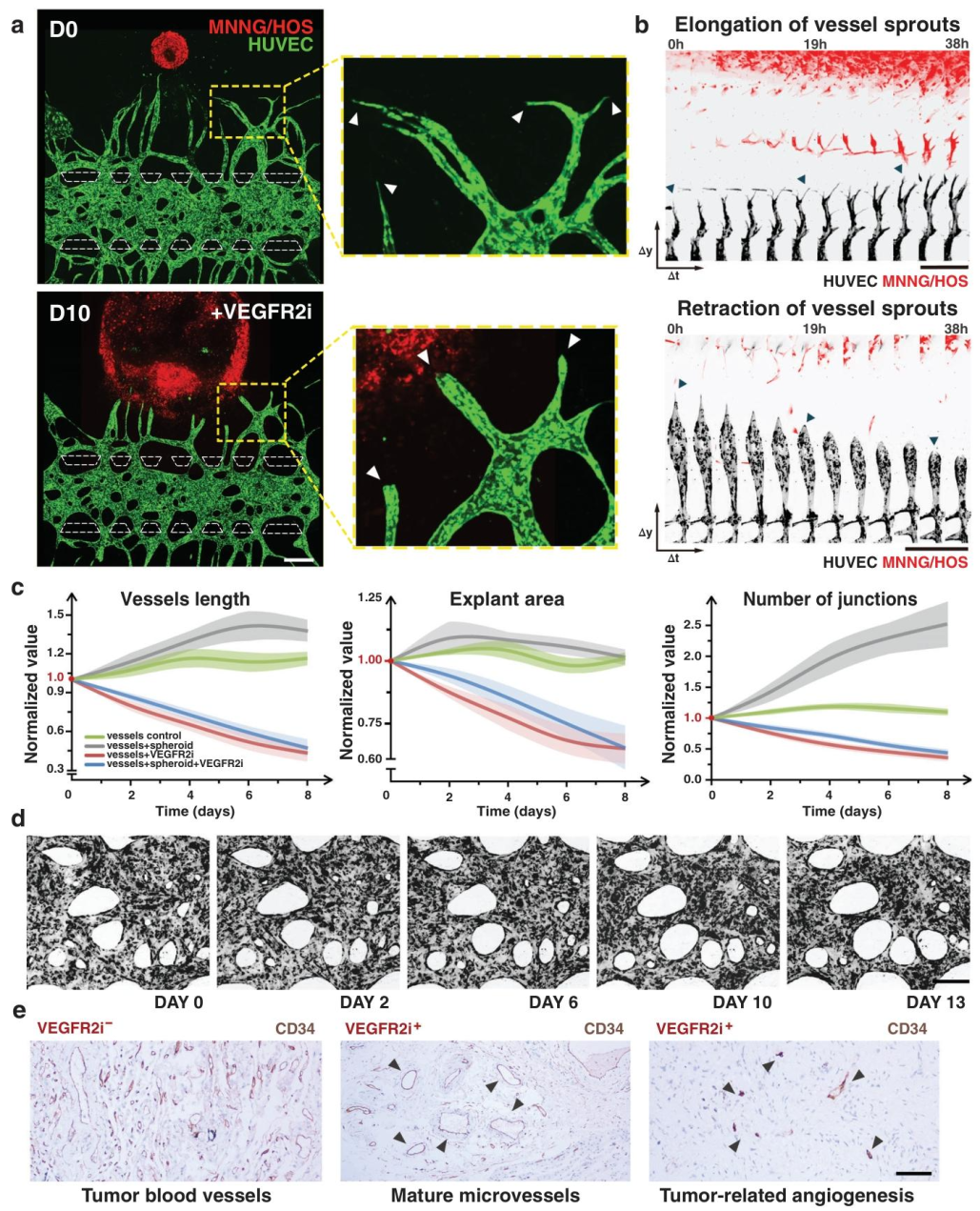
图5:抗血管生成药物的靶向效应
内容:阿帕替尼处理后,肿瘤诱导的新生血管芽生退缩(长度和连接数减少),内皮尖端细胞消失;成熟血管仅轻微收缩,与临床样本中 “抑制新生血管而保留成熟血管” 的响应一致。
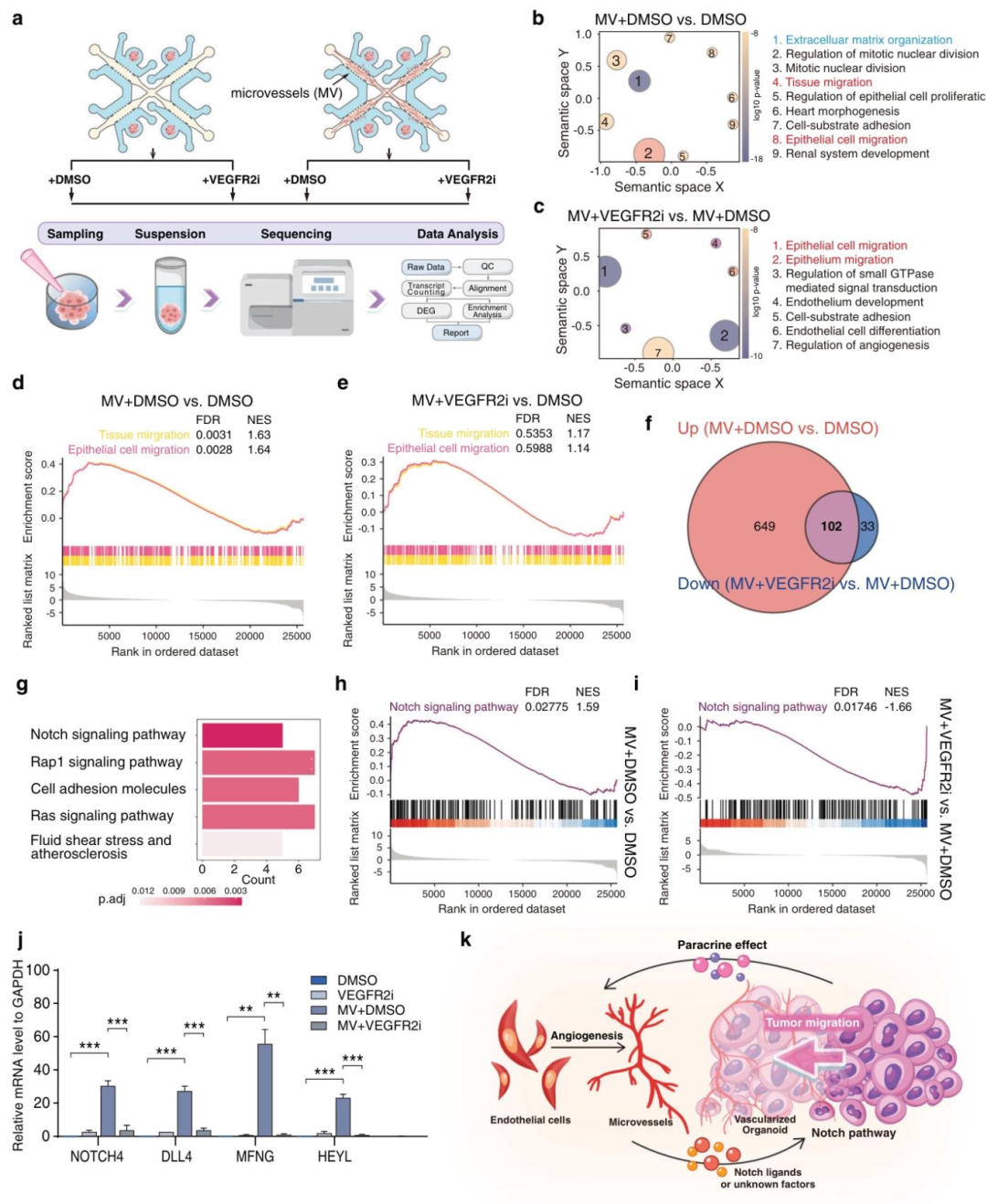
图6:Notch 通路调控肿瘤向血管迁移
内容:RNA-seq 显示,血管共培养激活肿瘤细胞的 “组织迁移”“上皮细胞迁移” 通路,VEGFR2 抑制剂可逆转这些变化;GSEA 和 qPCR 证实 Notch 通路(NOTCH4、DLL4、MFNG)是核心调控因子,其表达在转移性 PDTO 中显著上调。
本研究开发的血管化肿瘤类器官芯片(hTPV 芯片)通过创新设计构建了肿瘤特异性分级血管网络,解决了传统类器官血管缺失的问题,其包含的独立功能单元支持内皮细胞自组装形成具有灌注功能的异质性脉管系统,能重现不同转移潜能肿瘤细胞与血管的互作差异,且患者来源肿瘤类器官(PDTO)的血管生成和迁移能力可准确关联临床转移结果,同时揭示了 Notch 通路在肿瘤向血管迁移中的关键作用,抗血管药物测试验证了模型对临床响应的模拟能力,虽存在未整合免疫细胞、血管网络复杂度低于体内等局限,但该平台为肿瘤转移机制研究、个性化转移风险评估及血管靶向药效筛选提供了有力工具,有望加速相关疗法的临床转化。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000