常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-12-19 09:00:00 细胞资源库平台 访问量:93
Reporter THP1 Cell Line 细胞系是以 THP-1 为工具细胞,采用慢病毒感染的方式,构建稳定表达报告基因的细胞系,可用于检测信号通路转导。在被PMA、INF-α等刺激后,目标信号通路被激活,会启动下游特定基因的表达,这个表达过程会同时带动“报告基因”的表达。通过检测报告基因的信号强度,可以间接、定量、灵敏地衡量该信号通路的激活程度。
THP-1细胞本身来源于人单核细胞,可以分化为巨噬细胞样细胞,是研究先天免疫的经典模型。报告基因株的建立使其功能更强大。THP-1报告基因株是免疫学、炎症性疾病、药物研发等领域不可或缺的强大工具。它可以将一个复杂的、内在的生物学过程(信号通路激活/基因表达)转变为一个易于检测、可定量的物理信号(光或荧光)。这使得研究人员能够高通量地筛选药物,精确地量化免疫反应强度,直观地研究信号通路机制。
英文标题:LINC01270 Regulates the NF-κB-Mediated Pro-Inflammatory Response via the miR-326/LDOC1 Axis in THP-1 Cells
中文标题:LINC01270 通过 miR-326/LDOC1 轴调控 THP-1 细胞中 NF-κB 介导的促炎反应
发表期刊:《Cells》
影响因子:5.2
作者单位:
1.School of Life Sciences, Kyungpook National University, Daegu 41566, Republic of Korea
2.BK21 FOUR KNU Creative BioResearch Group, Kyungpook National University, Daegu 41566, Republic of Korea
3.Brain Science & Engineering Institute, Kyungpook National University, Daegu 41944, Republic of Korea
4.Department of Pharmacology, School of Medicine, Kyungpook National University, Daegu 41944, Republic of Korea
5.BK21 Plus KNU Biomedical Convergence Program, School of Medicine, Kyungpook National University, Daegu 41944, Republic of Korea
作者信息:
Imene Arab¹,², Su-Geun Lim¹,², Kyoungho Suk³,⁴,⁵, Won-Ha Lee¹,²,³*
炎症是机体应对有害刺激的复杂免疫反应,NF-κB 作为核心转录因子,调控促炎细胞因子和趋化因子的转录,其活性失衡与慢性炎症及相关疾病密切相关。长链非编码 RNA(lncRNA)LINC01270 在多种癌症中被报道参与调控,但在炎症反应中的作用尚未明确。本研究旨在探索 LINC01270 在脂多糖(LPS)刺激的人单核细胞白血病 THP-1 细胞中对 NF-κB 介导炎症反应的调控作用及分子机制,为炎症相关疾病的治疗提供新靶点。
本研究以 THP-1 细胞(人单核细胞白血病细胞)和 HEK293 细胞为研究对象,THP-1 细胞培养于含 10% 胎牛血清、0.05 mM β- 巯基乙醇等添加剂的 RPMI 1640 培养基,HEK293 细胞培养于高糖 DMEM 培养基;通过 siRNA 沉默 LINC01270,借助 dCas9-VP64 系统过表达 LINC01270,使用 miR-326 抑制剂及模拟 LINC01270 miR-326 结合位点的 decoy RNA 干扰分子互作;采用 qRT-PCR 检测 LINC01270、miR-326、LDOC1 及促炎细胞因子(IL-6、IL-8、MCP-1)的 mRNA 水平,ELISA 定量细胞因子分泌,Western blot 检测 NF-κB 通路相关蛋白(p65、磷酸化 p65、IκBα、磷酸化 IκBα)及 LDOC1 的表达,双荧光素酶报告基因实验验证 NF-κB 活性及 miR-326 与 LDOC1 的结合,吞噬实验检测细胞吞噬功能,通过生物信息学工具(lncRNASNP、miRDB、TargetScan)预测 RNA 互作位点,所有统计分析采用 GraphPad Prism 5 软件,p<0.05 为差异有统计学意义。
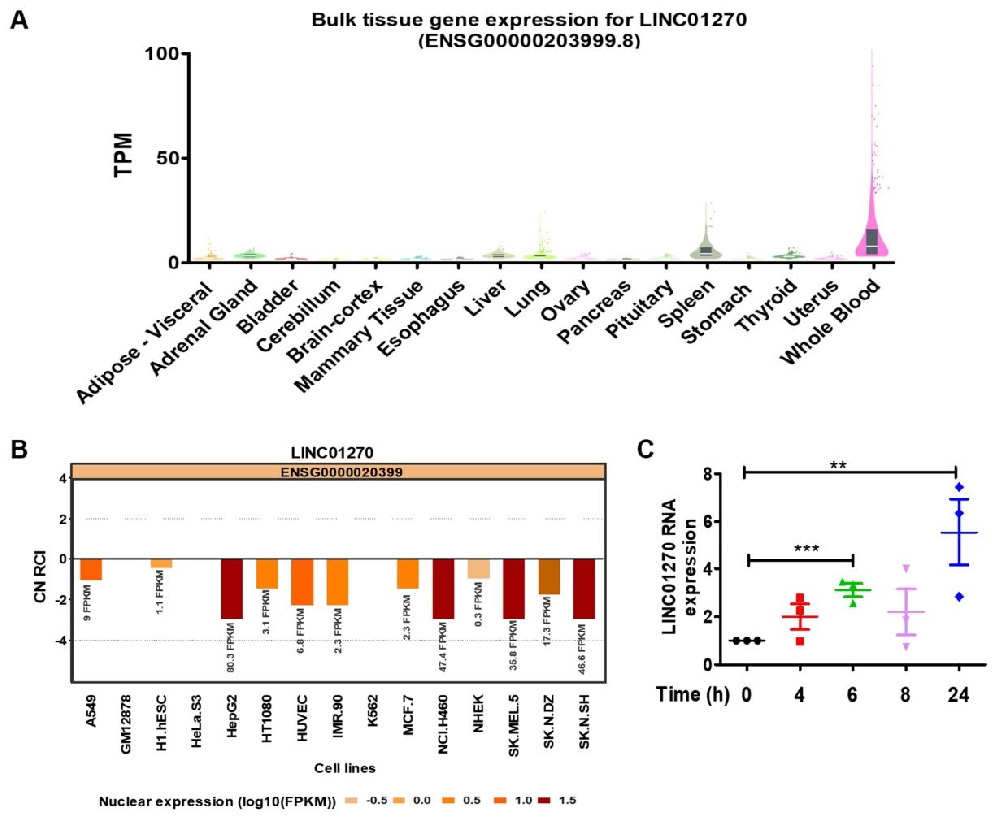
图 1:LPS 处理上调 THP-1 细胞中 LINC01270 的表达
该图明确 LINC01270 与炎症刺激的关联:GTEx 数据库显示 LINC01270 在脾脏和全血中高表达(图 1A);生物信息学及细胞分馏实验证实其主要定位于细胞核(图 1B);LPS(1μg/mL)刺激 THP-1 细胞后,LINC01270 表达呈双相上调,6 小时和 24 小时表达显著升高,8 小时短暂下降(图 1C),符合 LPS 诱导炎症信号的特征。
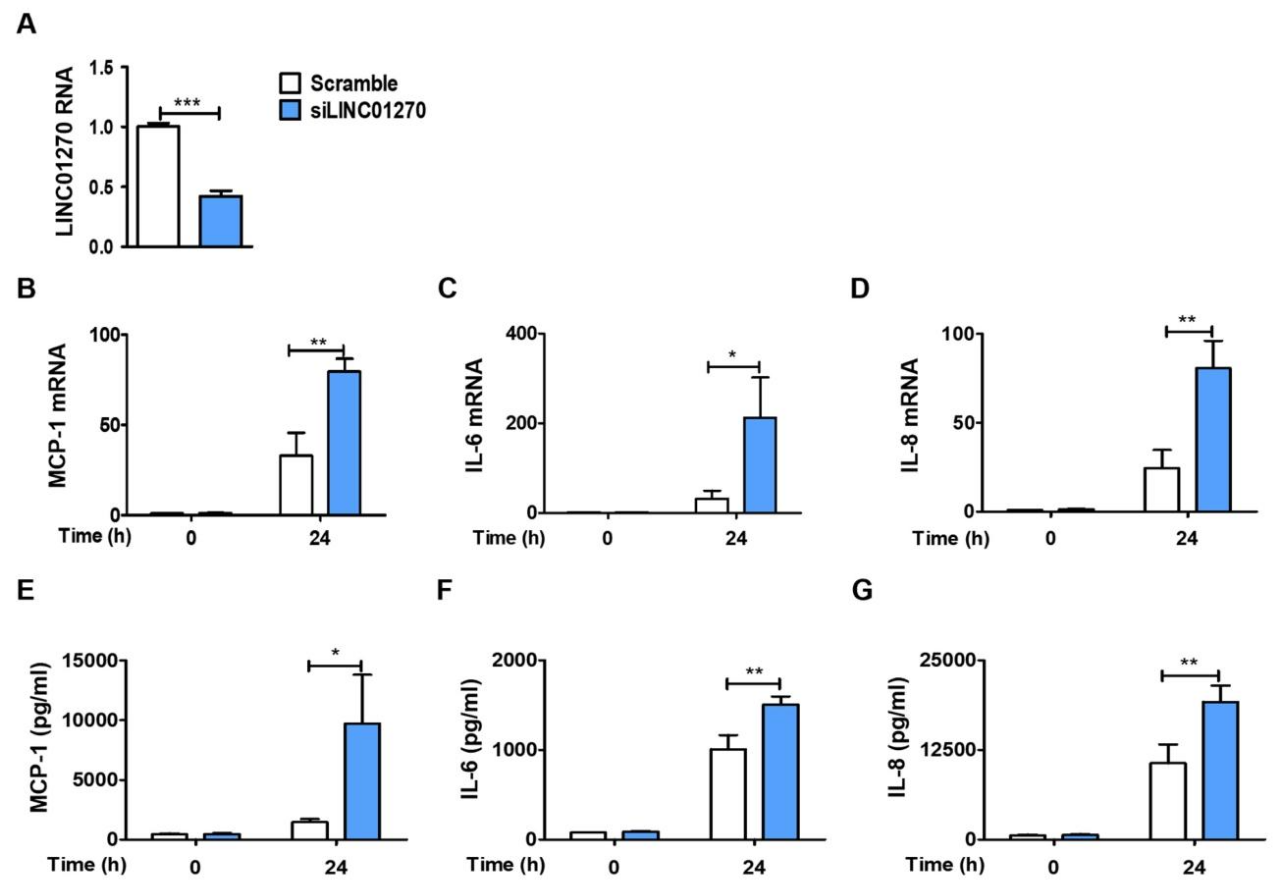
图 2:LINC01270 沉默上调 THP-1 细胞中促炎细胞因子的表达与分泌
该图验证 LINC01270 对炎症因子的调控:siRNA 沉默 LINC01270 效率显著(图 2A);LPS 刺激后,沉默组 IL-6、IL-8、MCP-1 的 mRNA 水平(图 2B-D)和分泌水平(图 2E-G)均显著高于对照组,而细胞吞噬功能无明显变化,表明 LINC01270 沉默可加剧 LPS 诱导的促炎细胞因子产生。
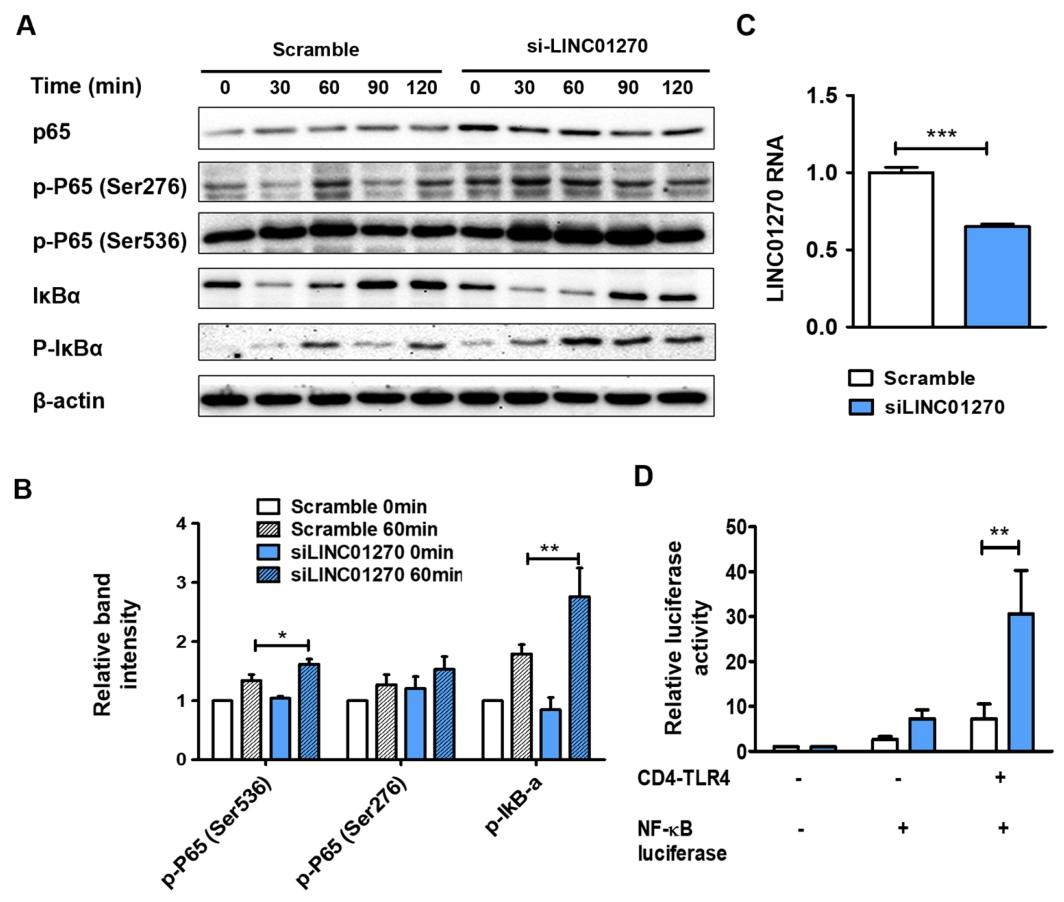
图 3:LINC01270 沉默通过激活 NF-κB 加剧炎症反应
该图揭示 LINC01270 与 NF-κB 通路的关联:LINC01270 沉默后,LPS 刺激的 THP-1 细胞中 p65 Ser536 位点磷酸化及 IκBα 磷酸化水平显著升高,p65 Ser276 位点磷酸化无明显变化(图 3A-B);HEK293 细胞中,沉默 LINC01270 可显著增强 CD4-TLR4 介导的 NF-κB 荧光素酶活性(图 3C-D),证实 LINC01270 沉默通过激活 NF-κB 通路加剧炎症。
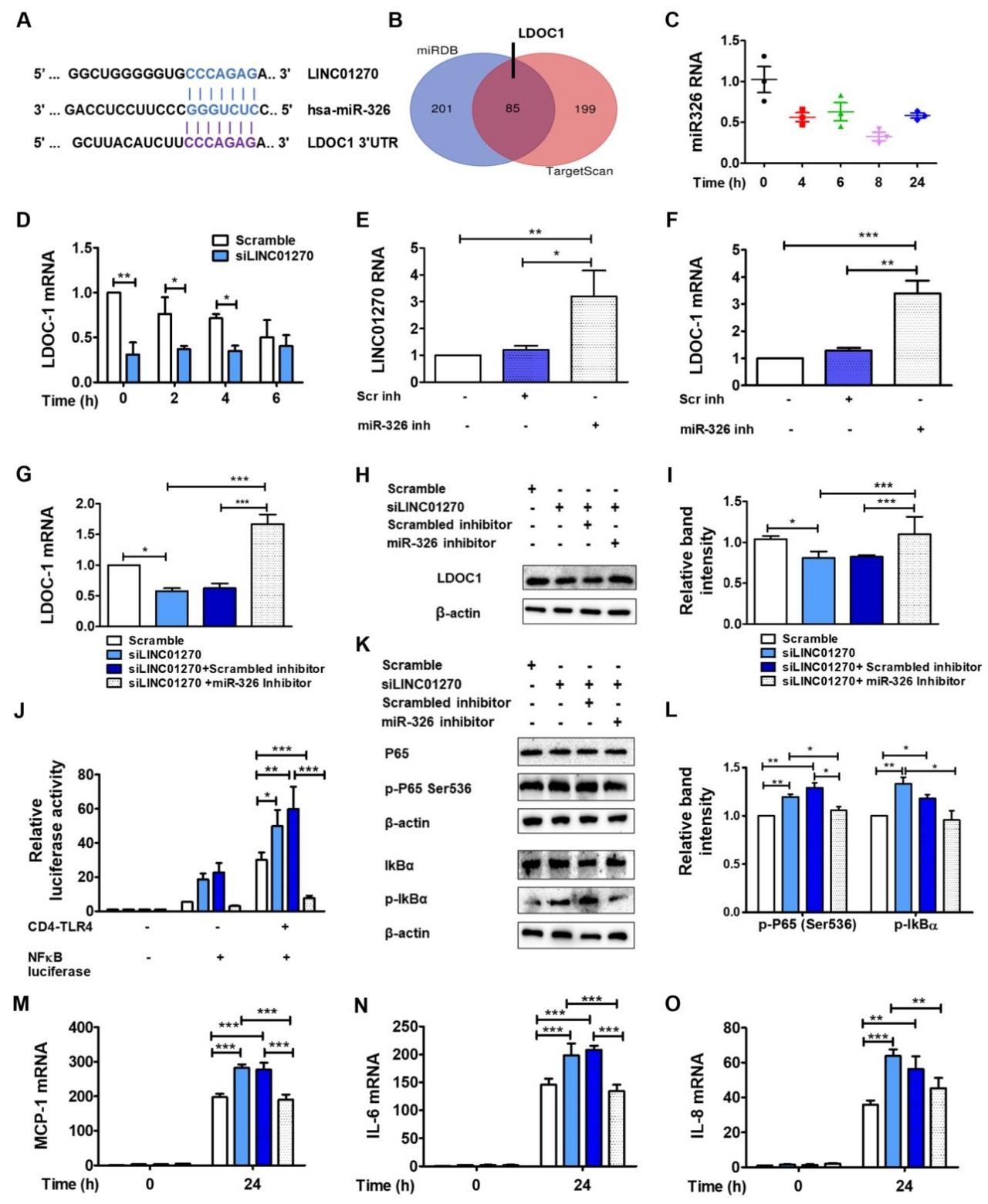
图 4:LINC01270 通过海绵吸附 miR-326 调控 LDOC1 的表达
该图阐明核心调控轴:生物信息学预测 LINC01270 与 miR-326、miR-326 与 LDOC1 3'UTR 存在结合位点(图 4A-B);LPS 刺激 THP-1 细胞后,miR-326 表达下调(图 4C);LINC01270 沉默导致 LDOC1 mRNA 水平降低(图 4D);miR-326 抑制剂可上调 LDOC1 和 LINC01270 的表达(图 4E-F),且能逆转 LINC01270 沉默引起的 LDOC1 mRNA 和蛋白水平下降(图 4G-I);双荧光素酶报告基因实验证实 miR-326 与 LDOC1 直接结合,miR-326 抑制剂可逆转 LINC01270 沉默介导的 NF-κB 激活(图 4J)、p65 和 IκBα 磷酸化升高(图 4K-L)及促炎细胞因子表达增加(图 4M-O)。
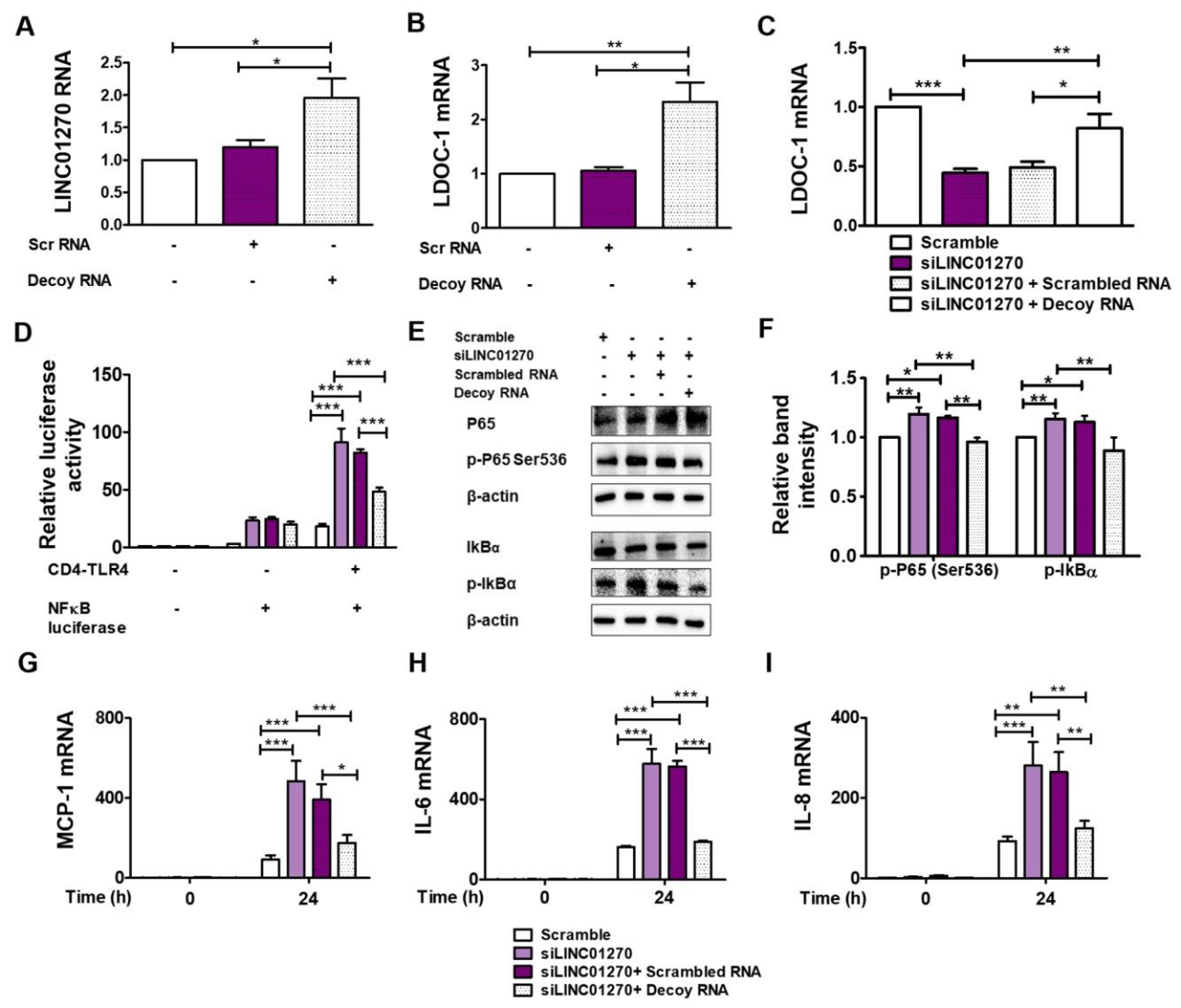
图 5:模拟 miR-326 结合位点的 decoy RNA 逆转 LINC01270 沉默的炎症加剧效应
该图进一步验证 RNA 互作的必要性:单独转染 decoy RNA 可上调 LINC01270 和 LDOC1 的表达(图 5A-B);decoy RNA 能逆转 LINC01270 沉默引起的 LDOC1 mRNA 水平下降(图 5C)、NF-κB 荧光素酶活性升高(图 5D)、p65 和 IκBα 磷酸化增强(图 5E-F)及 IL-6、IL-8、MCP-1 表达上调(图 5G-I),证实 LINC01270 通过与 miR-326 结合调控炎症反应。
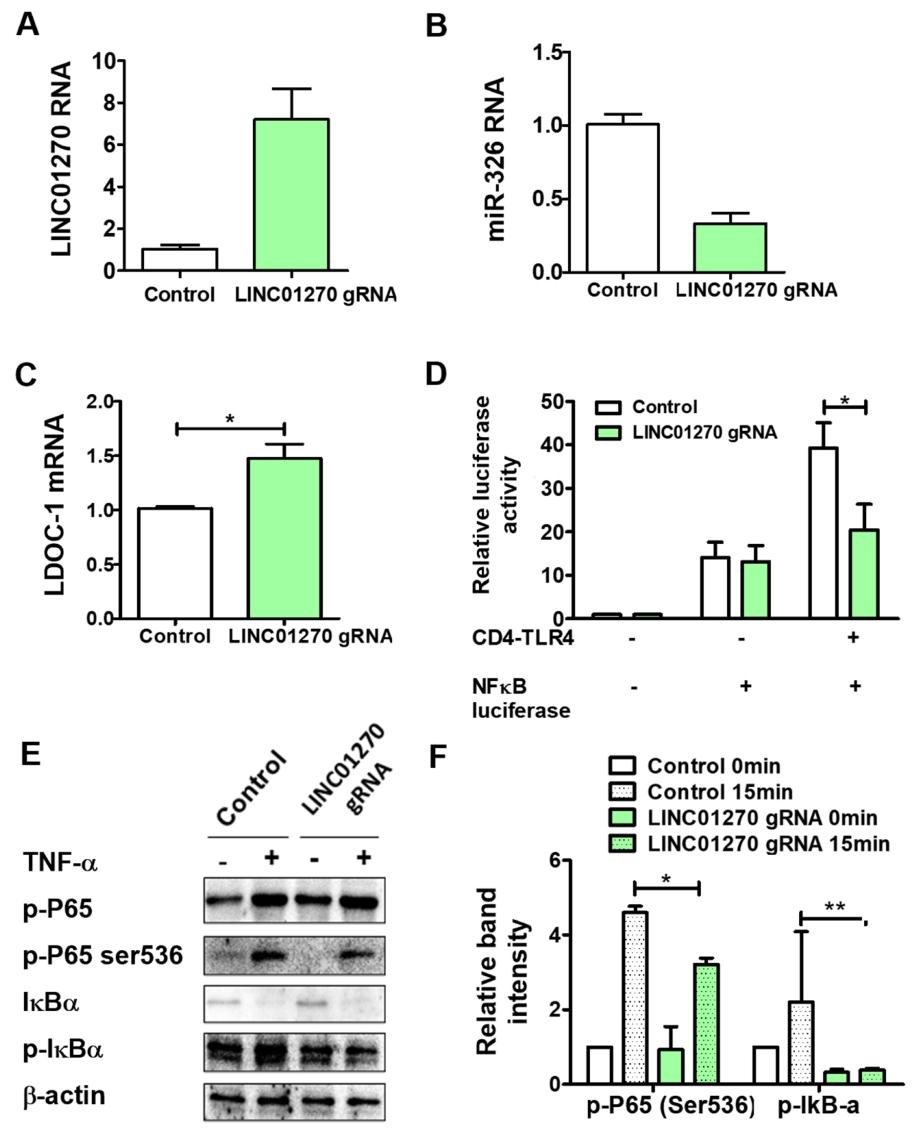
图 6:LINC01270 过表达抑制 HEK293 细胞中 NF-κB 的激活
该图验证 LINC01270 的负向调控作用:通过 dCas9-VP64 系统成功过表达 LINC01270(图 6A);过表达后 miR-326 表达下调,LDOC1 mRNA 水平上调(图 6B-C);双荧光素酶报告基因实验显示,LINC01270 过表达抑制 CD4-TLR4 介导的 NF-κB 激活(图 6D);TNF-α 刺激后,过表达组 p65 Ser536 磷酸化和 IκBα 磷酸化水平显著降低(图 6E-F),表明 LINC01270 过表达可抑制 NF-κB 通路激活。
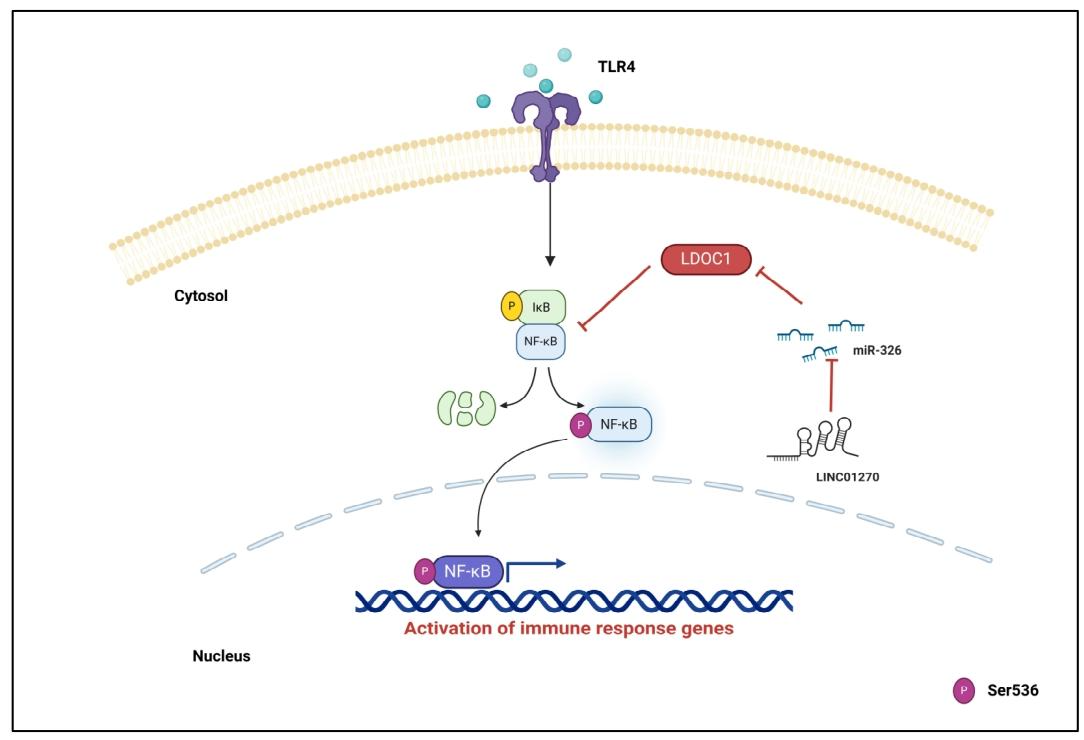
图 7:LINC01270 调控 NF-κB 介导炎症反应的机制示意图
该图总结核心机制:LINC01270 作为竞争性内源 RNA(ceRNA),海绵吸附 miR-326,阻止其与 LDOC1 mRNA 的 3'UTR 结合,维持 LDOC1 的表达水平;LDOC1 作为 NF-κB 抑制剂,抑制 p65 Ser536 磷酸化及 IκBα 磷酸化,进而抑制 NF-κB 核移位及促炎靶基因转录,最终减弱炎症反应(图 7)。
本研究首次证实 LINC01270 在 LPS 诱导的 THP-1 细胞炎症反应中发挥负向调控作用:LPS 刺激上调 LINC01270 表达,LINC01270 通过海绵吸附 miR-326,解除其对 LDOC1 mRNA 的降解抑制,维持 LDOC1 的表达,进而抑制 NF-κB 通路激活(降低 p65 和 IκBα 磷酸化),减少 IL-6、IL-8、MCP-1 等促炎细胞因子的产生;沉默 LINC01270 则释放 miR-326,导致 LDOC1 表达下调,NF-κB 通路过度激活,炎症反应加剧;miR-326 抑制剂或 decoy RNA 可逆转这一效应,LINC01270 过表达则进一步抑制 NF-κB 活性。该研究揭示了 LINC01270/miR-326/LDOC1/NF-κB 的新型调控轴,为炎症相关疾病的治疗提供了新的分子靶点和理论依据。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
下一篇:表观遗传调控新发现!HDAC 抑制剂可恢复 HBV 受体 hNTCP 表达