常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-12-04 17:00:36 细胞资源库平台 访问量:116
重庆医科大学组织胚胎学教研室、干细胞与组织工程实验室及第一附属医院神经外科团队 2019 年发表于《European Review for Medical and Pharmacological Sciences》的研究,通过原代细胞培养、Cx47 干扰及外源性蛋白处理实验,证实星形胶质细胞(ASTs)可通过上调少突胶质前体细胞(OPCs)中缝隙连接蛋白 47(Cx47)的表达,激活 Chi3l1(几丁质酶 3 样蛋白 1)的表达,进而上调 Cyclin D1 调控 OPCs 细胞周期,最终促进其增殖。该研究为阿尔茨海默病、多发性硬化症等脱髓鞘神经退行性疾病的治疗提供了新分子靶点。
脱髓鞘神经退行性疾病(如阿尔茨海默病 AD、多发性硬化症 MS)严重威胁老年人健康,髓鞘再生依赖少突胶质前体细胞(OPCs)的增殖与分化 —— 而 OPCs 是中枢神经系统(CNS)中唯一能分化为成熟少突胶质细胞(OLs,形成髓鞘的细胞)的前体细胞。星形胶质细胞(ASTs)作为 CNS 中数量最多的胶质细胞,可通过分泌细胞因子或缝隙连接(GJ)传递信号,调控 OPCs 的生长发育,但具体机制尚未完全明确。
缝隙连接由 connexin(Cx)蛋白构成,OPCs 主要表达 Cx47、Cx32 等,ASTs 主要表达 Cx43、Cx30 等,其中 Cx47 对 OPCs 稳定表达及髓鞘完整性至关重要,其下调会导致脱髓鞘疾病(如 MS)。Chi3l1 是一种促肿瘤细胞增殖的细胞因子,此前未报道其在 OPCs 增殖中的作用。本研究旨在探究 ASTs 是否通过 Cx47 调控 Chi3l1,进而影响 OPCs 增殖,填补该机制空白。
1. 核心材料与样本
样本来源:新生 SD 大鼠(P0-P3,重庆医科大学实验动物中心),动物饲养符合国家标准,实验经伦理委员会批准;
细胞与试剂:神经母细胞瘤细胞系 B104(陆军军医大学馈赠)、DMEM/F12 培养基、N-2 添加剂、胎牛血清(FBS)、Cx47 抗体(BS7447)、Chi3l1 抗体(sc-393484)、Cyclin D1 抗体(bs-20596R)、重组 Chi3l1 蛋白(RPB463Ra01)、EdU 试剂盒(RiboBio)、Cx47 siRNA(序列:CCGAGAAGACTGTCTTCTT)、RT-PCR 试剂盒(TaKaRa);
关键工具:流式细胞仪、激光共聚焦显微镜、Western blot 成像系统、荧光显微镜。
2. 关键实验步骤
细胞培养:
OPCs 原代培养:分离 SD 大鼠端脑组织,用含 12% FBS 的培养基培养 4 天后,换用含 1% N-2+20% B104 细胞上清的培养基,培养 7-9 天,EDTA 消化纯化;
ASTs 原代培养:大鼠脑组织胰酶消化后,37℃孵育 20 分钟,取上清接种于多聚赖氨酸(PDL)包被培养皿,含 12% FBS 培养基培养 3-4 天;
共培养:ASTs 与 OPCs 接种于同一培养皿,用含 20% B104 上清 + 1% N-2 的培养基培养 3-4 天。
实验分组:
A 组:ASTs 与 OPCs 直接接触共培养;
O 组:OPCs 单独培养;
Cx47si 组:共培养体系中干扰 OPCs 的 Cx47;
NCsi 组:共培养体系中空白干扰;
5ng/ml 组 / 10ng/ml 组:OPCs 单独培养时加入对应浓度外源性 Chi3l1。
检测方法:
增殖检测:EdU 标记(荧光显微镜计数阳性细胞)、流式细胞术分析细胞周期(75% 乙醇固定,检测 S 期比例);
分子检测:RT-PCR 测 Cx47 mRNA(引物:Cx47 上游 GAGGATGAGGACGAGGAACCA,下游 CTCCTACTCCTGCTCCTTGGT)、Western blot 测 Cx47/Chi3l1/Cyclin D1 蛋白(GAPDH 内参)、免疫荧光(DAPI 染核,特异性抗体标记目标蛋白,共聚焦成像);
统计分析:SPSS17.0,单因素方差分析,P<0.05 为差异有统计学意义。
Figure 1:AST-OPC 共培养促进 OPCs 中 Cx47 表达
Western blot 结果显示,OPCs 单独培养(O 组)的 Cx47 蛋白表达(0.68±0.08)显著低于 AST-OPC 共培养(A 组)(1.05±0.09,P<0.05);RT-PCR 结果显示,O 组 Cx47 mRNA 表达(2.2±0.58)显著低于 A 组(15.3±2.40,P<0.01),证实 ASTs 可通过直接接触共培养,显著上调 OPCs 中 Cx47 的转录与蛋白表达。
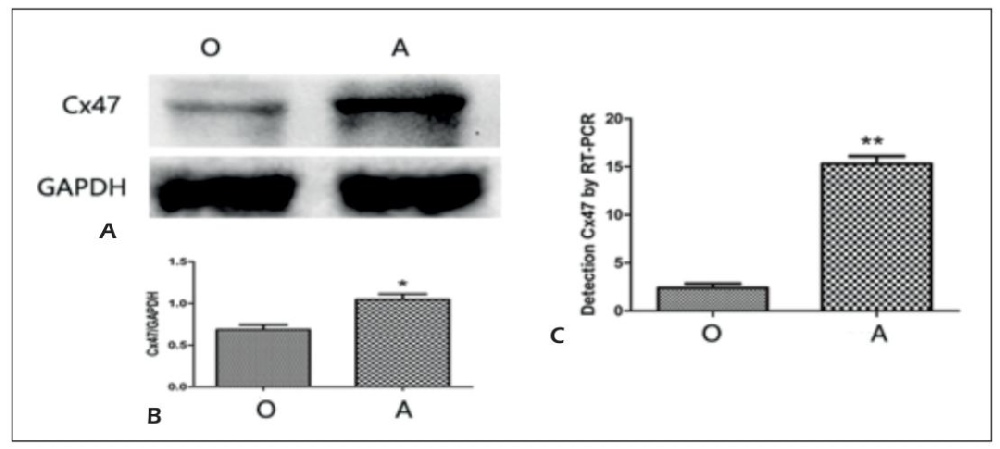
Figure 2:Cx47 干扰后 OPCs 增殖能力下降
Western blot 与免疫荧光证实 Cx47si 组的 Cx47 表达(蛋白:0.456±0.207;荧光强度:254.12±53.93)显著低于 NCsi 组(蛋白:1.046±0.163;荧光强度:881.35±263.97,P<0.01),干扰成功;流式细胞术显示,Cx47si 组 OPCs 的 S 期比例(7.44±1.10%)显著低于 A 组(17.35±2.03%)与 NCsi 组(14.85±1.92%,P<0.05);EdU 检测显示,Cx47si 组新生细胞比例(28.4±6.6%)显著低于 A 组(48.7±3.8%)与 NCsi 组(47.8±5.1%,P<0.05),表明 Cx47 是 ASTs 促进 OPCs 增殖的关键分子。
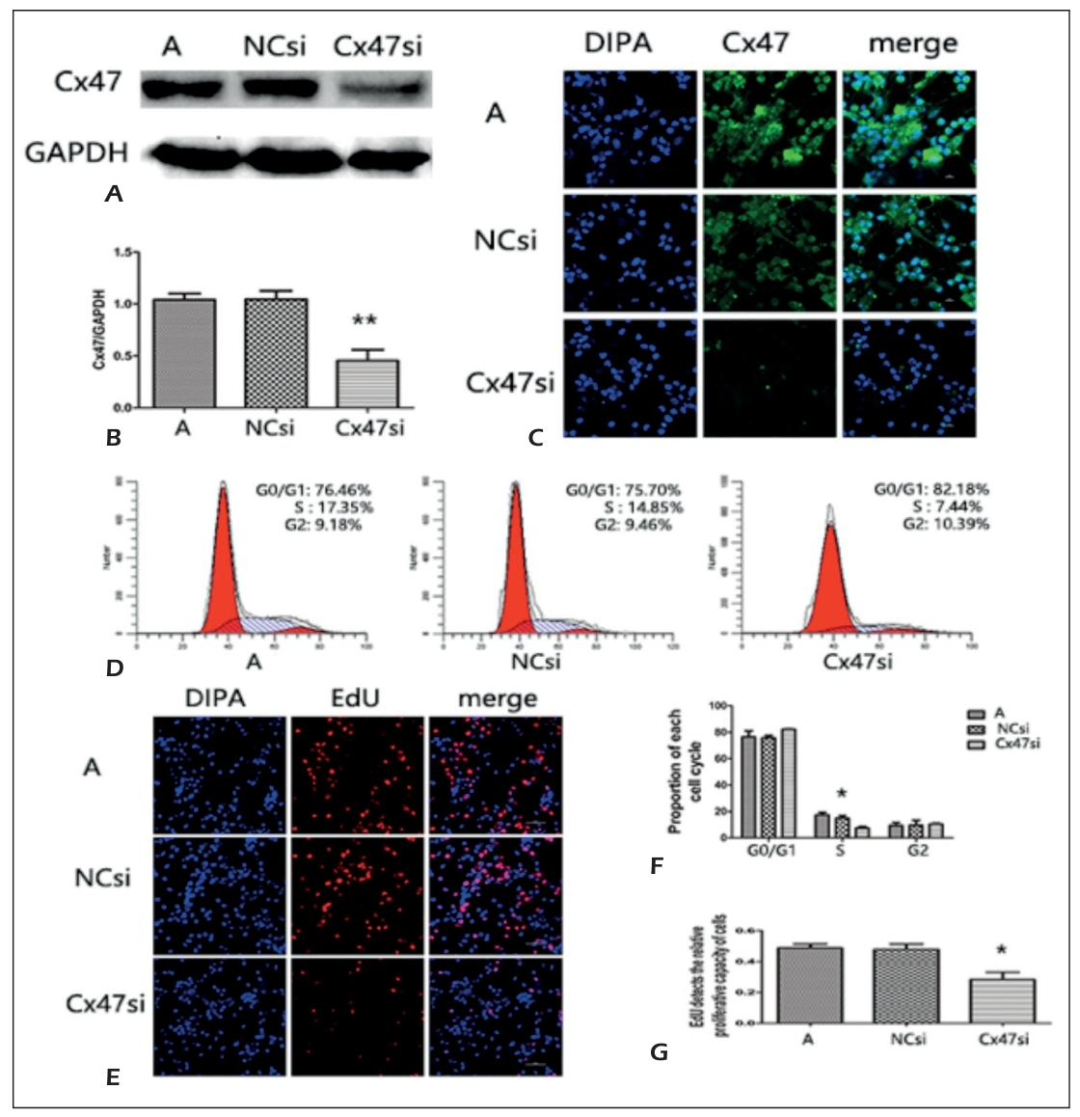
Figure 3:Cx47 干扰后 OPCs 中 Chi3l1 表达降低
Western blot 结果显示,Cx47si 组 Chi3l1 蛋白表达(0.30±0.08)显著低于 A 组(1.10±0.91)与 NCsi 组(1.03±0.27,P<0.05);免疫荧光显示,Cx47si 组 Chi3l1 红色荧光强度(407.33±106.84)显著低于 A 组(1081.54±327.25)与 NCsi 组(1282.33±381.64),且 Chi3l1 与 OPCs 特异性标志物 PDGFαR 共定位,证实 Cx47 可调控 OPCs 中 Chi3l1 的表达,Chi3l1 是 Cx47 下游分子。
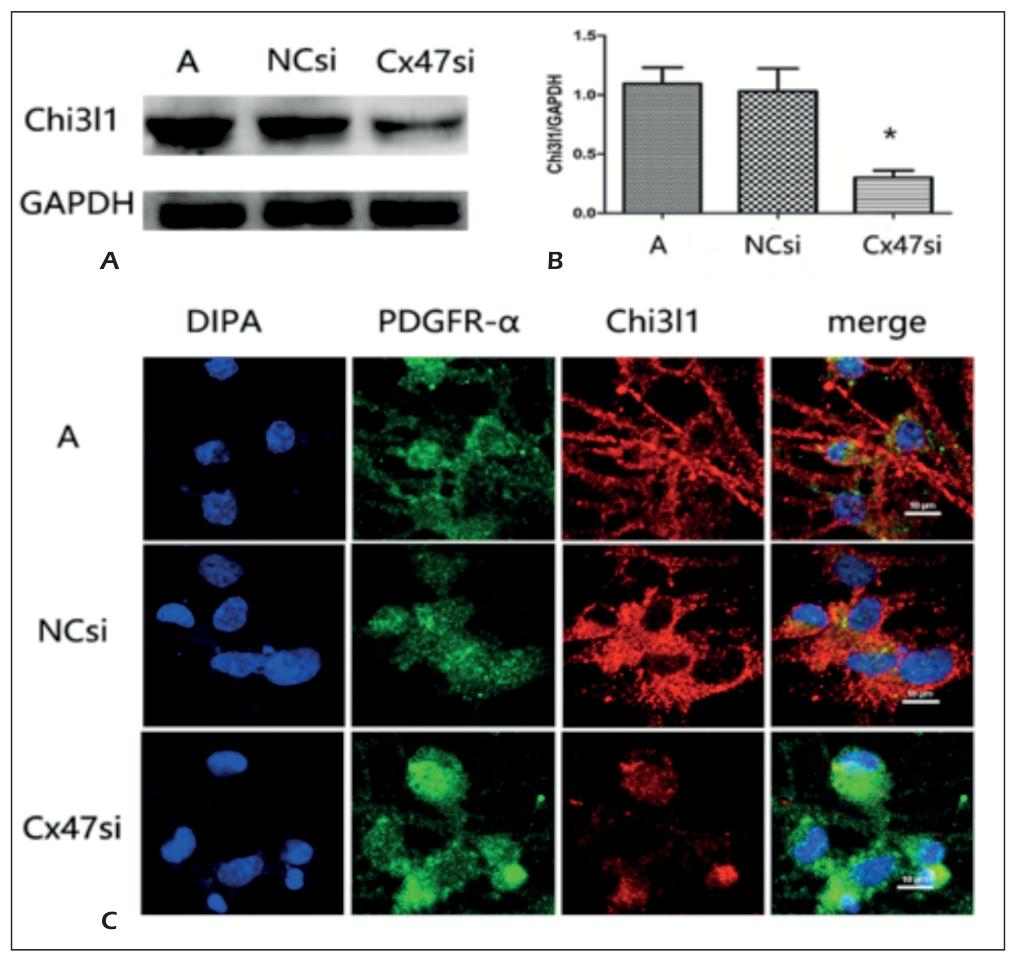
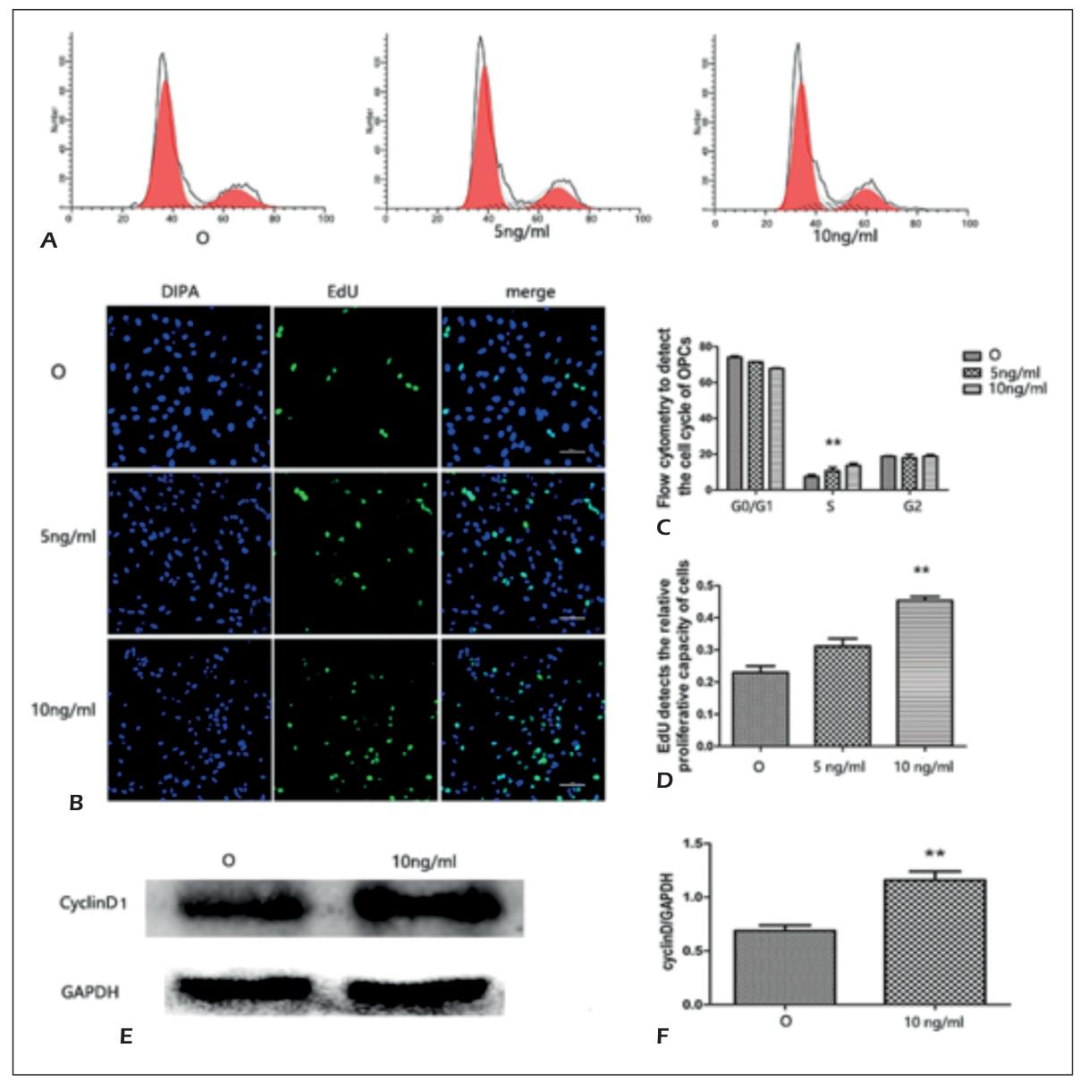
Figure 4:外源性 Chi3l1 促进 OPCs 增殖并上调 Cyclin D1
流式细胞术显示,OPCs 单独培养时,加入 5ng/ml(10.63±2.33%)、10ng/ml(13.55±1.60%)Chi3l1 后,S 期比例显著高于 O 组(7.37±1.38%,P<0.01);EdU 检测显示,5ng/ml 组(31.08±3.44%)、10ng/ml 组(45.32±1.74%)新生细胞比例显著高于 O 组(22.92±2.90%,P<0.01),且呈浓度依赖性;Western blot 显示,10ng/ml 组 Cyclin D1 蛋白表达(1.16±0.14)显著高于 O 组(0.68±0.09,P<0.01),证实外源性 Chi3l1 可通过上调 Cyclin D1,促进 OPCs 进入 S 期,增强其增殖能力。
星形胶质细胞(ASTs)通过直接接触共培养,显著上调少突胶质前体细胞(OPCs)中缝隙连接蛋白 47(Cx47)的表达;Cx47 进一步激活 OPCs 中 Chi3l1 的表达,上调细胞周期蛋白 Cyclin D1,促进 OPCs 从 G1 期进入 S 期,最终增强其增殖能力。该研究明确了 “ASTs-Cx47-Chi3l1-Cyclin D1” 调控轴在 OPCs 增殖中的关键作用,为 AD、MS 等脱髓鞘神经退行性疾病的髓鞘再生治疗提供了新分子靶点。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:新型肝脏培养系统问世!四细胞共培养 + 临床仪器,精准复现体内代谢,破解毒理学评估难题
下一篇:从信号到临床:SPRY2 如何通过抑制 FGFR2 信号改善胆管癌患者预后