常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-11-28 09:00:00 细胞资源库平台 访问量:95
英文标题:Itaconate reduces viral endocytosis by targeting Cys128 of the adaptor-related protein complex 1 gamma 1 subunit in the host, providing a novel target for antiviral drug development
中文标题:衣康酸通过靶向宿主AP1G1蛋白Cys128位点抑制病毒内吞,为抗病毒药物研发提供新靶点
发表期刊:《Molecular Biomedicine》
影响因子:10.07
作者单位:中国中医科学院中药研究所、北京中医药大学等
作者信息:Xinqi Deng, Heng Chen, Zhixing Huang, Rongge He, Qinling Rao, Luni Xu, Zijian Xu, Naixuan Zhao, Yeqing Peng, Muxuan Li, Xi Liu, Tao Ma, Xiaolan Cui, Chunguo Wang
1. 传统抗病毒策略的局限性
传统抗病毒药物和疫苗主要靶向病毒蛋白,但病毒突变快,易导致疫苗失效和耐药性。
2. 衣康酸的抗病毒潜力
衣康酸是一种内源性免疫代谢物,通过蛋白质翻译后修饰抑制病毒复制,但其抑制病毒内吞的机制尚不明确。
3. AP1G1与病毒内吞的关系
AP1G1是网格蛋白介导的内吞途径中的关键宿主因子,多种病毒(如流感病毒、SARS-CoV-2)依赖其进入细胞。
4. 研究创新点
提出衣康酸通过共价修饰AP1G1的Cys128位点,抑制其与网格蛋白的相互作用,从而阻断病毒内吞。
进一步筛选出天然产物Licochalcone B作为衣康酸的替代物,具有强效抗病毒活性。
1. 衣康酸检测与病毒感染模型
使用H1N1、RSV、HCoV-229E病毒感染BEAS-2B细胞和小鼠模型,检测衣康酸水平变化。
2. 点击化学与蛋白质互作分析
利用可点击衣康酸探针(ITAP)结合CuAAC反应、GST pull-down、CETSA等技术鉴定AP1G1为靶点。
3. 位点突变与功能验证
通过AP1G1截断体构建、点突变(C128A等)、免疫荧光、Western blot等验证Cys128为关键修饰位点。
4. 分子对接与药物筛选
使用分子对接分析衣康酸/Licochalcone B与AP1G1的结合模式;通过TPP和LiP-MS筛选并验证Licochalcone B的结合位点与抗病毒效果。
5. 体内外抗病毒实验
在BEAS-2B细胞和小鼠感染模型中评估Licochalcone B对病毒载量、肺组织损伤的影响。
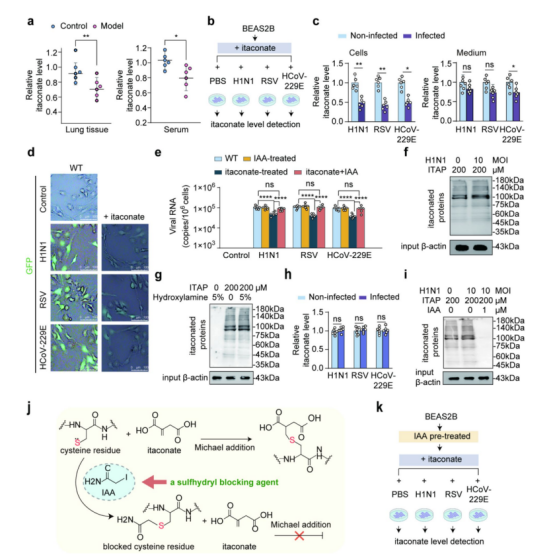
图1:
(a) 病毒感染后小鼠肺组织和血清中衣康酸的水平。模型组雄性无特定病原体昆明(KM)小鼠通过鼻内接种H1N1病毒(40 μL PBS稀释的100 TCID50),连续5天每日一次;对照组小鼠仅接种PBS,n=6,*p<0.05,**p<0.01。
(b) BEAS -2B细胞分别用H1N1、RSV和HCoV-229E病毒(MOI=2)感染24小时。
(c) BEAS -2B细胞及其培养上清液中衣康酸水平,n=6,*p<0.05,**p<0.01。
(d) BEAS -2B细胞用H1N1、RSV和HCoV-229E的 GFP 标记病毒(MOI=2,感染24小时)感染。与野生型组相比,衣康酸给药组的 GFP 信号减弱,表明病毒入侵减少,n=3。比例尺=100 μm 。
(e) 感染细胞中病毒RNA水平。细胞分别用衣康酸、IAA及衣康酸+IAA处理。在衣康酸+IAA组中,细胞先用IAA(1 μM)预处理24小时,再给予衣康酸(200 μM),n=6,**** p<0.0001 。
(f) 用生物素点击法检测H1N1流感病毒(MOI=0或10)感染24小时的 BEAS -2B细胞(用200 μM ITAP 标记)的蛋白质衣康化信号。输入样本的输入蛋白作为上样对照。
(g) 羟胺处理未消除蛋白质的衣康化信号,表明衣康酸通过硫酯共价键与蛋白质结合。通过生物素点击法检测到衣康酸化信号。输入样本的 β -肌动蛋白作为上样对照,n=3。
(h、i) 细胞经IAA预处理后衣康酸化受到抑制。IAA(1 μM)预处理的 BEAS -2B细胞中衣康酸水平。H1N1、RSV和HCoV-229E(MOI=10)病毒感染组细胞衣康酸水平无变化,n=6(h)。IAA处理后结合衣康酸含量的变化。Western blot分析显示:在三种条件下 BEAS -2B细胞的蛋白衣康酸化情况:(1)H1N1 MOI=0, ITAP 200 µM ,IAA 0 µM ;(2)H1N1 MOI=10, ITAP 200 µM ,IAA 0 µM ;(3)H1N1 MOI=10, ITAP 200 µM ,IAA 1 µM ,培养24小时。衣康酸化信号通过生物素点击法检测,输入样本的 β -肌动蛋白作为上样对照,n=3(i)。
(j、k) BEAS -2B细胞中IAA阻断衣康酸硫酯共价键的示意图。衣康酸中的 α ,β -不饱和羧酸基团及其迈克尔加成反应。该羧酸的碳-碳双键可与暴露的半胱氨酸巯基发生迈克尔加成反应,形成强共价键。IAA可阻断巯基,阻止其与衣康酸发生迈克尔加成反应(j)。IAA预处理后,细胞在补充衣康酸的培养基中培养,并暴露于H1N1、RSV和HCoV-229E(MOI=10)病毒感染(k)。
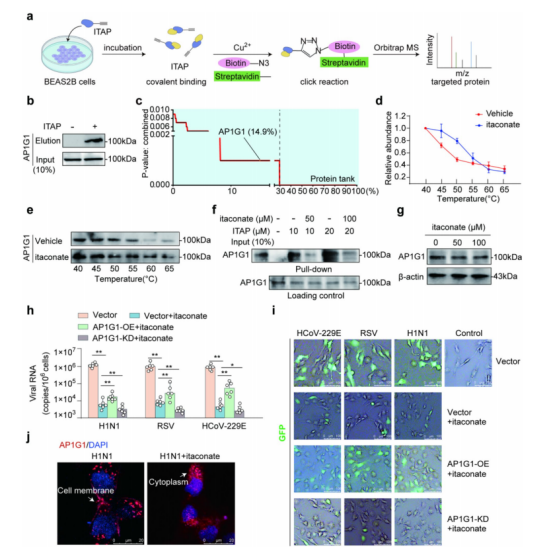
图2:CuOTeDsP的制备与表征
(a) 铜偶联偶联化学反应(CuAAC)介导的点击化学反应与轨道阱质谱(Orbitrap MS)联合标记鉴定衣康酸靶向蛋白的流程图。
(b) ITAP 下拉实验显示衣康酸与重组AP1G1蛋白存在相互作用,n=3。
(c) 采用基于CuAAC的生物正交化学检测法,通过 ITAP 富集衣康酸修饰的靶蛋白。AP1G1被鉴定为高排名候选蛋白,在潜在衣康酸靶向蛋白中位列前14.9%。
(d,e) 衣康酸处理显著改变AP1G1的热稳定性。通过细胞热移位实验(CETSA)-Western blot在40、45、50、55、60和65℃测定AP1G1的热移位曲线。Western blot图像(e)和定量分析(d)显示,与对照组相比,衣康酸处理组AP1G1的热稳定性显著提升,n=3。
(f) 衣康酸与AP1G1竞争结合,抑制 ITAP 的下拉效率。在天然条件下,将 BEAS -2B细胞裂解液与 ITAP(10 μM 或20 μM)共同孵育,同时加入衣康酸竞争物(50 μM 或100 μM)。孵育后,使用生物素-点击试剂和链霉亲和素偶联磁珠捕获 ITAP 结合蛋白,n=3。
(g) BEAS -2B细胞经0、50、100 μM 浓度衣康酸处理后的AP1G1表达情况。结果显示,衣康酸处理未改变AP1G1的表达水平,n=3。
(h,i) AP1G1是衣康酸抑制病毒入侵的关键靶点。在四种实验条件下(载体对照组、载体+富马酸、AP1G1过表达+富马酸、AP1G1敲低+富马酸),对感染H1N1、RSV或HCoV-229E病毒(MOI=2,感染后24小时)的 BEAS -2B细胞进行病毒RNA水平检测。通过qPCR定量病毒RNA拷贝数,n=6,*p<0.05,**p<0.01(小时)。将 BEAS -2B细胞感染携带 GFP 标签的H1N1、RSV和HCoV-229E病毒(MOI=2,感染后24小时),结果显示sh-AP1G1组的 GFP 信号较野生型弱化,表明病毒入侵能力降低,n=3。比例尺=100 μm (i)。
(j) 免疫荧光实验显示富马酸处理后AP1G1的亚细胞定位变化。富马酸处理改变了AP1G1的亚细胞分布,n=3。比例尺=20 μm
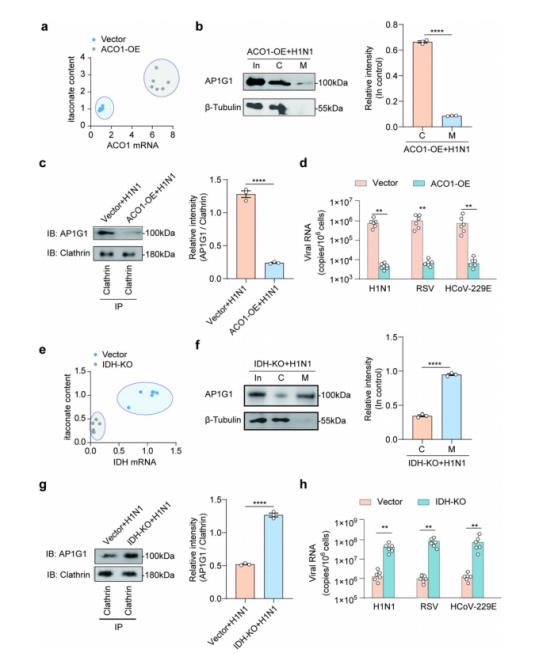
图3:
(a) 通过过表达ACO1增强内源性衣康酸表达,n=6。
(b) 西部印迹分析显示ACO1过表达后H1N1病毒感染期间AP1G1的亚细胞定位。输入图中,C=细胞质,M=细胞膜。右侧图中量化了相对表达水平(输入对照),n=3,**** p<0.0001 。
(c) 共免疫沉淀实验显示ACO1过表达后H1N1病毒感染期间AP1G1与网格蛋白的相互作用显著减弱。右侧图中量化了相对表达水平(网格蛋白对照),n=3,**** p<0.0001 。
(d) 载体与ACO1过表达的 BEAS -2B细胞中病毒RNA水平。细胞感染H1N1、RSV和HCoV-229E病毒(MOI=2),n=6,**p<0.01。
(e) IDH 敲除导致内源性衣康酸表达降低,n=6。
(f) 西部印迹分析显示 IDH 敲除后H1N1病毒感染期间AP1G1的亚细胞定位。右侧图中量化了相对表达水平(输入对照),n=3,**** p<0.0001 。
(g) 共免疫沉淀实验显示 IDH 敲除后H1N1病毒感染期间AP1G1与网格蛋白的相互作用显著增强。右侧图中量化了相对表达水平(网格蛋白对照),n=3,**** p<0.0001 。
(h) 载体与 IDH 敲除的 BEAS -2B细胞中病毒RNA水平。细胞感染H1N1、RSV和HCoV-229E病毒(MOI=2),n=6,**p<0.01
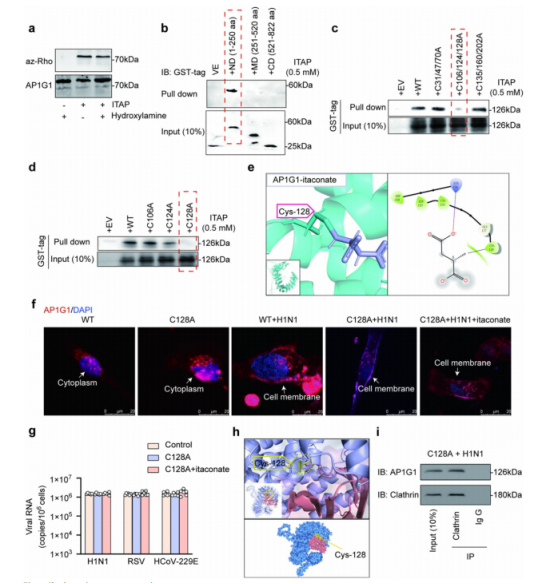
图4:
(a) 醋酸乙酯通过硫酯键与AP1G1结合。将AP1G1与100 μM ITAP 共孵育1小时后,进行5%羟胺处理。通过叠氮-Rho点击反应检测醋酸乙酯化,n=3。实验发现AP1G1的醋酸乙酯化位点对羟胺切割具有抗性。
(b) AP1G1与 ITAP 的结合位点位于1-250 aa范围内。将AP1G1合成三个GST标签片段:N端结构域(ND:1-250 aa)、中间结构域(MD:251-520 aa)和C端结构域(CD:521-822 aa)。其中N端结构域(ND:1-250 aa)被 ITAP 拉下。
(c、d) AP1G1与 ITAP 的结合位点位于C128位点。将 ITAP 分别与以下肽段孵育:C31/47/70A、C106/124/128A(c)和C135/160/202A(d),以及C106A、C124A和C128A(d)。
(e) 分子对接结果表明醋酸乙酯与AP1G1在C128位点的相互作用位点。
(f) 免疫荧光实验显示AP1G1在五种条件下的亚细胞定位:野生型细胞、C128A突变细胞、H1N1病毒感染的野生型细胞、H1N1病毒感染的C128A突变细胞,以及经醋酸乙酯处理的H1N1病毒感染C128A突变细胞。在未感染和H1N1感染条件下,C128A突变细胞的亚细胞定位与野生型细胞一致,表明C128A突变不影响AP1G1的亚细胞定位。然而,C128A突变阻断了醋酸乙酯对AP1G1亚细胞定位的影响。
(g) BEAS -2B细胞和C128A BEAS -2B细胞中的病毒RNA水平。实验中,细胞分别被H1N1、呼吸道合胞病毒(RSV)和人偏肺病毒229E(HCoV-229E)以MOI=2的感染剂量(MOI=感染复数)感染,每组样本量n=6。C128A位点突变导致衣康酸失去抑制三种病毒入侵的能力。
(h) 分子对接实验表明,AP1G1蛋白的Cys128残基位于其与网格蛋白的相互作用界面。
(i) 蛋白质印迹分析证实,C128A位点突变不会影响AP1G1与网格蛋白之间的相互作用。
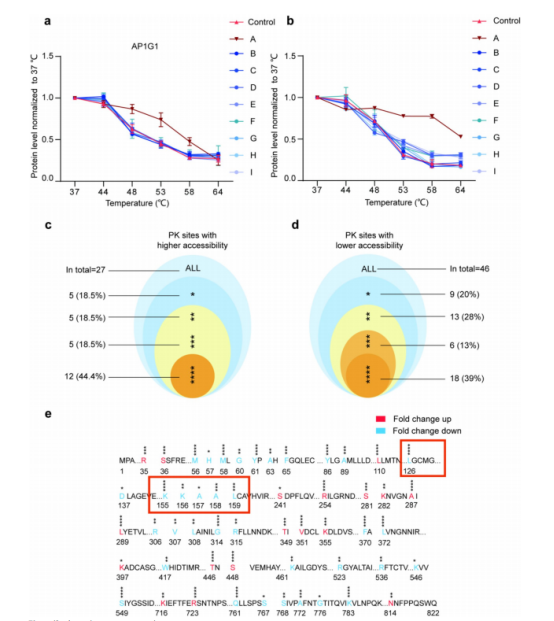
图5:
(a) AP1G1蛋白含量变化曲线与中药提取物共孵育结果对比。A:甘草根及根茎提取物,B:黄连提取物,C:芦苇根提取物,D:桔梗根提取物,E:黄芩根提取物,F:金银花根提取物,G:牛蒡草提取物,H:栀子果实提取物,I:连翘果实提取物。与对照组相比,甘草根及根茎提取物可引起AP1G1蛋白的热移位,n=3。
(b) 甘草根及根茎提取物中九种小分子成分对AP1G1蛋白含量的影响曲线。A:甘草次酸B,B:甘草酸,C:甘草次酸,D:槲皮素,E:甘草次酸,F:异甘草次甘露糖苷,G:毛蕊花苷,H:甘草酮J,I:甘草香豆素。与对照组相比,甘草次酸B可引起AP1G1蛋白的热移位,n=3。
(c、d) 高(c)或低(d)可及性PK位点的数量、分类及状态。星号符号表示强度变化幅度:*—强度变化2-3倍;**—强度变化3-10倍;***—强度变化超过10倍;****—仅在(c)结合或构象变化前(d)可检测到的位点。
(e) AP1G1中蛋白酶K水解可及性上调或下调的位点,倍数变化值上表示可及性增加,倍数变化值下表示可及性降低,n=4
表1:PK位点结合或构象变化后的可及性变化。该表汇总了具有可及性改变的PK位点数量、相对强度变化及百分比。表中列出了具体残基,而整体趋势在正文中有描述。

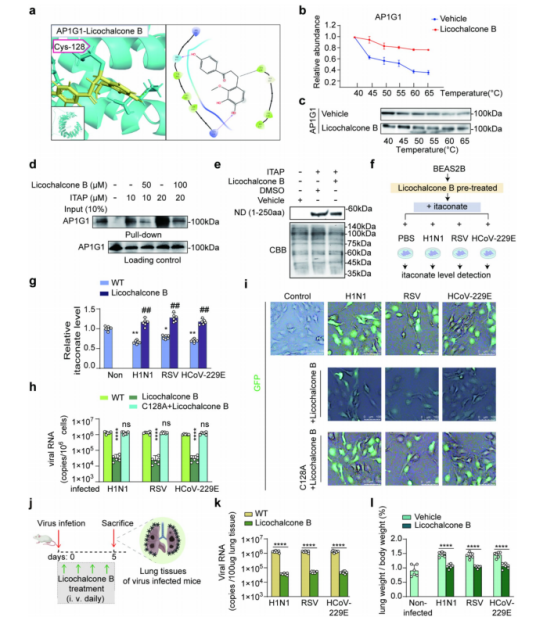
图6:
(a) 分子对接结果展示了Licochalcone B与位于C128的AP1G1之间的相互作用位点。
(b、c) Licochalcone B(100 μg /ml)处理显著改变了AP1G1的热稳定性。通过 CETSA -Western blot在40、45、50、55、60和65℃测定了AP1G1的热移曲线。Western blot图像(c)和定量分析(b)显示,与对照组相比,Licochalcone B处理组的AP1G1热稳定性有所提高,n=3。
(d) Licochalcone B与AP1G1竞争性结合,抑制了 ITAP 的下拉效率。在天然条件下,将 BEAS -2B细胞裂解液与10 μM 或20 μM 的 ITAP 共孵育,并在50 μM 或100 μM 的衣康酸竞争下进行。孵育后,使用生物素点击和链霉亲和素偶联的磁珠捕获与 ITAP 结合的蛋白质,n=3。
(e) Licochalcone B对N结构域(1–250 aa)的竞争性结合。将1 mM ITAP 与100 μg/ml的Licochalcone B共孵育24小时,n=3。
(f、g) Licochalcone B处理保留了 BEAS -2B细胞中的衣康酸含量。细胞首先用200 μM 的Licochalcone B预处理24小时,然后暴露于H1N1、RSV和HCoV-229E病毒感染,并在含衣康酸的培养基中培养24小时(f)。在MOI=2的 BEAS -2B细胞中检测衣康酸水平(g),n=6,**p<0.01,##p<0.01。
(h、i) AP1G1的C128是Licochalcone B抑制病毒入侵的关键靶点。在三种实验条件下(载体对照组、载体+木犀草素B组、C128A+α-愈创木酸组),对感染H1N1、RSV或HCoV-229E病毒(MOI=2,感染后24小时)的 BEAS -2B细胞进行病毒RNA水平检测。通过qPCR定量病毒RNA拷贝数,n=6,**** p<0.0001(小时)。将 BEAS -2B细胞感染H1N1、RSV和HCoV-229E的 GFP 标记病毒(MOI=2,感染后24小时),结果显示sh-AP1G1组的 GFP 信号较野生型弱化,表明病毒入侵能力降低,n=3。比例尺=100 μm (i)。
(j) 实验设计示意图:小鼠通过鼻内接种三种病毒(H1N1、RSV和HCoV-229E)以100 TCID50剂量(总接种量40 µL),并连续5天每日尾静脉注射木犀草素B(3 mg/kg)。收集肺组织进行分析。
k 木犀草素B对病毒感染小鼠肺组织病毒RNA水平的影响,n=6,**** p<0.0001 。
(l) 木犀草素B对病毒感染小鼠肺重量/体重比值的影响,n=6,**** p<0.0001 。
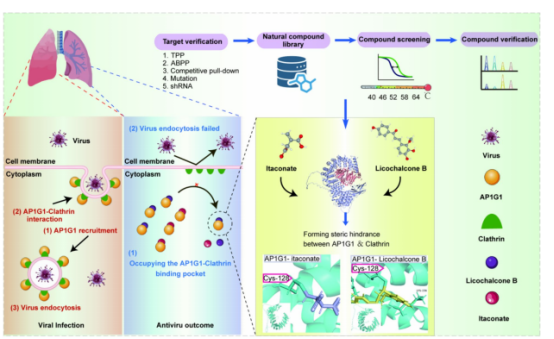
图7:
呼吸道病毒入侵时,AP1G1蛋白会通过膜转运过程与网格蛋白结合,从而促进病毒被宿主细胞内吞。研究表明,衣康酸和经药物筛选的利柯查尔酮B能通过与Cys128位点结合,阻断AP1G1的膜转运过程,进而削弱其与网格蛋白的相互作用,最终抑制呼吸道病毒的入侵。
衣康酸在病毒感染过程中被消耗,补充衣康酸可显著抑制病毒内吞。AP1G1是衣康酸的关键靶点,衣康酸通过修饰Cys128抑制AP1G1与网格蛋白的相互作用。Licochalcone B与衣康酸共享结合位点,能有效替代衣康酸,在细胞和小鼠模型中降低病毒载量超过95%。Licochalcone B减轻病毒引起的肺部炎症和损伤,具有良好的生物安全性和成药潜力。
研究结论:
衣康酸通过修饰AP1G1的Cys128位点,抑制病毒内吞,揭示了一种独立于免疫调节的新型抗病毒机制。
Licochalcone B作为衣康酸类似物,具有广谱抗病毒活性,靶向宿主蛋白,不易产生耐药性。
该研究为开发宿主导向的广谱抗病毒药物提供了新靶点和先导化合物。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:人类胆盐转运体 NTCP 结构新发现:闭合构象是惰性状态,面板域移动调控通道开关
下一篇:57 nm 光谱分离!高灵敏度mNG-p2/p7-NLuc报告基因,助力抗病毒药物研发