常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-11-18 09:09:21 细胞资源库平台 访问量:70
为应对消化道肿瘤在临床治疗中面临的高侵袭性、易转移与化疗耐药等共同挑战,推动更具针对性的基础研究与药物开发,建立并系统表征了一系列源自原发肿瘤的细胞系。该系列模型涵盖多种高发及罕见癌种,包括胰腺导管腺癌(PDAC-X1, PDAC-X2, PDAC-X3)、肝细胞癌(Hep-X1)、壶腹癌(DPC-X1)、肝内胆管癌(ICC-X1, ICC-X2, ICC-X3)、胆囊癌(GBC-X1)以及联合肝细胞-胆管癌(CHC-X1)。这些细胞系不仅在体外表现出稳定的增殖能力,更能在体内高效成瘤,其病理特征、分子表型(如特定基因突变)以及组织学结构均与临床原发肿瘤高度相似,确保了模型优异的临床相关性。
作为宝贵的临床前研究工具,该系列细胞系为深入探索肿瘤发生发展机制、侵袭转移规律、耐药分子基础提供了核心平台。同时,它们也是筛选抗癌药物、验证新型疗法、以及开展个体化精准治疗研究的理想实验模型。本系列细胞系的成功构建,填补了特定癌种(如混合型壶腹癌)模型的空白,为全面揭示中国人消化道肿瘤的生物学特性、研发新的诊断与治疗策略奠定了坚实的资源基础。
英文标题:Establishment and characterization of a new Chinese hepatocellular carcinoma cell line, Hep-X1
中文标题:源自中国肝细胞癌患者的新型细胞系Hep-X1的建立与表征
发表期刊:《Human Cell》
影响因子:3.1
作者单位:
1. The Forth Department of General Surgery, The First Hospital of Lanzhou University, No.1 Donggang West Road, Chengguan District, Lanzhou 730000, Gansu, China
2. State Key Laboratory of Veterinary Etiological Biology & OIE/National Foot and Mouth Disease Reference Laboratory & Key Laboratory of Animal Virology of the Ministry of Agriculture, Lanzhou Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Lanzhou 730000, China
3. Department of General Surgery, The Second Hospital of Lanzhou University, Lanzhou 730000, China
4. The Second Clinical Medical College, Lanzhou University, Lanzhou 730000, China
作者信息:
Hao Xu¹, Xin Miao², Changpeng Chai¹, Huan Tang¹, Jinjing Hu¹, Zhenjie Zhao¹, Wei Luo¹, Kexiang Zhu¹, Wence Zhou³⁴*
肝细胞癌(HCC)是全球高发恶性肿瘤,2020年全球新发病例约90.6万,死亡83万,东亚发病率最高。现有肝癌细胞系(如HepG2、Huh7)多源自西方人群,长期传代易出现特性改变、交叉污染,且难以反映中国肝癌患者的种族特异性(如80%中国HCC患者合并乙肝感染、肝硬化)。此外,肝癌原代培养成功率低(微生物污染、成纤维细胞过度生长为主要障碍),亟需建立源自中国患者的稳定HCC细胞系,为肝癌病理机制研究、药敏筛选提供贴近中国人群的临床前模型。本研究从46岁中国男性乙肝相关HCC患者的手术标本中建立Hep-X1细胞系,系统表征其生物学特性、遗传背景及药敏特征,填补中国人群HCC细胞系的研究空白。
标本来源与伦理:
标本:46岁中国男性HCC患者(乙肝病史多年,HBV-DNA 9.99E+2 IU/mL,长期恩替卡韦治疗;AFP>1000 IU/mL)的右半肝切除标本,肿瘤位于肝V、VI、VII段(10×7cm),伴门静脉和胆管癌栓,未接受术前放化疗;
伦理:兰州大学第一医院伦理委员会批准(LDYYLL-2021-472),患者签署知情同意书。
细胞培养与建立:
原代培养:肿瘤组织经无菌PBS冲洗3次,胶原酶II(0.2mg/mL)+Dispase II(0.4mg/mL)37℃消化30分钟,300g离心5分钟,用含10%FBS、1×青霉素-链霉素、1×GlutaMAX的RPMI-1640培养基接种于6孔板,5%CO₂、37℃培养;
传代与冻存:细胞汇合80%-90%时1:1传代,2代后转10cm培养皿(1:2-3传代),间隔冻存于液氮,传代50次后确认为稳定细胞系(命名Hep-X1),保藏于中国典型培养物保藏中心(CCTCC NO:2022181)。
细胞鉴定技术:
形态学:倒置显微镜观察活细胞形态,HE染色观察细胞结构;
生长特性:CCK-8法检测P20细胞增殖,公式(Td=t×lg2/lg(N₁/N₀))计算倍增时间,绘制生长曲线;
干性检测:超低吸附板培养P25细胞(无血清干细胞培养基)观察球形成,Matrigel™包埋培养类器官(1000细胞/100μL,每3-4天换液);
遗传特征:STR分型(检测20个多态性位点,对比原发肿瘤),G带核型分析(P30细胞);
免疫表型:免疫组化检测P30细胞、原发肿瘤及类器官中Ki-67、P53、E-钙黏蛋白(E-cad)、波形蛋白(Vimentin)、AFP、CD133的表达;
药敏试验:CCK-8法检测P35细胞对索拉非尼、奥沙利铂、5-氟尿嘧啶(5-FU)、紫杉醇的IC₅₀;
裸鼠成瘤:5周龄雌性BALB/c裸鼠左腋皮下接种P35细胞(3×10⁶/只),每2天测肿瘤体积(体积=(长×宽²)/2),4周后解剖观察转移。
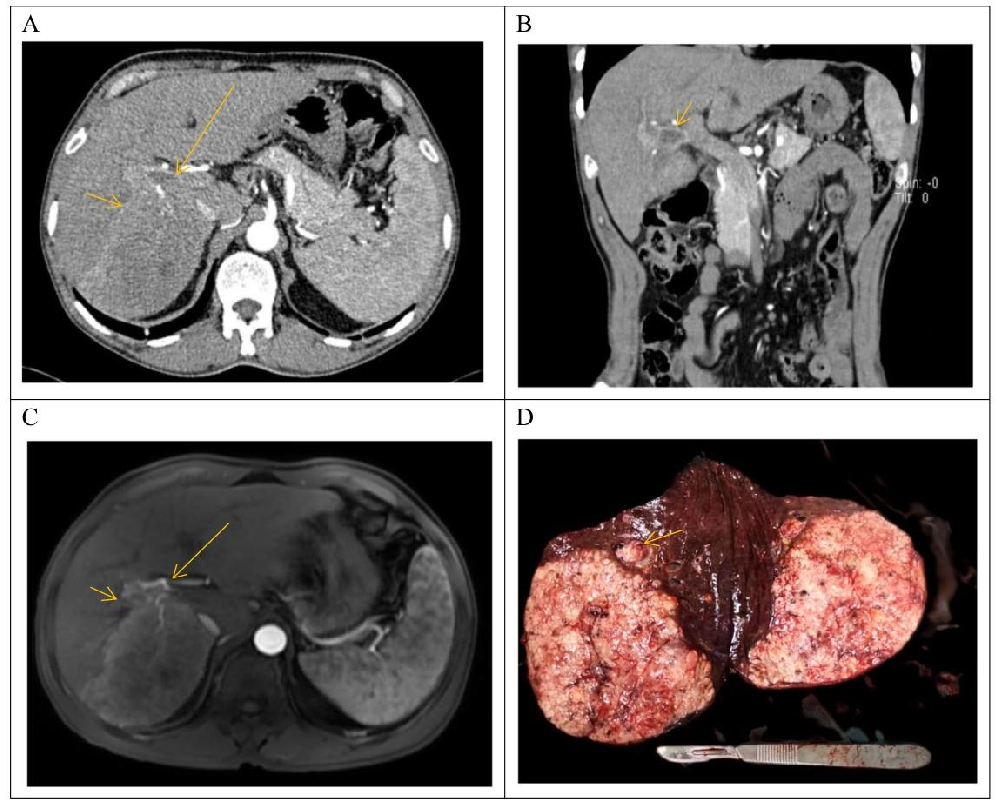
图1:患者临床资料
图1呈现细胞系来源的患者背景:① 术前CT/MRI显示肝右后叶病灶(动脉期强化)及门静脉右支癌栓(图1A-C);② 手术标本肉眼可见血管内癌栓(图1D);③ 患者病理特征:Edmondson-Steiner分级III-IV级,微血管侵犯(MVI)M2级,AFP>1000 IU/mL,CEA 4.0ng/mL,CA199 19.0U/mL(图1E),证实为晚期乙肝相关HCC。
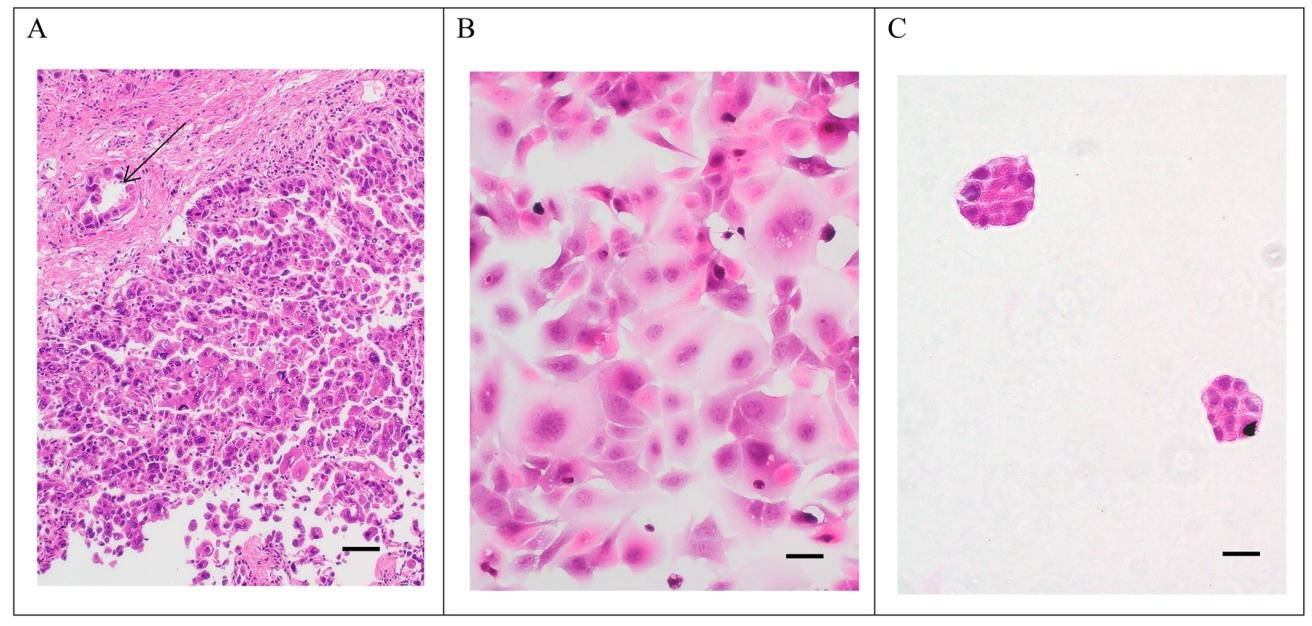
图2:原发肿瘤、Hep-X1细胞及类器官的HE染色
图2验证病理一致性:① 原发肿瘤HE染色显示中低分化HCC,浸润性生长,细胞体积大、核仁明显,可见病理核分裂及血管癌栓(图2A);② Hep-X1细胞HE染色呈典型上皮样,体积大、多核巨细胞多见(图2B);③ Hep-X1类器官呈团块状结构,形态与原发肿瘤一致(图2C),证实细胞系保留原发肿瘤病理特征。
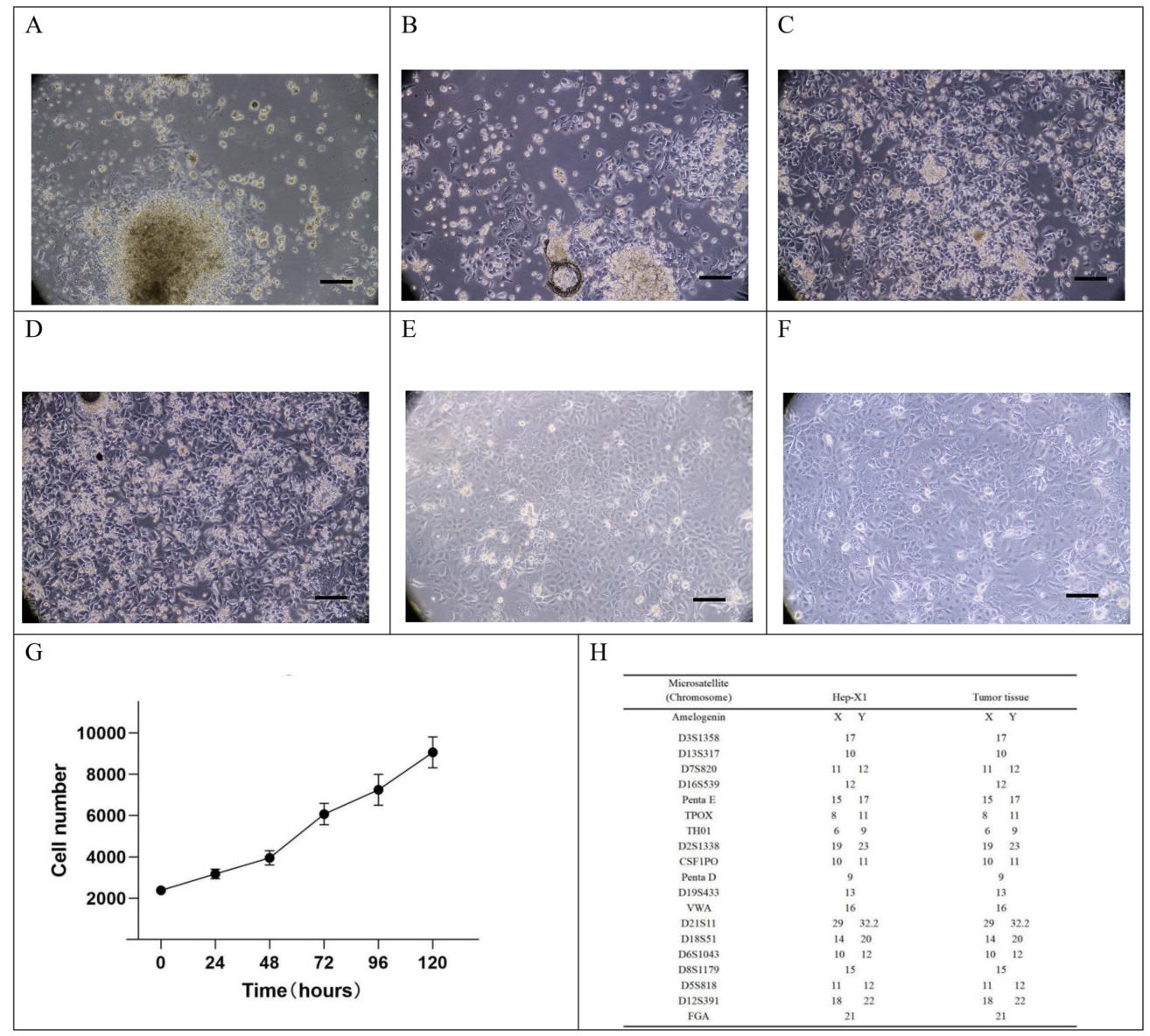
图3:Hep-X1细胞培养过程、生长曲线与STR分型
图3核心验证细胞系稳定性:① 培养过程:原代细胞3天贴壁(图3A)、5天增殖(图3B)、1周汇合(图3C)、2周传代(图3D),P1代(图3E)与P50代(解冻后,图3F)形态一致,长期传代(达P79)特性稳定;② 生长曲线:倍增时间约60小时,增殖速率中等(图3G);③ STR分型:20个位点与原发肿瘤完全匹配,未匹配公共细胞库任何细胞系,确认为新型细胞系(图3H)。
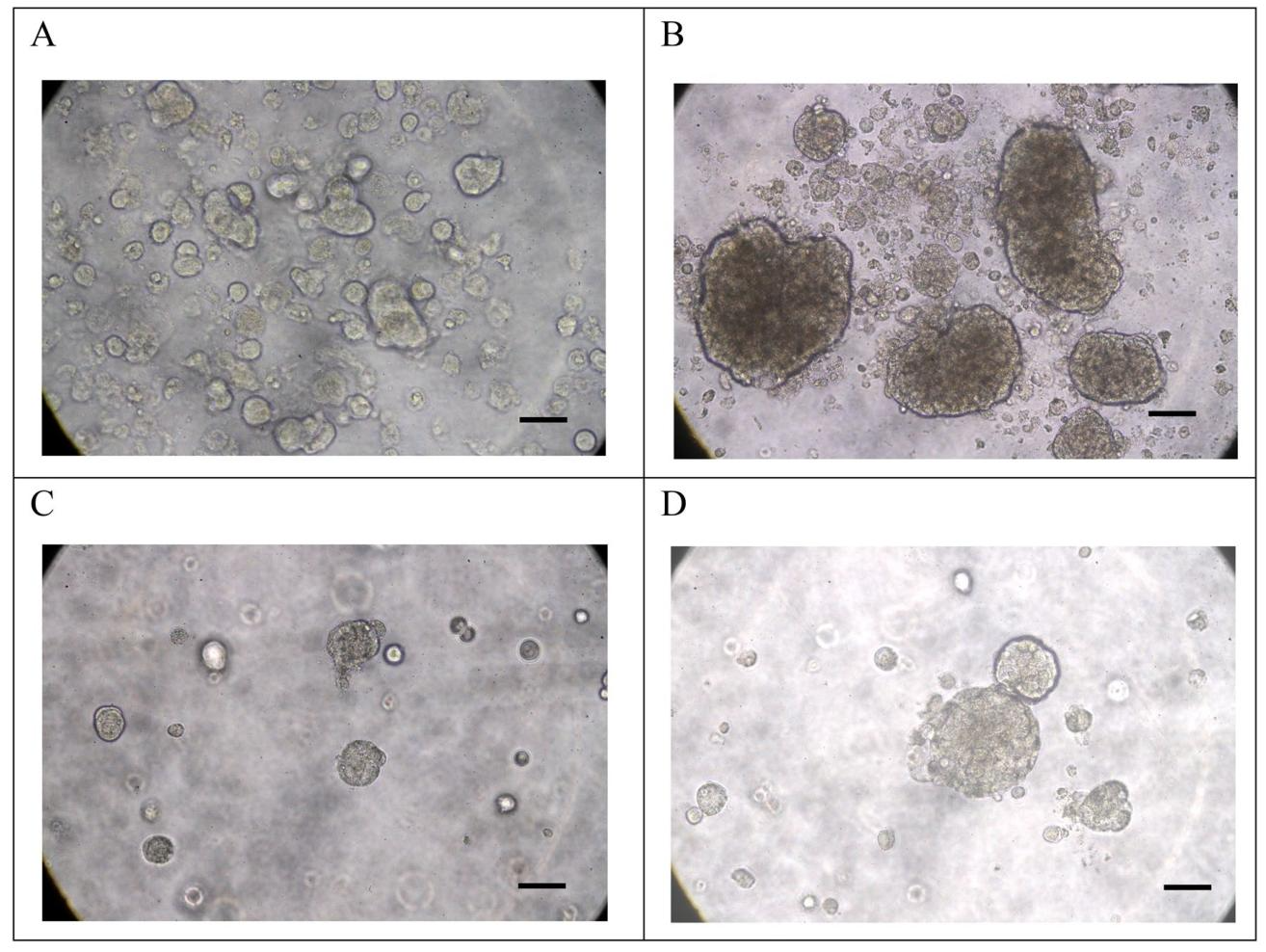
图4:Hep-X1的球形成与类器官培养
图4证实细胞干性特征:
① 球形成实验:超低吸附培养1周(图4A)、2周(图4B)形成大量结构完整的肿瘤球,提示强干性;
② 类器官培养:Matrigel™包埋1周(图4C)、2周(图4D)形成大小不一的肝癌类器官,冻存复苏后活性不变,为三维药敏模型提供基础。
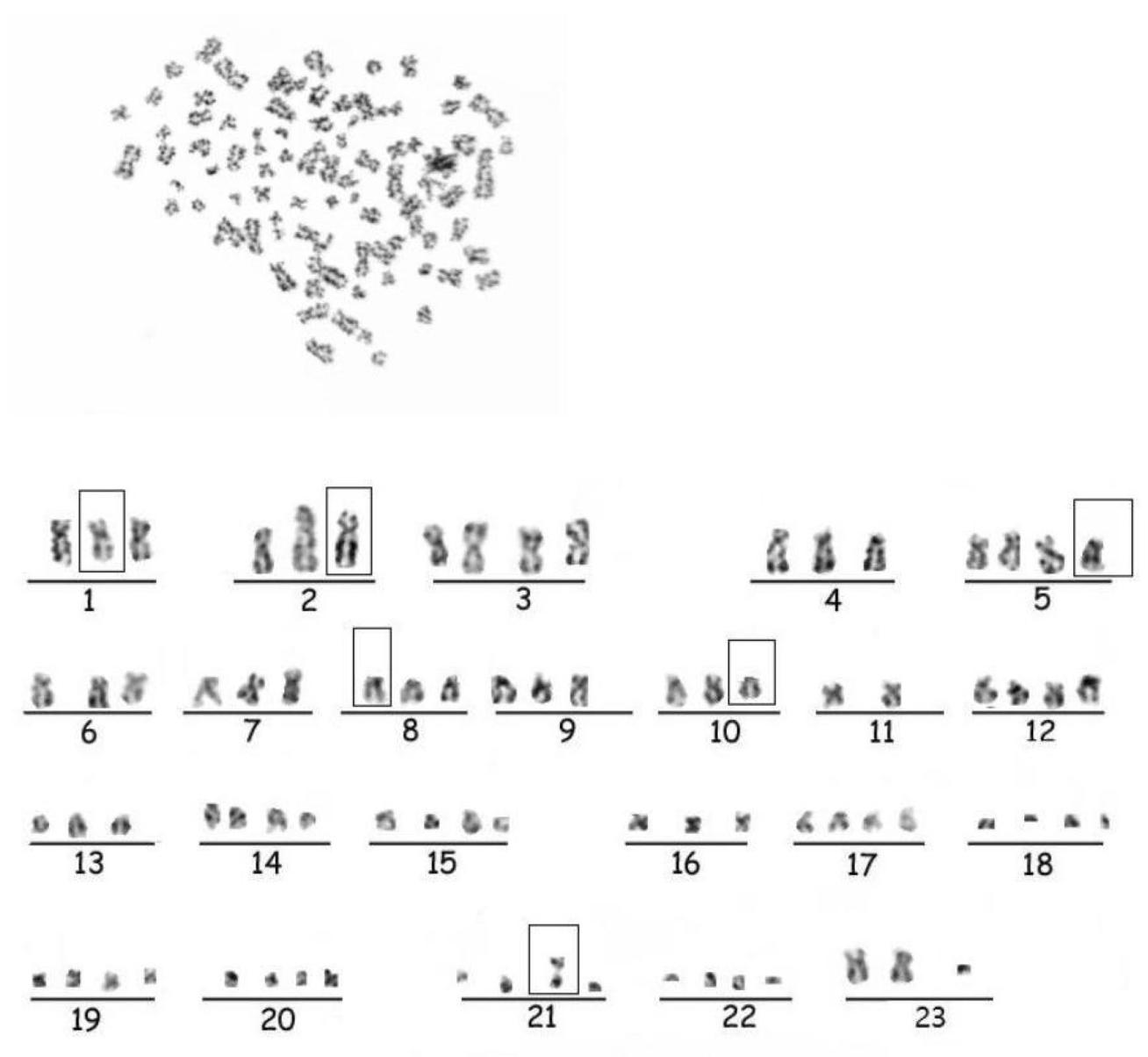
图5:Hep-X1的核型分析
图5揭示遗传特征:G带核型分析显示Hep-X1以亚四倍体为主(占93%),代表性核型为79, XXY del(1)(p31)del(2)(p22)del(5)(p13)del(8)(p12)del(10)(p12) rob(21:21)(图5),染色体数目与结构异常,符合肝癌高遗传不稳定性特征。
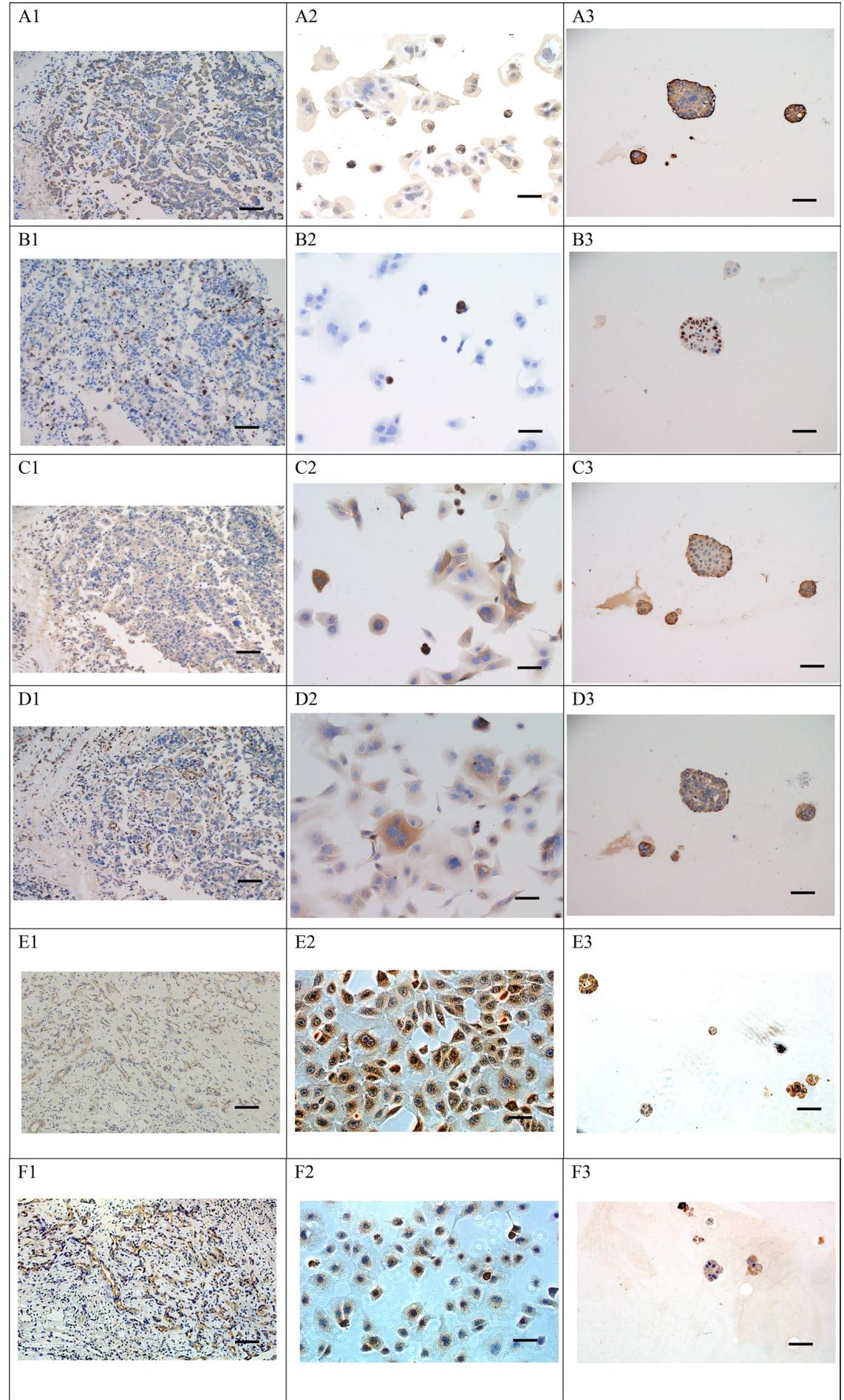
图6:Hep-X1的免疫表型
图6验证分子标志物一致性:原发肿瘤、Hep-X1细胞及类器官中:① E-钙黏蛋白(上皮标志物)、P53(抑癌基因,突变型高表达)、Ki-67(增殖标志物,阳性率高)、Vimentin(间质标志物)、AFP(肝癌特异性标志物)、CD133(干细胞标志物)均呈相似阳性表达(图6A1-F3),证实Hep-X1保留原发肿瘤的免疫表型特征。
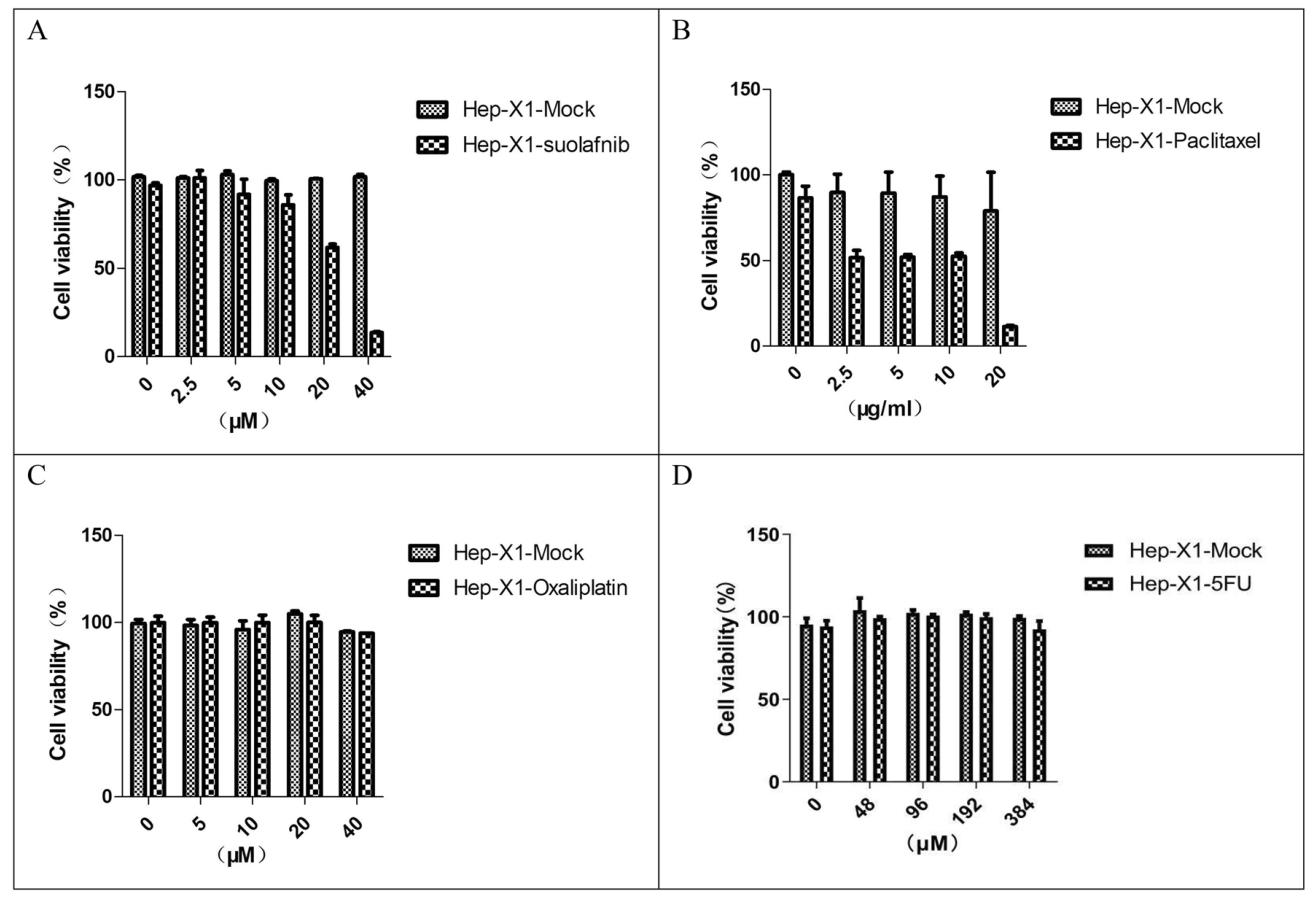
图7:Hep-X1的药敏试验
图7明确药敏特征:① 耐药性:对索拉非尼(图7A)、奥沙利铂(图7C)、5-FU(图7D)均耐药;② 敏感性:对紫杉醇敏感(图7B),为临床紫杉醇治疗乙肝相关晚期HCC提供实验依据,也为索拉非尼耐药机制研究提供模型。
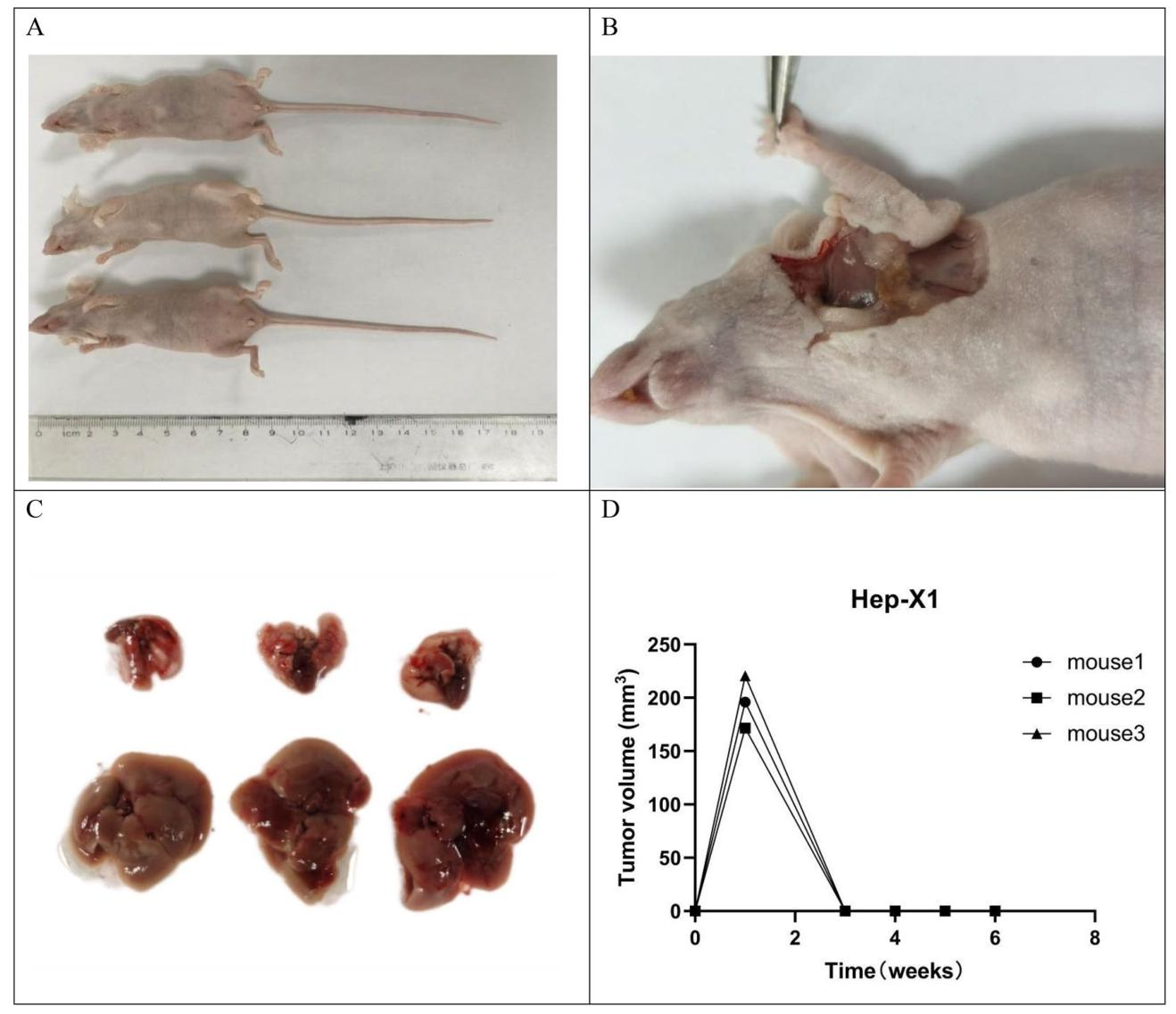
图8:Hep-X1的裸鼠成瘤实验
图8显示体内成瘤特性:
① 6只BALB/c裸鼠接种后4周均未形成皮下肿瘤(图8A-B、D);
② 解剖未见肝、肺转移(图8C),推测与Hep-X1自身抗原性强或裸鼠残留先天免疫活性相关,后续需用NOD-scid小鼠验证成瘤能力。
本研究成功从中国乙肝相关HCC患者(中低分化,伴血管癌栓)手术标本中建立新型细胞系Hep-X1,核心特征包括:
① 遗传唯一性:STR分型与原发肿瘤100%匹配,为未报道的新型细胞系(CCTCC NO:2022181);
② 生物学特性稳定:上皮样形态,倍增时间60小时,长期传代(P79)特性不变,可形成肿瘤球和类器官(干性特征);
③ 分子与病理一致性:保留原发肿瘤的免疫表型(AFP、CD133、Ki-67阳性)及亚四倍体核型;
④ 药敏特征明确:对紫杉醇敏感,对索拉非尼、5-FU、奥沙利铂耐药;
⑤ 局限性:BALB/c裸鼠不成瘤,需后续用NOD-scid小鼠验证体内活性。
Hep-X1填补了中国乙肝相关HCC细胞系的空白,可作为研究中国人群肝癌发病机制(如乙肝相关HCC的遗传改变)、索拉非尼耐药机制及紫杉醇疗效预测的临床前模型,为肝癌精准治疗提供工具。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:不手术也能治翼状胬肉?尼达尼布通过FGFR2-ERK通路精准“杀灭”病变细胞
下一篇:基于工程化ECM-DNA-CPO仿生基质的高效骨再生策略