常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-11-11 17:36:35 细胞资源库平台 访问量:138
WEE1激酶作为细胞周期检查点的关键调控因子,在DNA损伤修复和细胞稳态维持中扮演着至关重要的角色。WEE1通过磷酸化CDK1/2激酶的Y15位点,抑制CDK1-cyclinB复合物活性,导致G2/M期检查点停滞,为DNA损伤修复提供足够时间。大多数人类恶性肿瘤由于TP53基因突变导致G1/S检查点功能缺陷,因此过度依赖WEE1调控的G2/M和S期内检查点进行DNA损伤修复。因此,WEE1抑制剂可以选择性地增敏TP53缺陷癌细胞对放疗和其他抗癌药物的敏感性,或通过单药治疗消除这些癌细胞。目前,尚无WEE1抑制剂获得全球药品监管机构批准,但已有一些候选药物正在临床评估中。AZD1775(adavosertib)曾完成多种癌症类型的II期临床试验,但由于4级不良事件如骨髓抑制和其他耐受性问题,阿斯利康于2022年初停止了该药物的研究。这主要是由于AZD1775对WEE1和PLK1显示出等效的体外活性,缺乏足够的选择性。因此,开发对WEE1更具选择性且具有较强抗癌活性的新型抑制剂具有重要意义。
近期,发布在Journal of medicinal chemistry期刊,题为Discovery of WEE1 Kinase Inhibitors with Potent Activity against Patient-Derived, Metastatic Colorectal Cancer Organoids的研究基于AZD1775的吡嗪并嘧啶酮骨架,合成了一系列强效WEE1抑制剂,并首次利用患者来源类器官(PDOs)平台评估这些抑制剂对健康和恶性细胞活力的影响。
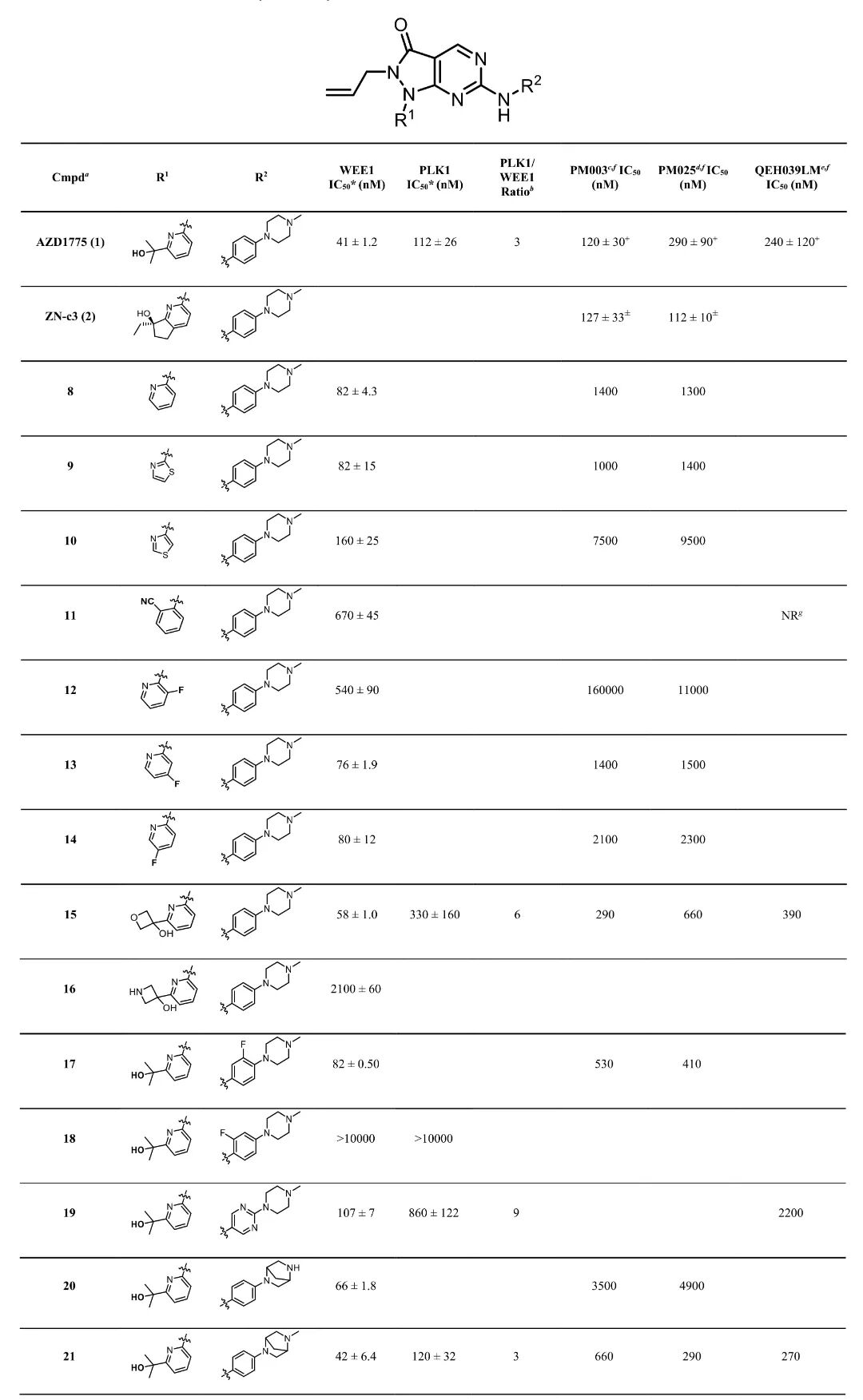
1,基于临床候选药物AZD1775的结构,设计并合成了一系列吡嗪并嘧啶酮类WEE1抑制剂。首先对核心骨架进行修饰,将酰胺化和环丙基胺基功能引入嘧啶4位,但这些修饰导致WEE1抑制活性显著降低,可能是由于无法形成抑制剂羰基与N376酰胺的关键氢键相互作用。随后团队将研究重点转向头部和尾部基团的修饰,通过比较各种杂环取代和功能团修饰,成功获得了多个对WEE1具有纳摩尔级活性的抑制剂。
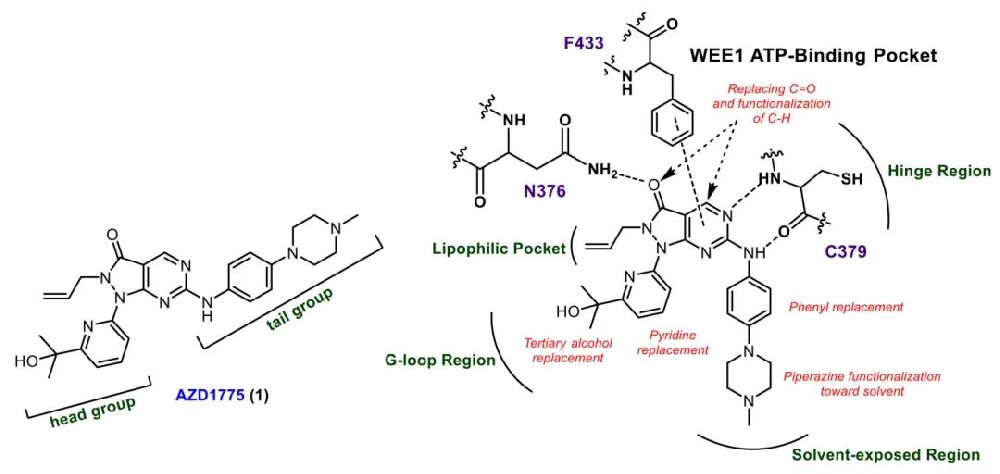
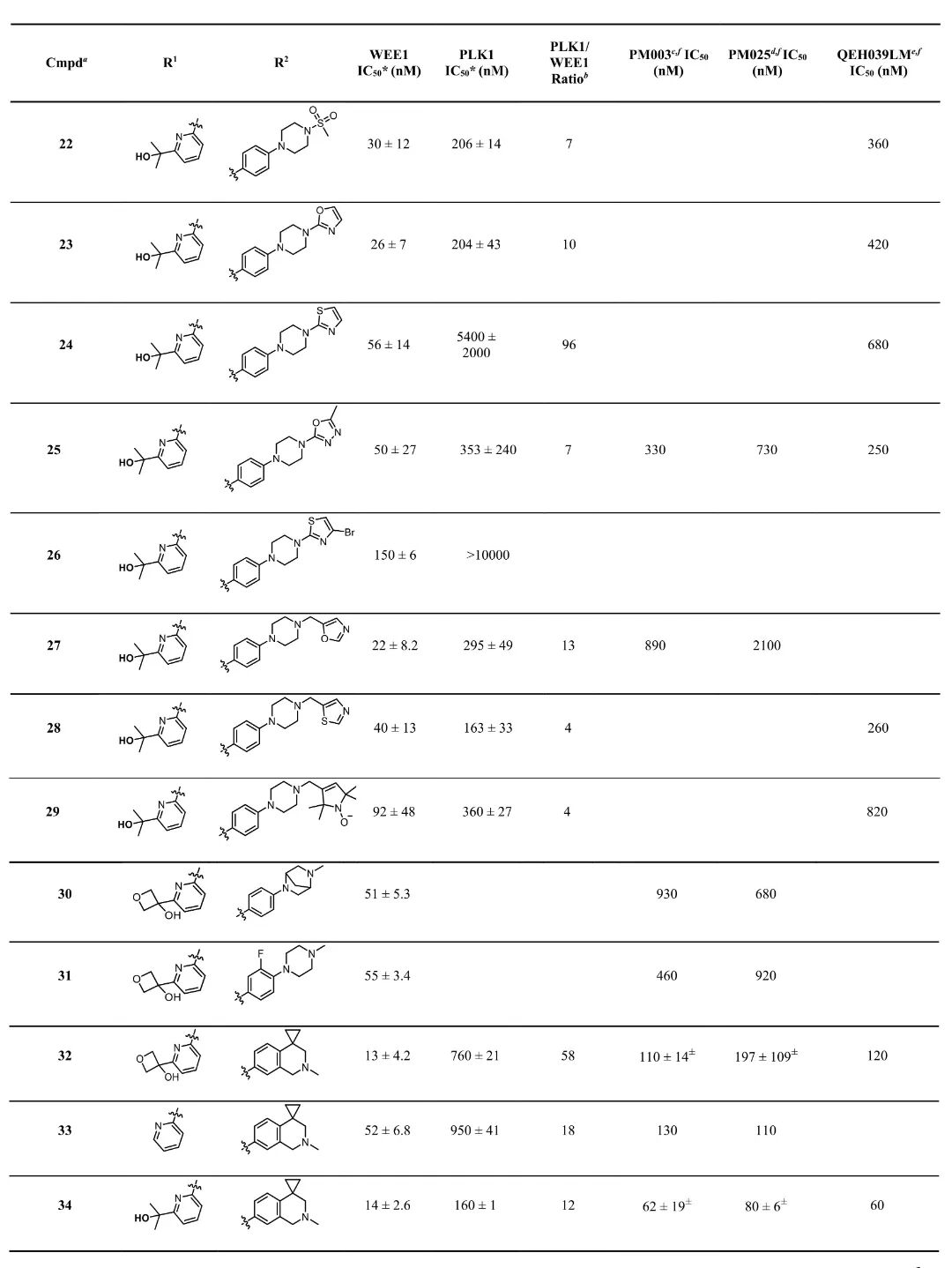
2,对AZD1775的叔醇基团进行替换,发现噁烷-3-醇衍生物(15号化合物)保持了良好的活性(WEE1 IC50值为58 nM),且对PLK1选择性显著提高(选择性指数为6)。在尾部基团修饰中,将哌嗪环替换为四氢异喹啉(THIQ)结构(34号化合物)显著提高了WEE1抑制活性(IC50值为14 nM),同时保持了对PLK1的选择性(选择性指数为12)。此外,多种含噁唑、噻唑和噁二唑基团的衍生物也表现出对WEE1的高活性和良好选择性。
3,将这些化合物应用于从TP53突变的转移性结直肠癌(mCRC)患者腹膜转移组织中分离的类器官(PDOs)活性测试。研究中使用了三种mCRC PDO细胞系:PM003(对AZD1775较敏感)、PM025(对AZD1775较耐药)和QEH039LM(肝转移来源)。测试结果表明,34号化合物对所有三种PDO细胞系均表现出卓越的抑制活性,IC50值分别为62 nM、80 nM和60 nM,均优于AZD1775(IC50值分别为120 nM、290 nM和240 nM)和当前处于临床试验阶段的ZN-c3(IC50值分别为127 nM和112 nM)。
4,进一步研究发现,在正常结肠与匹配肿瘤类器官(RAH051N/T)的对比试验中,领先化合物(25、32和34)均表现出显著的治疗窗口,肿瘤类器官对这些化合物的敏感性明显高于正常结肠类器官。尤其是34号化合物显示出卓越的治疗指数值(20),表明其具有良好的安全性潜力。机制研究表明,这些领先化合物与AZD1775具有相似的作用机制,均能诱导DNA复制应激,但32和34能显著增强DNA损伤和细胞凋亡,后者还能增加S期细胞比例。
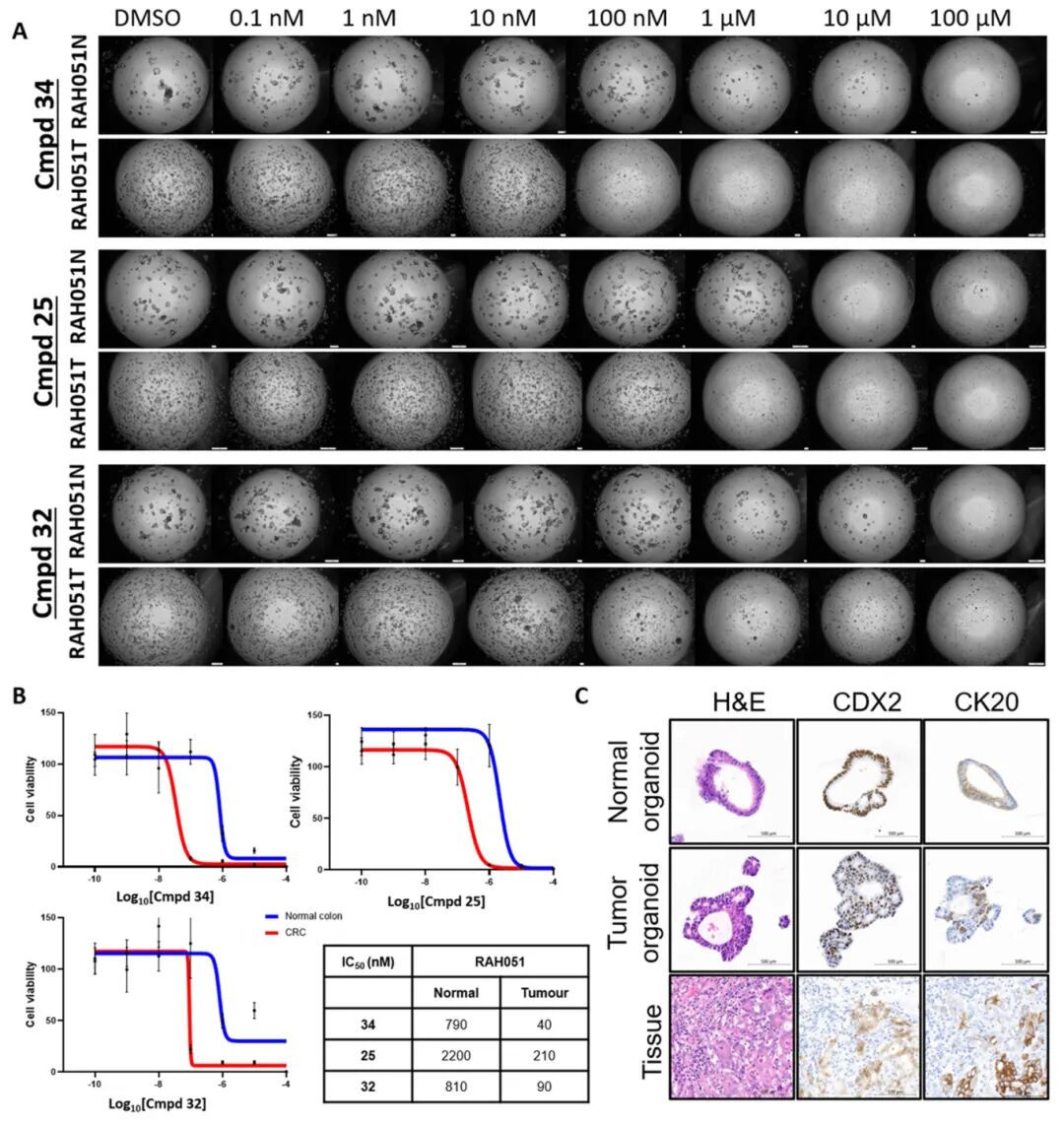
图3 与患者匹配的正常结肠类器官相比,CRC类器官对WEE1抑制剂的敏感性显著更高
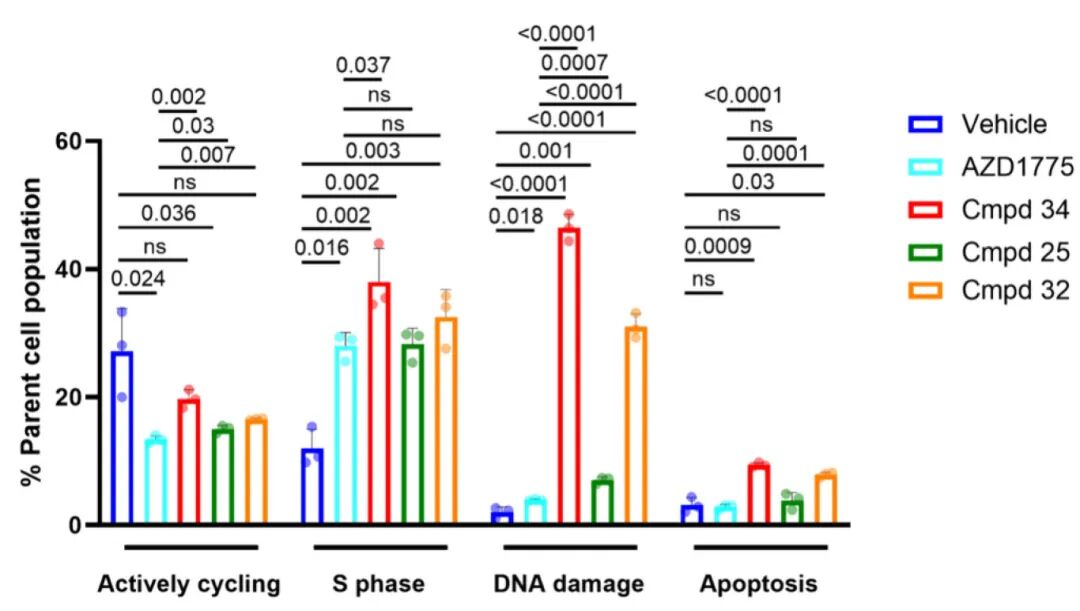
图4 WEE1抑制剂(25、32和34)的作用机制与AZD1775相似
5,研究对34号化合物进行了扩展性评估,在24种不同癌症细胞系面板中表现出良好的活性和肿瘤选择性,IC50值范围从16 nM(淋巴瘤细胞系Ramos)到30,000 nM不等。通过多变量模型分析发现,WEE1基因拷贝数与对34号化合物的敏感性显著相关。此外,西方印迹实验证实,34号化合物能浓度依赖性地降低MDA-MB-231HM乳腺癌细胞中pY15-CDK1水平,确认了其细胞内WEE1靶点参与。
6,理化性质和ADMET-PK分析显示,15号化合物(噁烷-3-醇衍生物)相比AZD1775具有更好的理化和药代性质,溶解度提高,在小鼠和人微粒体中半衰期延长,微粒体内在清除率降低。体内药代动力学研究表明,15号化合物的组织分布体积(Vss = 2.97 L/kg)是AZD1775(Vss = 1.27 L/kg)的2倍以上,表明其组织渗透性更好。
本研究利用患者来源类器官平台评估WEE1抑制剂对健康和恶性细胞活力的影响,为WEE1抑制剂的开发提供了重要见解。研究团队成功开发了一系列具有高效抗肿瘤活性的WEE1抑制剂,其中34号化合物作为主要候选物,不仅对WEE1具有极高的抑制活性(IC50值为14 nM),还对PLK1表现出良好的选择性(选择性指数为12),显著优于临床候选药物AZD1775和ZN-c3。总的来说,这项研究为靶向WEE1激酶的癌症治疗策略提供了新的候选药物和科学依据,有望推动相关药物的临床转化研究。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000