常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-10-29 17:15:22 细胞资源库平台 访问量:189
肝癌是第六大常见恶性肿瘤,也是癌症相关死亡的第四大主要原因,其中肝细胞癌(HCC)约占85%-90%。肝细胞活跃的脂质代谢与肝细胞癌的发生发展密切相关。脂肪酸代谢(FAM)作为脂质代谢的关键组成部分,在肝细胞癌中发挥着重要作用。与正常细胞相比,肿瘤细胞会发生代谢重编程,其中脂肪酸获取的方式从外源性摄取转向内源性合成增强。增强的脂肪酸生物合成(FAB)和脂质积累可以为肿瘤细胞快速增殖提供膜结构的构建块。然而,由于细胞代谢网络和脂肪酸代谢的复杂性,阐明肿瘤细胞中脂肪酸代谢的分子机制仍面临挑战。
近期,南京医科大学第一附属医院王学浩等在Journal of Hepatology期刊上发表了题为eIF3f promotes tumour malignancy by remodelling fatty acid biosynthesis in hepatocellular carcinoma的研究论文,该研究利用类器官模型、单细胞RNA测序、空间转录组学等技术,旨在确定HCC中脂肪酸代谢的特征和差异,并探索其中涉及的关键基因和分子机制,为肝细胞癌的精准治疗提供新的靶点。
1,eIF3f在HCC中高表达并与不良预后相关。研究团队建立了来自五名HCC患者的肿瘤类器官,并进行了单细胞RNA测序分析,探索HCC中脂肪酸代谢的差异。研究者建立了基于MsigDB的脂肪酸代谢评分,并通过Monocle2进行轨迹和伪时间分析,鉴定出五个类器官中脂肪酸代谢高和低集群的差异表达基因(DEGs)。通过与TCGA数据库交叉分析,识别出真核翻译起始因子3亚基f(eIF3f)和跨膜蛋白14C(TMEM14C)与HCC恶性程度和预后最相关。研究者在90对HCC样本中进一步验证,发现eIF3f在HCC与邻近正常组织之间表达差异更大,与恶性程度关联更强。空间转录组学分析证实EIF3F在HCC细胞中明显高表达,且EIF3F高表达组中上调的差异表达基因富集在多个代谢相关通路,特别是与脂质代谢相关的通路。
2,eIF3f促进HCC恶性进展。为揭示eIF3f在HCC中的生物学作用,研究者在高eIF3f表达的HCC13T类器官和Hep3B细胞中敲低EIF3F,在低eIF3f表达的HCC133T类器官和Huh7细胞中过表达EIF3F。通过体外实验证明,eIF3f影响了HCC细胞的增殖、迁移和侵袭能力。在多种动物模型中,包括患者来源类器官基于的异种移植(PDOX)模型、荷瘤小鼠模型和斑马鱼模型,均证实了eIF3f能促进肿瘤生长和转移。在裸鼠直接原位移植模型中,敲低EIF3F的小鼠生存期显著延长,而过表达EIF3F的小鼠生存期缩短。肺转移模型和斑马鱼模型也显示,eIF3f能促进HCC的转移。这些跨物种的体内外研究结果突显了eIF3f在促进HCC恶性进展中的关键作用。
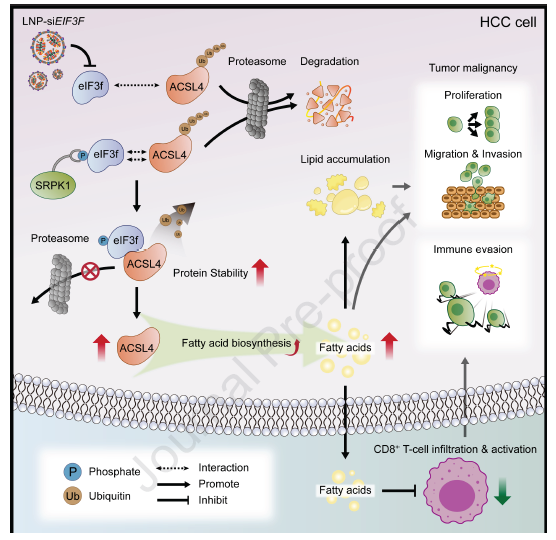
图1 实验示意图
3,eIF3f增强脂肪酸合成和脂质积累。为进一步探索eIF3f在HCC脂肪酸代谢中的具体作用,研究者对转染的Huh7细胞进行了非靶向代谢组学和蛋白质组学综合分析。结果显示,EIF3F过表达组与对照组的代谢物和蛋白质谱明显不同,上调的代谢物主要为脂类和类脂分子,如棕榈酰CoA和十八烷酸。KEGG通路富集分析显示,不饱和脂肪酸的生物合成和脂肪酸生物合成等与脂肪酸代谢相关的通路在EIF3F过表达组显著富集。通过U13C6葡萄糖代谢流分析发现,EIF3F过表达组中葡萄糖衍生的13C6更有效地掺入到脂肪酸(C16:0、C16:1、C18:0和C18:1)中。透射电镜观察和油红O染色显示,敲低EIF3F的细胞脂滴减少,而过表达EIF3F的细胞脂滴积累增加。ELISA分析和微型MRI成像进一步证实了eIF3f对细胞内和肿瘤内甘油三酯和胆固醇水平的调节作用。
4,eIF3f通过去泛素化稳定ACSL4促进脂肪酸合成。为阐明eIF3f调控脂肪酸合成的分子机制,研究者通过免疫沉淀-质谱(IP-MS)和蛋白质组学分析,鉴定出长链酰基CoA合成酶4(ACSL4)作为eIF3f的靶蛋白。共免疫沉淀和GST-pull down实验证实了eIF3f与ACSL4的直接相互作用。通过构建eIF3f和ACSL4的截短体和AlphaFold3预测结构,确定了eIF3f的mitmem区域(残基223-357)是与ACSL4结合的主要区域,而ACSL4中可能的结合片段位于中央区域(残基238-474)。蛋白质组学分析表明ACSL4水平与eIF3f水平呈正相关。进一步研究表明,eIF3f通过减少ACSL4的K48-连接泛素化水平,抑制蛋白酶体介导的ACSL4降解,从而稳定ACSL4蛋白。在eIF3f的MPN结构域中,残基161-163(KKV)是其去泛素化活性的关键,而ACSL4蛋白上的K148和K536是被eIF3f去泛素化的关键位点。
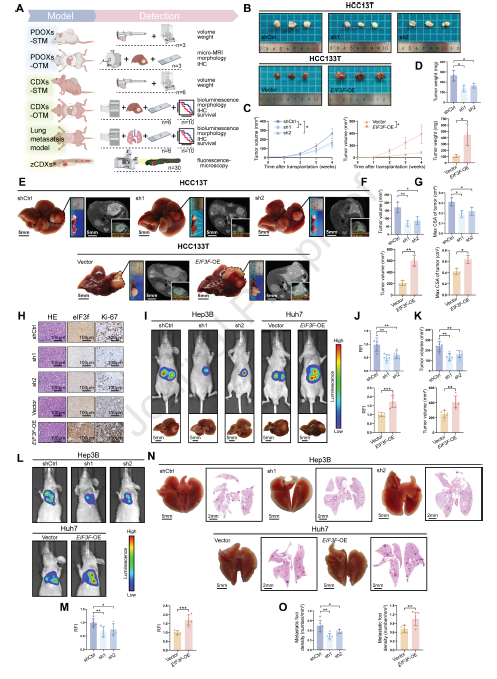
图 2 升高的真核起始因子 3 亚基 f(eIF3f)水平在体外和体内都会促进肝细胞癌(HCC)的恶性发展
5,磷酸化修饰增强eIF3f与ACSL4的相互作用。研究发现去磷酸化的eIF3f和ACSL4之间的相互作用显著减弱,表明磷酸化对两者相互作用十分重要。通过IP-MS分析和siRNA筛选,研究者鉴定出丝氨酸/精氨酸蛋白激酶1(SRPK1)作为调控eIF3f磷酸化的关键激酶。敲低SRPK1或使用SRPK1抑制剂SPHINX31削弱了eIF3f与ACSL4的相互作用。进一步通过构建磷酸化位点突变体并结合PhosphoSitePlus和GPS网站数据,最终鉴定出Ser266是影响eIF3f与ACSL4结合的磷酸化位点。在HEK293T细胞中,敲低SRPK1减弱了野生型eIF3f与ACSL4的相互作用,但对磷酸模拟型eIF3f突变体(S266D)无显著影响,表明eIF3f的磷酸化可增强其与ACSL4的相互作用。
6,eIF3f促进脂肪酸合成减少CD8+ T细胞浸润,且可作为HCC治疗靶点。研究发现eIF3f/ACSL4的表达水平与HCC患者的预后密切相关。流式细胞仪时间飞行(CyTOF)分析和多重荧光免疫组化染色显示,敲低Eif3f的肿瘤中CD8+ T细胞浸润增加,且CD8+ T细胞活性(IFN-γ和GZMB水平)增强。相反,Eif3f过表达抑制了CD8+ T细胞浸润和活性。这表明eIF3f介导的肿瘤内脂肪酸水平升高可能通过影响免疫微环境减少CD8+ T细胞浸润。基于这一发现,研究者使用脂质纳米颗粒(LNP)递送针对Eif3f的siRNA,结合抗PD-1免疫治疗,在小鼠原位肿瘤模型中取得显著的治疗效果,表明靶向eIF3f可能是HCC精准治疗的潜在策略,尤其适用于eIF3f高表达的患者。
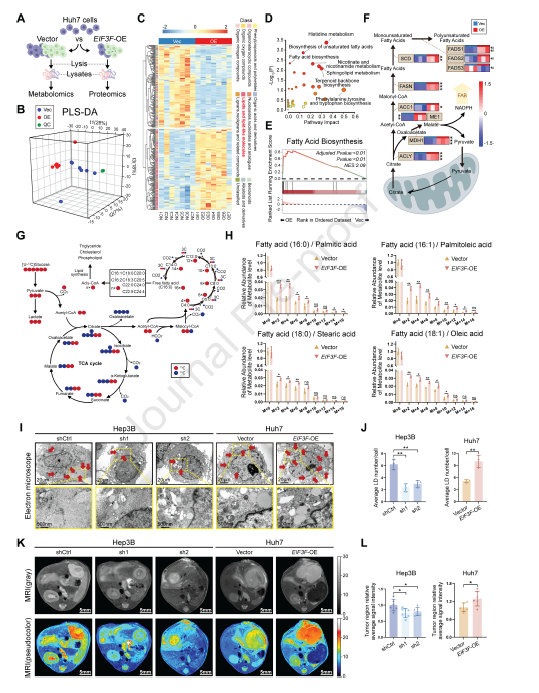
图 3 真核起始因子 3 亚基 f(eIF3f)增强了肝细胞癌(HCC)中的脂肪酸生物合成和脂质积累
该研究阐明了eIF3f在肝细胞癌中促进肿瘤恶性进展的分子机制。研究发现eIF3f通过去泛素化稳定ACSL4,促进脂肪酸合成和脂质积累,从而增强肝细胞癌的恶性程度。同时,eIF3f介导的脂肪酸代谢重塑改变了肿瘤微环境,减少了CD8+ T细胞的浸润和活化,这为理解肝细胞癌免疫逃逸提供了新的视角。研究还揭示了SRPK1介导的eIF3f磷酸化在调控eIF3f与ACSL4相互作用中的重要作用,为深入理解蛋白质翻译后修饰在代谢重编程中的功能提供了依据。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:HNSCC PDOs的基因组和单细胞分析助力个体化治疗
下一篇:高通量筛选新突破:THP-1 报告细胞揪出 TLR 抑制性纳米颗粒