常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-10-24 09:00:38 细胞资源库平台 访问量:146
肠道生物学研究领域已经发生了革命性的变化,主要得益于三维(3D)肠道上皮细胞培养技术的发展。在这些方法中,从供体物种肠道隐窝分离的初级肠道干细胞被培养在细胞外基质(ECM)中,支持多能细胞自组织成为被称为肠道类器官的3D结构。这些类器官可以在没有人工应用的永生化条件下经过多次培养传代而持续存在,并包含天然肠道上皮中发现的各种细胞类型,如肠细胞、杯状细胞、潘氏细胞和肠内分泌细胞。由于其多细胞性和结构复杂性,类器官提供了一个先进的研究平台,弥合了传统细胞培养和体内研究之间的差距,使其特别适合于研究肠道生理学和疾病。
牛新生儿腹泻是由各种肠道病原体引起的,包括病毒、细菌和原虫。2014年,美国农业部报告称,不到一个月大的奶牛犊中超过50%的健康事件归因于肠道疾病,导致死亡率增加、农场效率降低,并对奶牛的福利产生负面影响。此外,奶牛犊已被证明与人类肠道感染爆发有关,这凸显了动物健康对人类健康的影响。研究这些病原体-宿主相互作用需要强大的模型,以更好地了解导致定植、复制和疾病的因素。
肠道类器官技术已被用作牛相关传染因子的模型,包括牛冠状病毒、副结核分枝杆菌和胃肠道线虫。然而,研究设计在类器官供体年龄、品种和培养基方面的变异性限制了其在其他研究问题,特别是与牛新生儿肠道感染相关的研究问题上的适用性。随着牛的年龄增长,成熟的肠道上皮对病原体感染具有抵抗力。例如,肠毒素大肠杆菌是不到一周龄的犊牛新生儿腹泻的主要原因,而超过一周龄的犊牛会对疾病产生抵抗力。这突显了根据牛的年龄优化肠道类器官培养方法的重要性,以确保为研究人员提供可靠的协议。
近期,一篇题为From in vitro development to accessible luminal interface of neonatal bovine-derived intestinal organoids的研究发布在BMC Veterinary Research期刊,该研究从14日龄奶牛犊中开发了肠类器官和类器官衍生单层细胞,以促进对早期肠道功能和疾病的研究。
1,牛新生儿肠道类器官的建立和冷冻保存。研究团队成功地从14天龄奶牛犊的十二指肠、空肠、回肠、结肠和直肠五个肠道部位建立了肠道类器官。他们使用自制的定制培养基,成功培养了这些类器官,并能在含有10%二甲基亚砜和90%胎牛血清的冷冻保存液中保存超过300天。复苏成功率因冷冻小瓶而异,从不同肠道部位至少有一个细胞系能够传代至少15次以上。研究发现,十二指肠和空肠类器官在传代过程中出现增殖能力下降,表现为暗色、颗粒状外观。添加10%胎牛血清改善了这些类器官的形态和增殖能力,使其能够继续稳定培养。相比之下,回肠、结肠和直肠类器官不需要胎牛血清补充就能维持其形态和增殖能力。
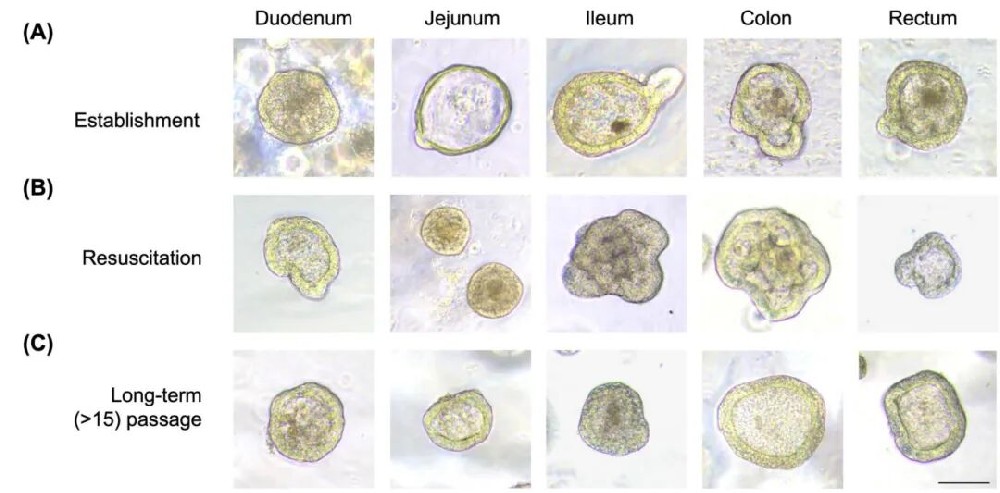
图1 新生牛肠类器官培养的相衬图像
2,牛新生儿肠道类器官的细胞特征分析。免疫荧光特征分析证实了类器官的多细胞组成。这些类器官细胞表达上皮细胞间粘附连接(E-cadherin),并与F-actin共定位。细胞采用基底外极性并形成中央腔,增强的F-actin染色指向腔内空间,DAPI染色的细胞核位于周边。类器官细胞的上皮性质通过上皮细胞粘附分子(EpCAM)染色得到验证。SOX9染色显示许多细胞保持干性状态,但并非所有细胞都是如此。活跃复制的细胞通过EdU摄取被识别。此外,在所有肠道部位的类器官中都观察到了细胞内和类器官腔内的Sambucus nigra凝集素(SNA)染色,表明存在杯状细胞分化,并且许多细胞将其分泌物导向腔内,突显了类器官内混合细胞群的存在。
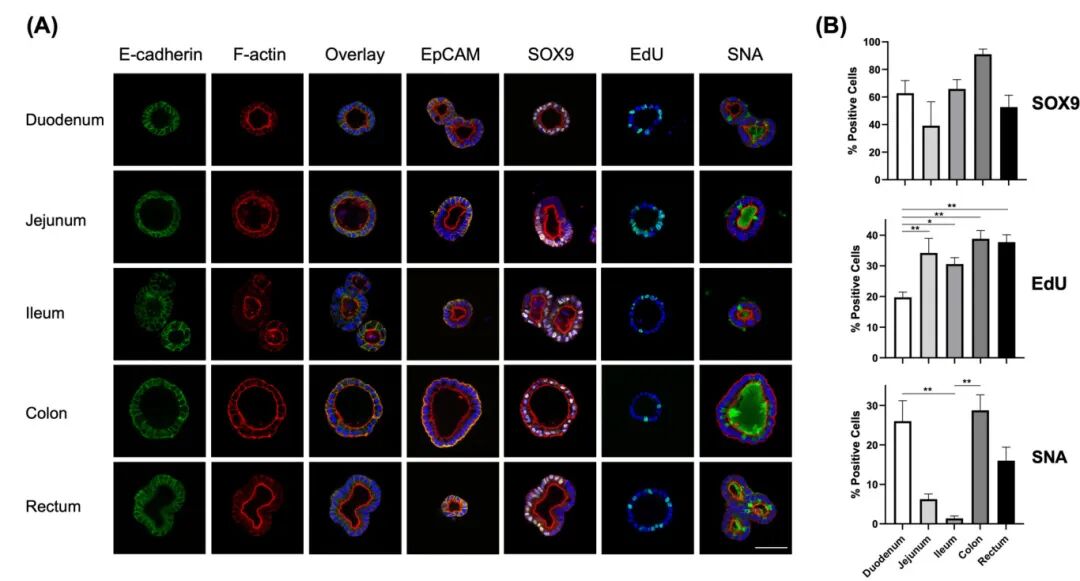
图2 新生牛肠类器官的免疫荧光染色
3,类器官扩增与分化培养基的基因表达分析。基因表达分析进一步证实了类器官的细胞组成、区域特性和潜在的功能特征。在不同肠道部位的类器官中观察到目标上皮谱系标记基因的相对表达水平存在差异。干细胞标记基因LGR5在分化培养基(ODM)处理的类器官中表达水平较低,在回肠和直肠类器官中差异尤为显著。肠内分泌细胞标记基因CHGA在ODM处理的直肠类器官中表达水平较高。潘氏细胞标记基因LYZC在所有部位的ODM处理类器官中普遍下调,但未达到统计学显著性。有趣的是,ODM处理的结肠类器官倾向于增加杯状细胞标记基因MUC2的表达,而其他类器官在分化培养基处理下MUC2表达下调。最后,肠上皮细胞标记基因FABP2在所有ODM处理的类器官中上调,在回肠、结肠和直肠类器官中达到统计学显著水平。
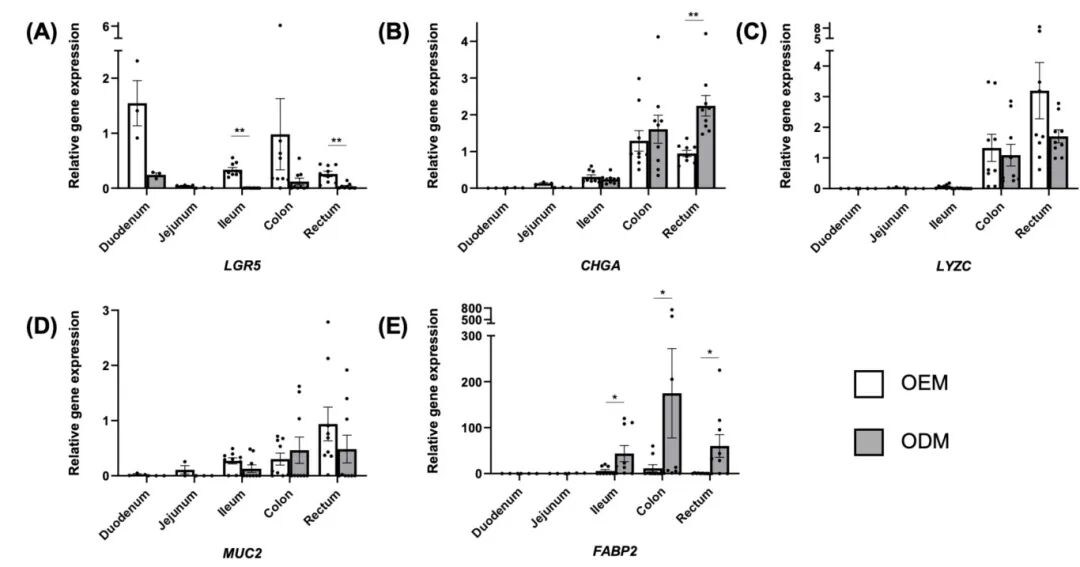
图3 在扩增(OEM)或分化(ODM)培养基中培养的新生牛肠道类器官的相对基因表达
4,直肠类器官衍生单层的发展和屏障完整性评估。在研究中,研究人员发现直肠类器官相比其他肠道部位的类器官展现出最稳定的发展。基于这一观察,研究团队成功建立了从新生牛直肠类器官衍生的稳定二维单层培养。单层细胞在培养第1天达到汇合(图4A),并在整个6天培养期间保持稳定,无论是在单层扩增培养基(MEM)中全程培养还是在第3天切换到单层分化培养基(MDM)后培养。相控显微镜观察显示,MEM和MDM条件下的单层细胞在培养第6天没有形态学差异。单层的屏障完整性通过跨上皮电阻(TEER)测量和表观渗透性(Papp)检测得到确认,后者评估了4 kDa FITC-葡聚糖标记物穿过单层的扩散情况。TEER测量显示从第1天到第2天(65.2±26.6 vs. 188.6±34.9 Ωcm2)以及从第2天到第3天(188.6±34.9 vs. 302.9±21.5 Ωcm2)有显著增加。TEER值在第4天达到峰值(317.1±35.9 Ωcm2),并持续到第5天(290.6±24.2 Ωcm2)。TEER值的变化与4 kDa FITC-葡聚糖扩散阻力增加相一致,表现为Papp值降低。培养第3天,单层展现出与第1天相比Papp值显著降低(5.2±0.7 vs. 1.4±0.3×10-7 cm/s),并持续到第5天(0.9±0.2×10-7 cm/s)。
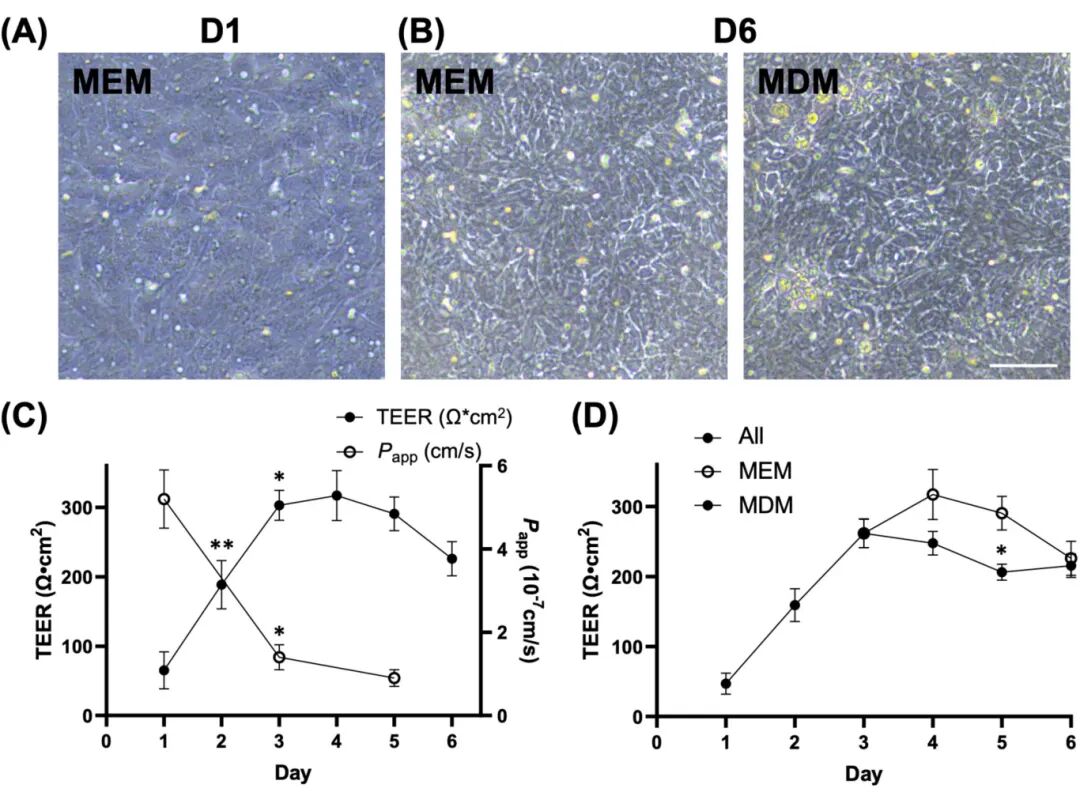
图4 评价来自新生儿牛直肠类器官的稳定二维单层
5,单层细胞的超微结构特征。电子显微镜进一步证实了单层细胞的详细特征。扫描电子显微镜(SEM)评估显示单层细胞发展出微绒毛和粘蛋白样颗粒,表明功能性上皮成熟(图6A&B)。透射电子显微镜(TEM)证实了细胞间紧密连接的形成,强化了稳健屏障功能的建立(图6C)。此外,存在发达的微绒毛和糖萼层,表明吸收营养物质的表面积增加(图6D)。这些超微结构特征突显了直肠类器官衍生单层模拟天然肠道上皮关键特征的能力,进一步支持了细胞和分子分析中观察到的功能分化。
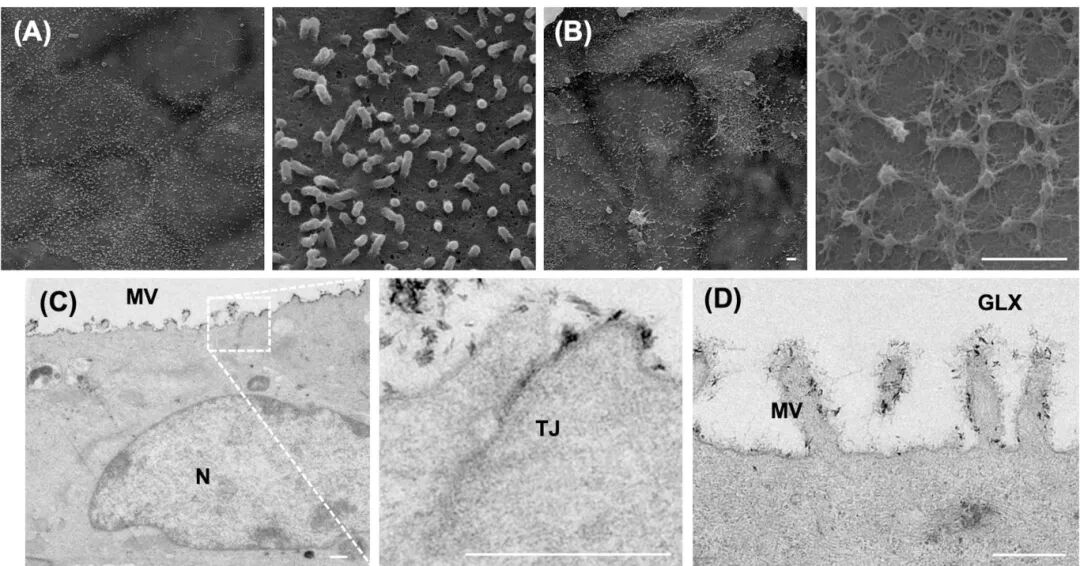
图5 直肠类器官衍生的二维单层的电子显微镜表征
6,MEM和MDM培养条件下直肠单层的基因表达特征。基因表达分析显示,与MEM培养的单层相比,MDM处理的单层中LGR5表达下调,而上皮谱系标记基因CHGA、LYZC、MUC2和FABP2上调。值得注意的是,MDM处理的单层中MUC2表达显著上调,相对于MEM培养的单层。这些基因表达变化表明单层细胞在分化培养条件下向更成熟上皮细胞发展的趋势,与类器官样本中观察到的分化模式相似。
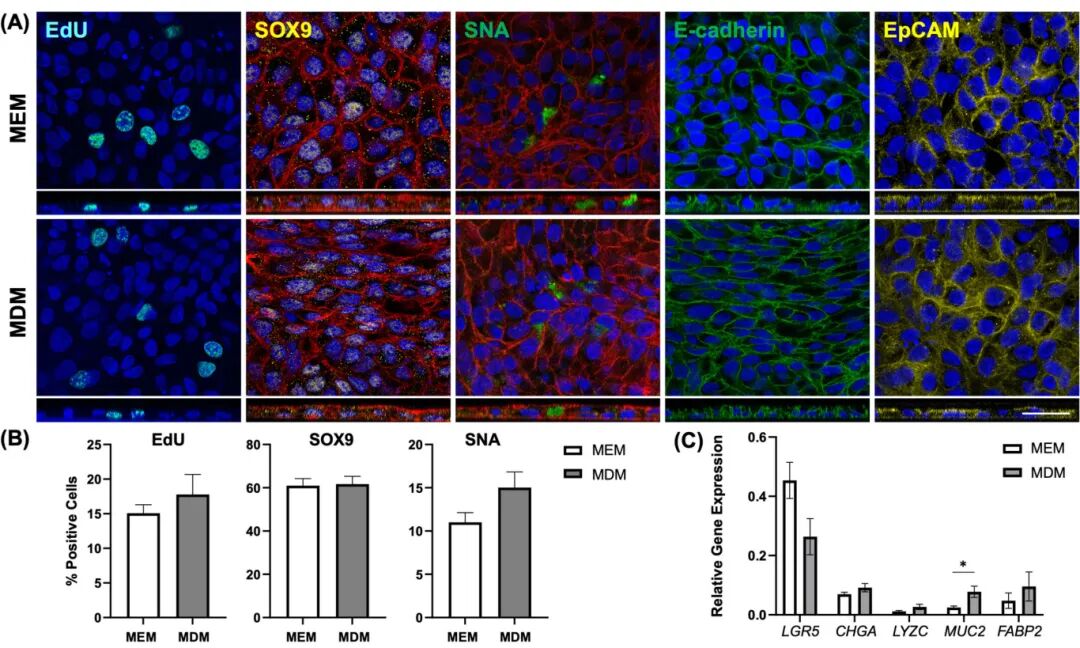
图6 在扩增(MEM)或分化(MDM)培养基中培养的2D直肠单层细胞的免疫荧光和基因表达分析
本研究成功将成年牛肠道类器官的优化培养条件转化应用于14天龄奶牛犊的肠道样本,从五个不同肠道区域建立了类器官培养系统。这些新生牛类器官展现了与体内相似的关键特征,包括自组织、多细胞性和专门活动。特别是成功建立了功能性直肠类器官衍生单层,解决了接触腔内表面的主要挑战,这对于研究宿主-病原体相互作用至关重要。这项研究为研究牛新生儿肠道生物学提供了新的工具和方法,特别是针对那些易感染肠道病原体如牛轮状病毒和隐孢子虫的年龄组。通过优化这些体外模型,研究人员现在能够更精确地研究肠道屏障功能和宿主-病原体相互作用,这对于开发预防和治疗策略至关重要。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000