常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-10-23 17:19:22 细胞资源库平台 访问量:173
在生物医学研究和药物开发领域,生物发光成像技术因其高信噪比而被广泛应用于细胞测定和动物成像研究。然而,传统的荧光素酶种类有限,限制了同时成像多个分子和细胞事件的能力。为了突破这一限制,科学家们开发了一种新型的ATP非依赖性荧光素酶——NanoLuc(NL),它源自深海虾Oplophorus gracilirostris,并经过工程改造以增强蛋白质稳定性。NanoLuc作为一种小型(19 kDa)、高亮度的荧光素酶,其亮度是传统萤火虫或海肾荧光素酶的100倍,并且使用furimazine作为底物产生明亮的辉光型发光。NanoLuc的意义在于其为双报告基因生物发光分子成像提供了新的可能。它不仅可以在活体小鼠的表层和深层组织中成像,而且其生物发光随时间的变化可以用来定量肿瘤生长,甚至在少量血清中也能检测到分泌的NL。此外,NanoLuc与萤火虫荧光素酶的结合使用,为在完整细胞和活体小鼠中定量TGF-β信号传导的两个关键步骤提供了一种新型双荧光素酶成像策略,从而在正常生理、疾病和药物开发中扩展了信号转导的成像能力。NanoLuc的作用不仅体现在其高灵敏度和高稳定性上,它还具有更小的尺寸,这使得在标记细胞和蛋白质时对样本的侵入性更小,有助于保持细胞或组织的天然状态。NanoLuc的快速反应、低背景发光和多样灵活等特点,使其在生物学和医学研究中具有广泛的应用前景。因此,NanoLuc作为一种新的报告基因,不仅增强了我们对生物过程的理解和疾病机理的研究,而且在开发潜在治疗方法和疗法方面发挥了重要作用。
英文标题:Cell-based high-throughput screening using a target–NanoLuc fusion construct to identify molecular glue degraders of c-Myc oncoprotein
中文标题:基于靶标 - NanoLuc 融合构建体的细胞水平高通量筛选鉴定 c-Myc 癌蛋白的分子胶降解剂
发表期刊:《RSC Chemical Biology》
影响因子:3.1
作者单位:
1. Centre of Translational Research, Shenzhen Bay Laboratory, Guangming District, Shenzhen, Guangdong 518132, China
2. University of Chinese Academy of Sciences, 19 Yuquan Rd, Shijingshan District, Beijing 100049, China
3. Multi-omics Mass Spectrometry Core, Biomedical Research Core Facilities, Shenzhen Bay Laboratory, Guangming District, Shenzhen, Guangdong 518132, China
作者信息:
Muyu Xu, Jinying Qiu, Lin Tan, Jiayu Xu, Yi Wang, Wenyue Kong, Hongda Liao, Anran Chen, Xiaolan Chen, Jiying Zhang, Cookson K. C. Chiu, Meiying Zhang, Yingying Tian, Caohui Li, Biao Ma, Leiming Wang, Jingpeng Fu, Seung H. Choi, Jeffrey Hill, Weijun Shen
c-Myc 癌蛋白作为调控 15%-20% 细胞基因表达的转录因子,在 70% 以上癌症(如淋巴瘤、乳腺癌、肝癌)中失调,是肿瘤发生发展的关键驱动因子,但因无传统配体结合口袋、定位于细胞核且对正常细胞功能必需,40 年来被视为 “不可成药” 靶标。现有靶向策略(如阻断 Myc/Max 二聚化、抑制上游 BRD4)多停留在临床前阶段,蛋白降解剂中 PROTACs 因分子量大、口服递送困难受限,而分子胶降解剂(MGDs)分子量小(通常 < 500 Da)、可诱导新型蛋白相互作用,是靶向 Myc 的理想方向,但其发现多依赖偶然,缺乏高效筛选体系。基于此,本研究构建 Myc-NanoLuc 融合质粒的细胞水平高通量筛选(HTS)系统,旨在筛选可下调 Myc 的小分子,鉴定具有分子胶特性的 Myc 降解剂,为 “不可成药” 靶标 Myc 的靶向治疗提供新工具。
质粒构建与细胞准备:构建两种质粒,分别为编码 f-Myc-Nluc 融合蛋白的 pCDNA3-f-Myc-Nluc 和仅编码 f-Nluc 的 pCDNA3-f-Nluc,将其分别瞬时转染至 293T 细胞后冷冻保存(每管约 2000 万细胞)。筛选时将冻存细胞复苏,用含 10% FBS 的培养基调整密度至 500 细胞 /μL,经 40-70μm 细胞滤膜过滤后接种至 1536 孔板,避免细胞 dispenser 堵塞。
HTS 筛选流程:先以含 17452 个已知活性化合物的生物活性库验证系统,以 UNC10112785(CDK9 抑制剂)为阳性对照,筛选出已知 Myc 下调化合物 G9(去泛素化酶抑制剂)和 SY-1365(CDK7/9 抑制剂);再筛选 ChemDiv 库的 108800 个化合物,初筛以 “f-Myc-Nluc 信号降低> 30%” 为阳性,复筛通过三重验证 + 反筛(f-Nluc 信号降低 < 20% 排除毒性或荧光素酶抑制剂),经剂量响应实验确定 DC50 后,用 Western blot 验证 Myc 降解活性,筛选过程控制 Z 因子 > 0.5、CV<10%、检测窗口 = 3.5。
Myc 结合与降解机制验证:采用细胞热迁移实验(CETSA),在 293T 全细胞裂解液中 56℃加热 3min,以 Myc 结合剂 MYC361i 为阳性对照,检测化合物对 Myc 热稳定性的影响;通过差示扫描荧光法(DSF)检测重组 Myc/Max 蛋白中化合物对 Myc 熔点的影响;293T 细胞转染 Flag-Myc 后加梯度浓度 C1,用免疫共沉淀(Co-IP)检测 Myc 与 Max 及 E3 连接酶(FBXW7、CHIP)的相互作用;转染 Myc-eGFP-IRES-mCherry 的 293T 细胞经 C1 处理后,用共聚焦显微镜观察 Myc 聚集情况。
功能与特异性验证:通过细胞活力实验(CTG)检测 C1 对 6 种不同 Myc 表达细胞系(Ramos、HCT116 等)的 GI50,分析其杀伤选择性;qRT-PCR 检测 C1 对 Myc 靶基因(CAD、CCNB1 等)和非靶基因(ACTB)的表达影响;Ramos 细胞加 10μM C1 处理 8h 后,采用 label-free 定量蛋白质组学(LFQ-MS)分析下调蛋白与 Myc 直接结合基因的重叠率,评估 C1 的作用特异性。
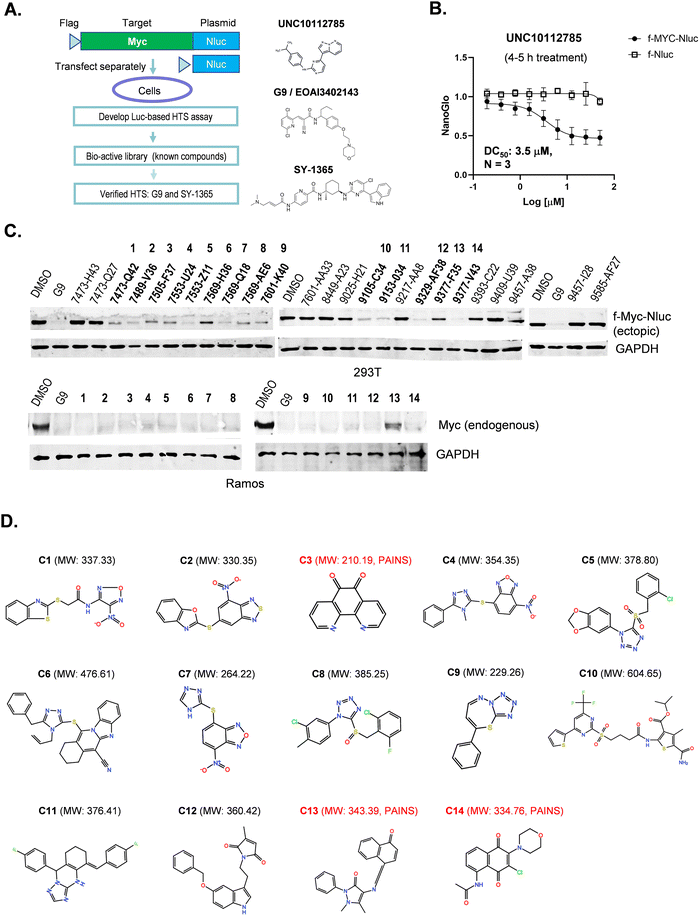
图1:Myc 下调化合物的 HTS 筛选与鉴定
图 1A 展示 HTS 系统设计:转染 f-Myc-Nluc 或 f-Nluc 的 293T 细胞经化合物处理 4-5h 后检测 NanoGlo 信号,UNC10112785 为阳性对照,从生物活性库中筛选出 G9 和 SY-1365;
图 1B 显示 UNC10112785 对 f-Myc-Nluc 呈剂量依赖性抑制,对 f-Nluc 无影响;
图 1C Western blot 结果显示,25 个初筛阳性化合物中 14 个(命名为 C1-C14)可有效降解异位 f-Myc-Nluc(抗 Flag 抗体检测)和 Ramos 细胞内源性 Myc,11 个为假阳性;
图 1D 呈现 14 个化合物的化学结构,其中 C3、C13、C14 含 PAINS 预警结构(红色标注),多数化合物分子量 < 500 Da。
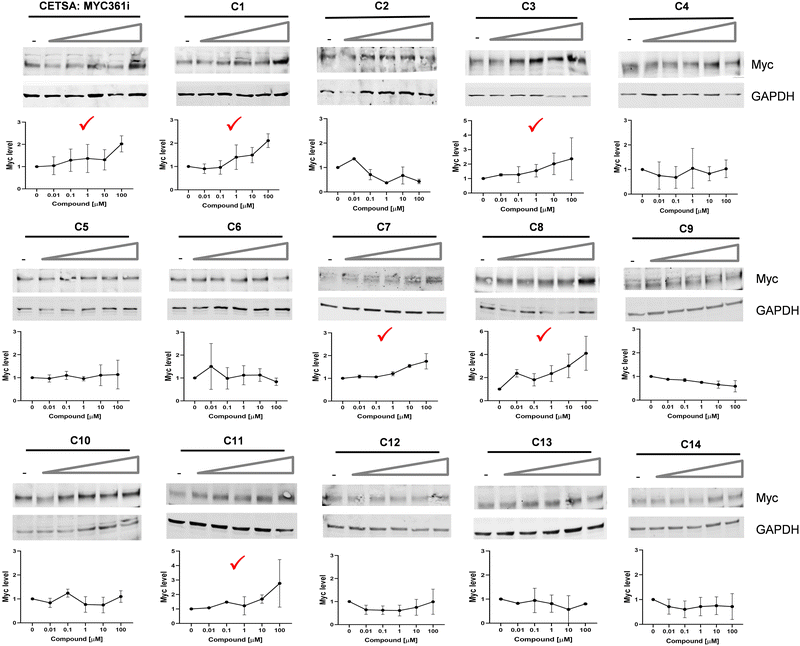
图2:CETSA鉴定出5个Myc结合候选化合物
CETSA 鉴定 Myc 结合化合物预实验确定 CETSA 最佳加热温度为 56℃(此温度下 MYC361i 可显著稳定 Myc);
图 2 结果显示,MYC361i(阳性对照)及 C1、C3、C7、C8、C11 在 0.01-100μM 浓度范围内,随剂量增加可显著提升加热后 Myc 的可溶性(即增强 Myc 热稳定性),而其余 9 个化合物无此效果,证实这 5 个化合物可直接结合 Myc,符合分子胶降解剂(MGD)的候选特征。
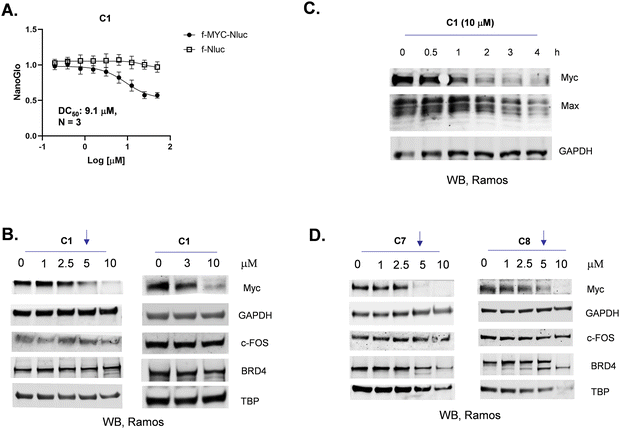
图3:C1 的 Myc 选择性降解特性图
3A NanoGlo 实验显示,C1 对 f-Myc-Nluc 的 DC50 约为 9.1μM,对 f-Nluc 无抑制作用;图 3B Western blot 结果表明,C1 对 Ramos 细胞内源性 Myc 的 DC50 约 5μM,且对 GAPDH、BRD4、c-FOS 等其他蛋白无显著降解;图 3C 时间依赖性实验显示,C1 处理 2h 后 Myc 和 Max 蛋白开始降解;图 3D 对比显示,C7、C8 虽 DC50 与 C1 相近(约 5μM),但会非特异性降解 BRD4、TBP 等蛋白,进一步证实 C1 对 Myc 的降解选择性更优。
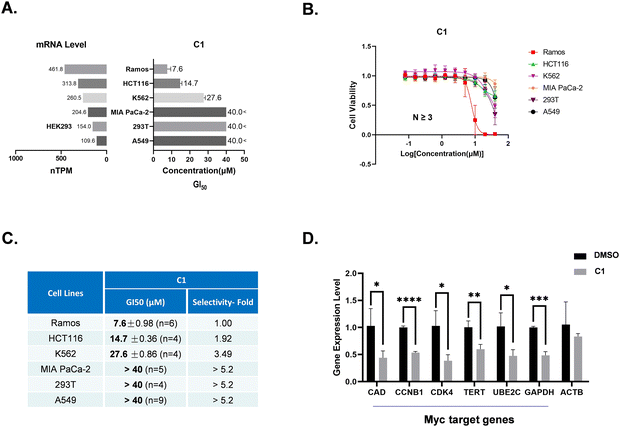
图4:冻干即用型试剂的稳定性与检测效果
4A 显示细胞 Myc mRNA 表达水平(nTPM)与 C1 的 GI50 呈负相关:Myc 表达最高的 Ramos 细胞(461.8 nTPM)GI50 最低(7.6μM),Myc 表达最低的 A549 细胞(109.6 nTPM)GI50>40μM;图 4B 细胞活力曲线进一步验证 C1 对高 Myc 表达细胞的抑制作用更显著;图 4C 计算得出 C1 对 Ramos 细胞的杀伤选择性是 A549 细胞的 > 5.2 倍;图 4D qRT-PCR 结果显示,C1 可显著降低 Myc 靶基因(CAD、CCNB1、CDK4 等)的表达,对非 Myc 靶基因 ACTB 无明显影响,证实 C1 通过调控 Myc 发挥作用。
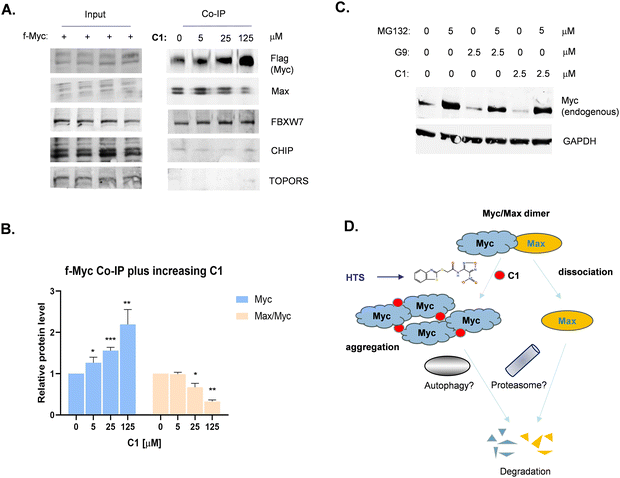
图5:C1 的分子胶作用机制图
5A Co-IP 结果显示,随 C1 浓度增加(0-125μM),Flag-Myc pull-down 的内源性 Myc 显著增多(提示 Myc 聚集),而结合的 Max 蛋白逐渐减少(表明 Myc/Max 相互作用被阻断),Myc 与 E3 连接酶 FBXW7 的相互作用略有增强;
图 5B 定量分析显示,C1 浓度达 25μM 时,Myc 聚集量显著升高(p<0.05),Max/Myc 比值显著降低(p<0.05);
图 5C Western blot 显示,蛋白酶体抑制剂 MG132 可阻断 C1 介导的 Myc 降解,提示 Myc 降解依赖蛋白酶体途径;
图 5D 机制示意图总结:C1 作为分子胶诱导 Myc 自聚集、阻断 Myc/Max 二聚化,进而促进两者通过蛋白酶体途径降解。
本研究成功开发基于 Myc-NanoLuc 融合质粒的细胞水平高通量筛选系统,该系统 Z 因子高、特异性好,从 108800 个化合物中筛选出 14 个 Myc 下调化合物,其中 C1 可通过分子胶机制直接结合 Myc,诱导 Myc 自聚集并阻断 Myc/Max 相互作用,以约 5μM 的 DC50 选择性降解 Myc/Max 蛋白。功能验证表明,C1 对高 Myc 表达癌细胞(如 Ramos)的杀伤选择性 > 5.2 倍,可显著下调 Myc 靶基因表达,且对非靶蛋白影响小。该筛选系统为其他 “不可成药” 靶标的降解剂发现提供了可推广的技术方案,而 C1 作为新型 Myc 分子胶降解剂,为慢性 Myc 失调相关癌症的治疗提供了候选分子,未来需通过化学修饰优化其 potency 并验证体内疗效。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:1484 例患者验证!深度学习 NTCP 模型提升头颈部癌放疗毒性预测