常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-10-22 09:03:46 细胞资源库平台 访问量:175
骨软骨缺损(OCDs)是一种常见的关节损伤,通常由创伤或骨关节炎引起,需要有效的治疗策略来实现完整修复。膝关节的天然骨软骨结构由三层组成:关节软骨、钙化软骨和软骨下骨,它们呈现出无缝的梯度异质性过渡。关节软骨主要由II型胶原和蛋白多糖组成,无血管且依赖滑液获取氧气和营养物质。相比之下,软骨下骨是高度血管化的硬组织,其细胞外基质由I型胶原和羟基磷灰石组成,提供结构支持和刚度。钙化软骨层作为过渡结构,自然连接关节软骨和软骨下骨。这三个组成部分共同形成了梯度异质性骨软骨组织。
尽管目前有各种临床治疗方法,如关节镜清创术、微骨折术、干细胞移植和自体/异体移植,但没有一种能够实现软骨和软骨下骨的一体化再生,同时保持梯度异质性。这些方法往往无法重建自然梯度结构,移植物失败仍是一个显著问题。传统的组织工程方法虽在动物模型中显示一些进展,但仍难以复制天然骨软骨组织中的平滑过渡,导致研究成果与临床需求之间存在差距。
类器官技术——通过自组装构建功能性组织的方法——为OCDs修复提供了一条有希望的途径。类器官是由多能干细胞或成体干细胞通过自组装形成的三维细胞球,广泛应用于器官发育、疾病建模、药物发现和再生医学。软骨类器官构建相对成熟,能够分泌自身的细胞外基质以保护软骨细胞。相比之下,骨类器官构建仍面临挑战,尤其是需要精确调控基质矿化和沉积。
骨软骨修复的一个关键挑战在于整合软骨和骨类器官,以模拟天然梯度结构。构建分离的软骨和骨类器官可能是可行的,但这种方法面临重大的科学和实际挑战,包括骨类器官的成熟方案缺乏、同时构建两种不同类器官的复杂性以及在它们之间实现无缝梯度过渡的困难。因此,使用具有软骨和骨双向分化能力的同一种干细胞开发单一类型的类器官,并提供合适的微环境引导分化,可能为这些问题提供解决方案。
近期,海南医科大学附属医院陈茹/上海市肺科医院徐勇等发布在Journal of Nanobiotechnology期刊,题为Single BMSC-derived cartilage organoids for gradient heterogeneous osteochondral regeneration by leveraging native vascular microenvironment的研究提出了一种利用天然血管微环境梯度来诱导单一骨髓间充质干细胞(BMSCs)衍生的软骨类器官实现骨软骨梯度异质性再生的创新策略。
1,兔BMSCs的分离、鉴定和分化能力评估。研究团队首先分离了兔骨髓间充质干细胞(BMSCs)并进行了系统表征。P0期BMSCs主要呈三角形、梭形或纺锤形,随着培养时间增加,细胞密度逐渐增大并覆盖培养皿底部。使用间充质干细胞标记物CD29和CD44以及造血标记物CD34和CD45进行流式细胞术和免疫荧光染色分析,结果显示MSC标记物在P0时表达水平高(CD29为71.9%,CD44为98.4%),随着传代次数增加逐渐下降,在P7时达到最低(CD29为67.3%,CD44为87.5%),但仍保持较高水平。而造血标记物CD34和CD45在P0时表达低(分别为0.5%和4.31%),且在P3时显著降低(分别为0.4%和0.7%),表明P3细胞已基本消除了造血细胞成分。茜素红S和阿尔新蓝染色证实了BMSCs具有骨和软骨分化潜能,但这种能力在P3之后显著下降。基于这些结果,研究选择了P3 BMSCs用于后续软骨类器官开发。
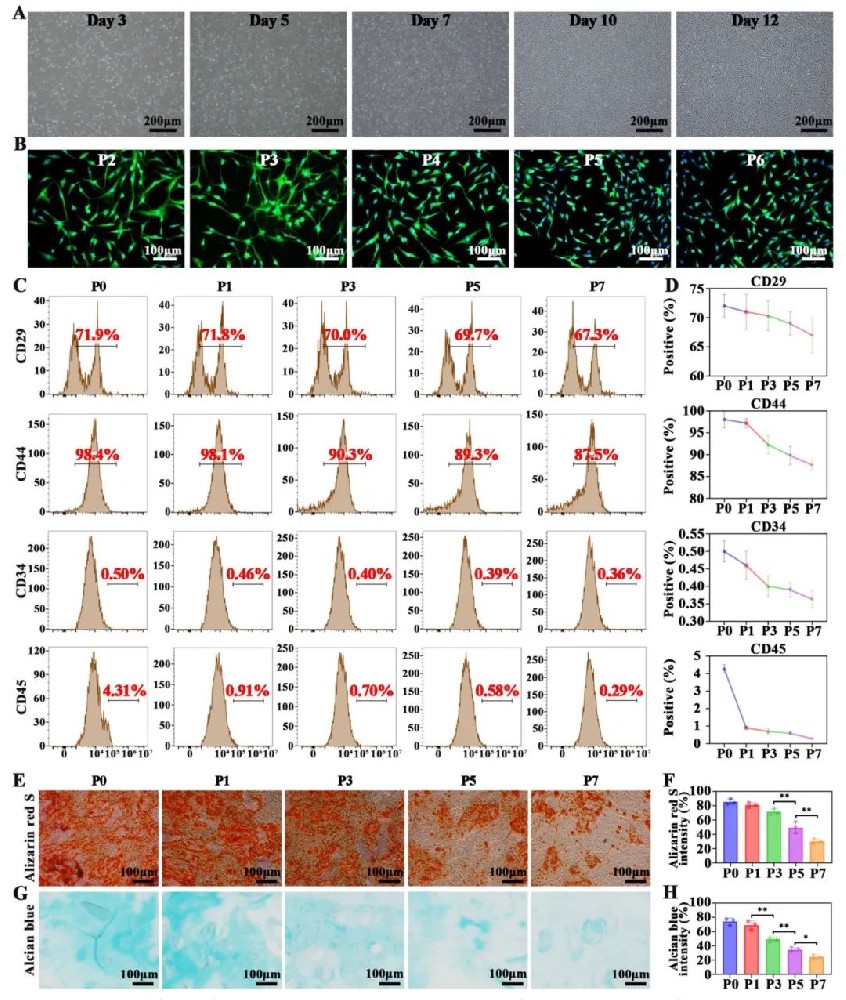
图1 兔源性BMSC的分离与鉴定
2,基于P3 BMSCs的软骨类器官开发。研究使用光刻技术设计了一个圆柱状阵列硅晶片,每个柱体直径200μm,深度150μm,柱间距100μm,并使用该主模制作了3%琼脂糖复制品。每个复制品含约2000个微腔,为BMSC球体培养提供隔离空间。通过在软骨生成培养基中培养,P3 BMSCs在三维文化条件下形成了软骨类器官,直径从第2天的23.38±2.20μm增长到第28天的190.29±29.17μm。相比之下,二维培养的BMSCs虽能增殖但未能形成三维球状聚集体。活/死细胞染色和CCK-8实验证明,三维培养组的细胞存活率和增殖活性显著高于二维培养组。免疫荧光染色显示三维培养组的软骨标记物(聚集蛋白、Sox9和II型胶原)表达显著,而二维培养组几乎无表达。28天后,BMSC衍生的软骨类器官已肉眼可见,呈现为沉积在96孔板底部的球形、不透明、白色聚集体。H&E染色和番红O/快速绿染色结果证实了软骨类器官尺寸随培养时间增加,软骨外基质沉积增强,表明软骨类器官构建成功。
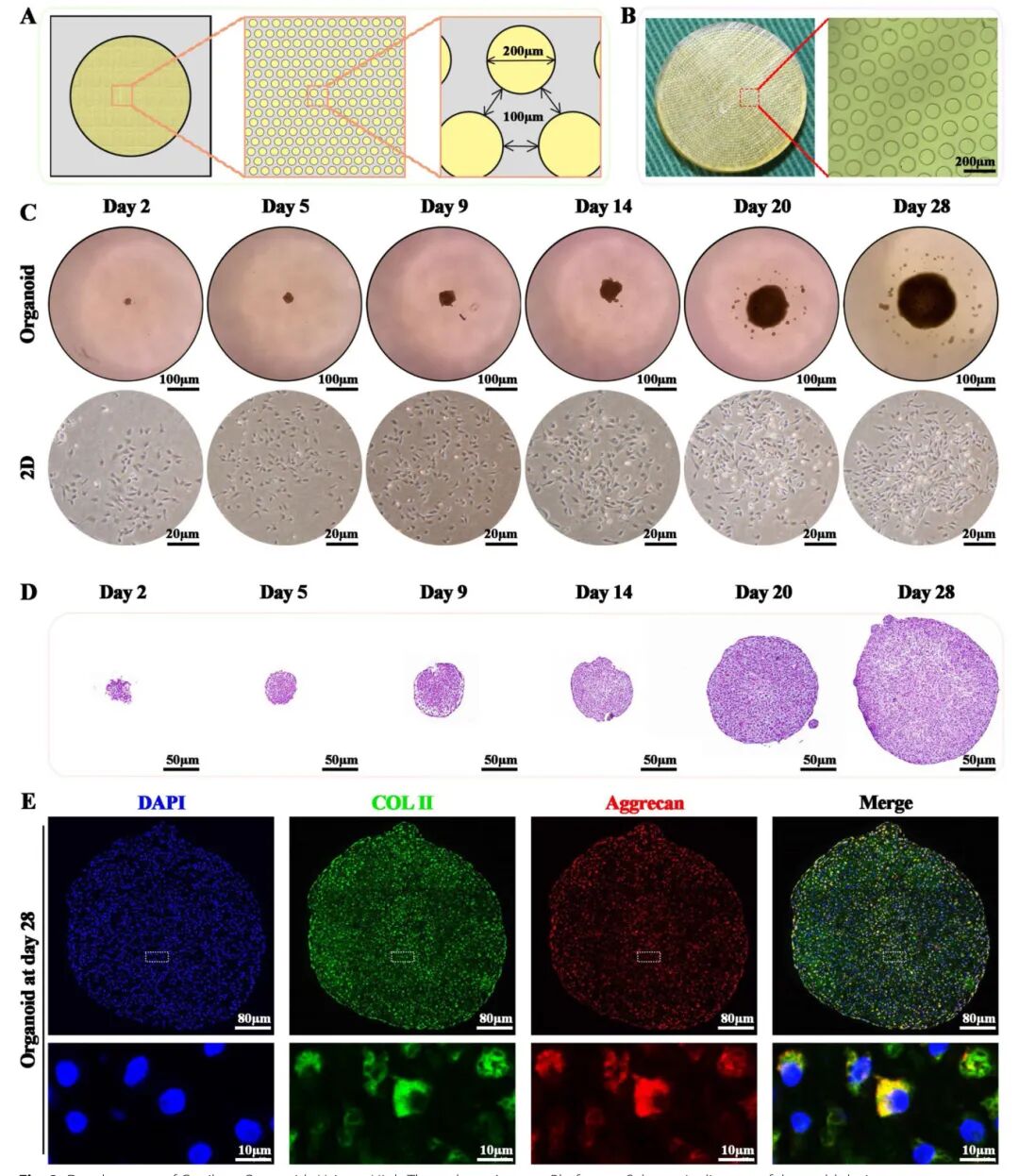
图2 利用高通量琼脂糖平台开发软骨器官
3,软骨类器官在无血管和血管微环境中的体外分化评估。为评估血管微环境如何调节软骨类器官的分化,研究团队使用血管内皮生长因子(VEGF)共培养28天软骨生成培养的软骨类器官。与对照组相比,qPCR数据显示VEGF处理4周后,(+)VEGF组显示软骨相关基因Col2a1和Sox9表达显著下降,而肥大相关基因Col10a1和Mmp13表达显著上升。Western blot和免疫荧光染色进一步证实了这些发现,表明(+)VEGF组的肥大标记物(Mmp13和X型胶原)表达增加,而软骨标记物(II型胶原和GAG)表达降低。考虑到BMSCs在软骨类器官中的肥大分化最终可导致内软骨骨化,这些结果表明软骨类器官具有在VEGF处理下向软骨和骨两个方向分化的潜能。RNA测序进一步证实,(+)VEGF组上调的基因富集于与血管生成、肥大和骨生成相关的过程,而下调的基因与软骨生成相关,表明VEGF通过增强血管生成、肥大和骨生成活动,同时抑制软骨生成,正向调节软骨类器官发育。
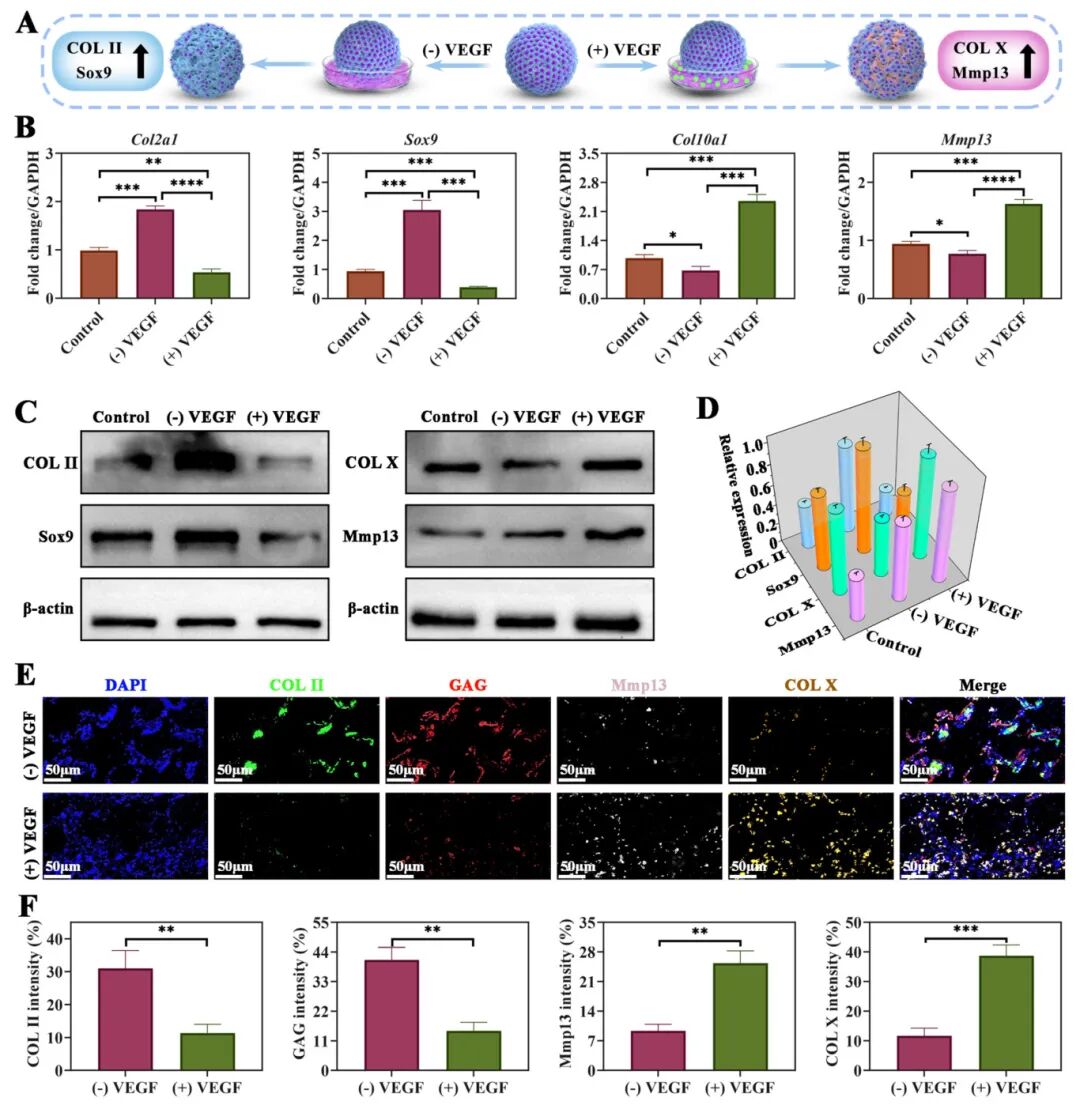
图3 VEGF存在下软骨器官体的体外增生潜力
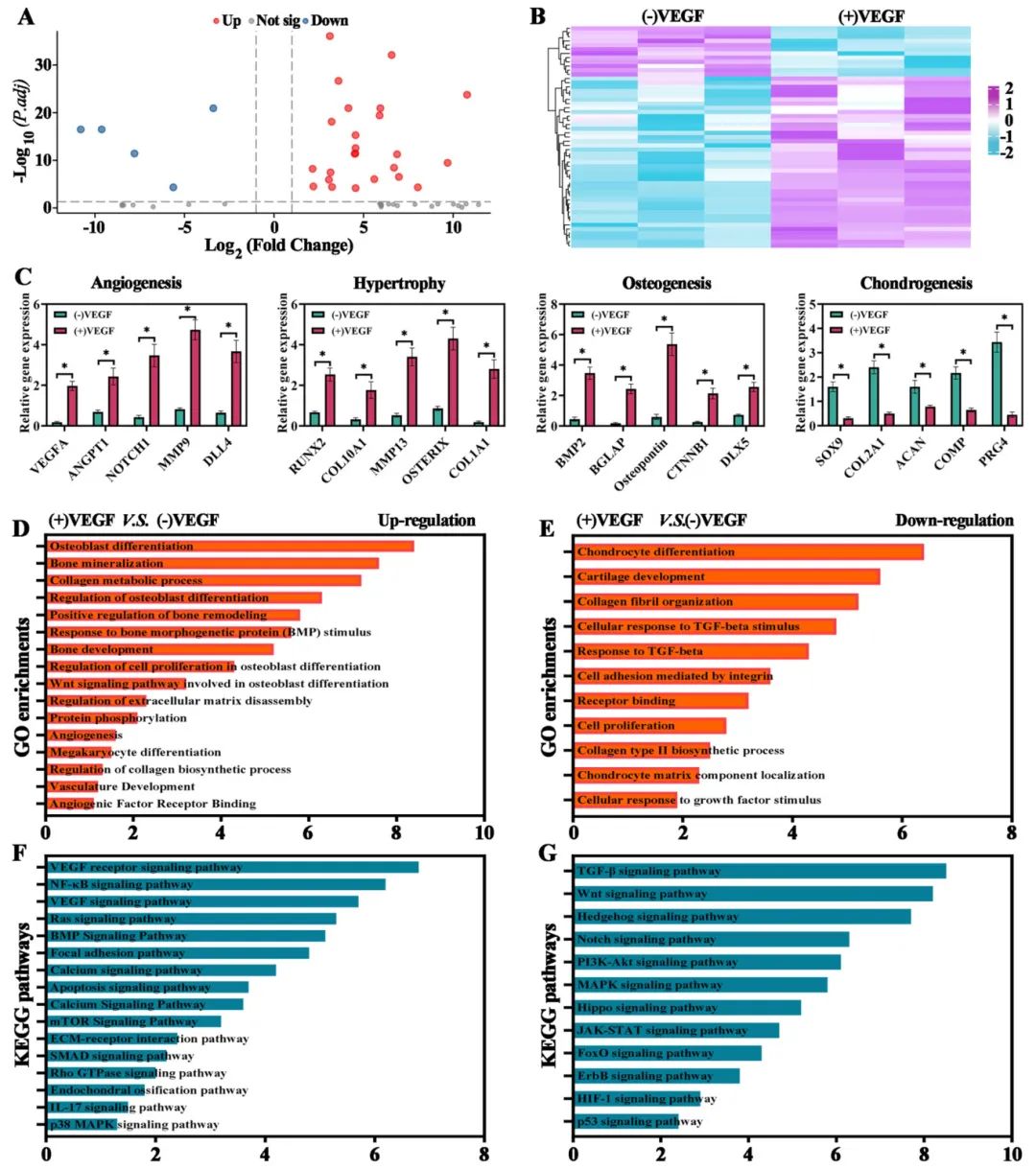
图4 体外存在或不存在VEGF的软骨器官组织全转录组RNA序列分析
4,类器官/GelMA复合物的体内软骨和骨再生活性评估。为验证血管和无血管微环境对软骨类器官分化的调节作用,研究者将双层类器官/GelMA复合物皮下植入裸鼠体内。皮下环境天然富含血管,作为血管微环境,而抗血管生成药物Axitinib用于创建无血管微环境。将小鼠分为三组:(1)(+)Axitinib/(+)Axitinib组(两层均含Axitinib),(2)(-)Axitinib/(-)Axitinib组(两层均不含Axitinib),(3)(+)Axitinib/(-)Axitinib组(仅上层含Axitinib)。植入2周后,H&E和番红O/快速绿染色结果显示,(+)Axitinib/(+)Axitinib组形成均质软骨组织,(-)Axitinib/(-)Axitinib组形成骨组织,而(+)Axitinib/(-)Axitinib组在上层观察到软骨基质分泌,下层形成骨基质沉积。这一模式在4周时更为明显,定量分析显示Axitinib处理组的GAG和II型胶原水平较高,从2周到4周呈增加趋势。微型CT和CD31免疫荧光染色进一步证实,Axitinib荷载层中CD31表达稀疏,而无Axitinib层中CD31表达丰富,表明血管微环境是引导软骨类器官内软骨骨化的关键决定因素。
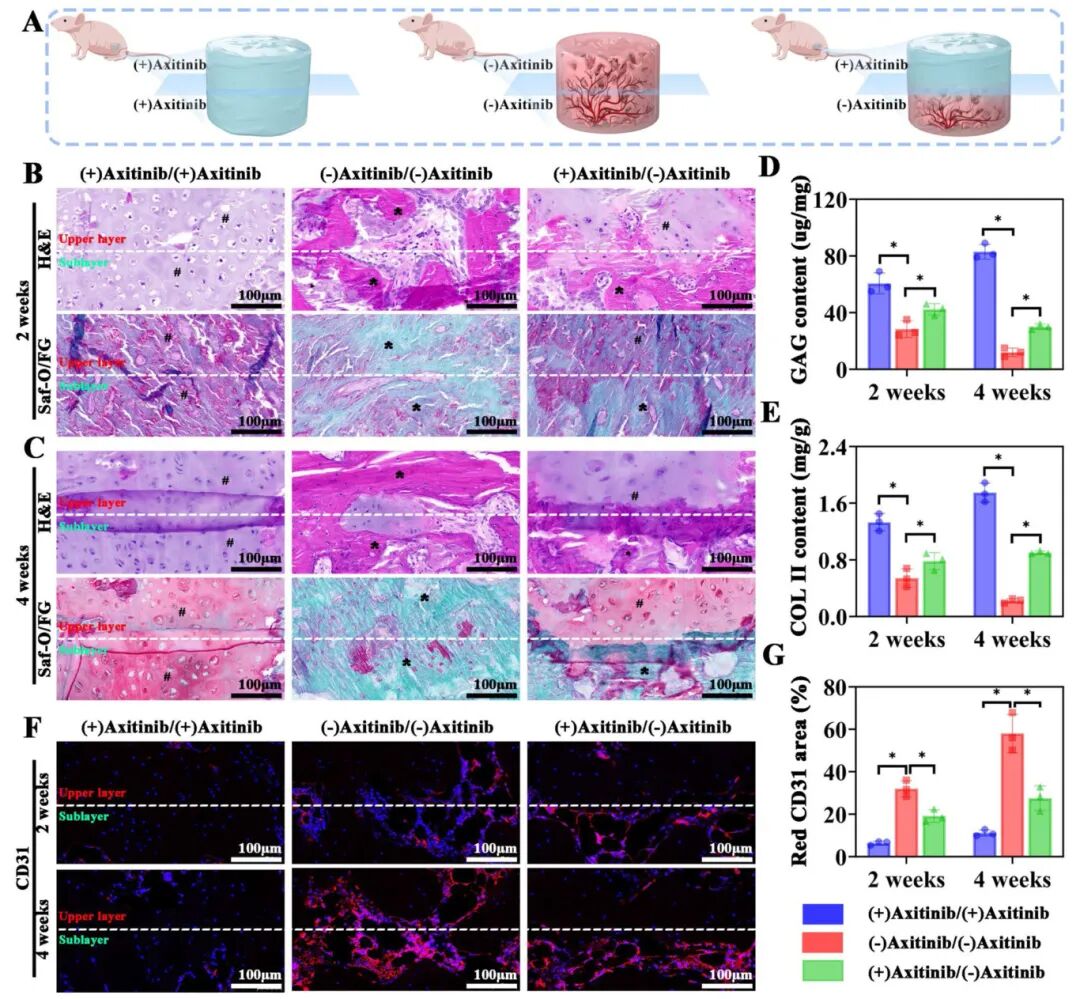
图5 无血管和血管微环境对器官/凝胶MA复合物的体内软骨生成和成骨调节
5,利用类器官/GelMA圆柱体在兔OCD模型中实现梯度异质性骨软骨再生。为促进一体化骨软骨再生,研究团队制备了完整的类器官/GelMA圆柱体用于原位骨软骨植入。在兔膝关节建立OCD模型,分为三组:空白组(对照)、纯GelMA圆柱体植入组和类器官/GelMA圆柱体植入组。术后12周,宏观观察显示空白组组织修复有限,而GelMA和类器官/GelMA组显示改善的组织修复。特别是在类器官/GelMA组,新形成的组织与周围天然软骨无缝结合,非常接近自然状态。三维微型CT成像和二维微型CT图像证实了类器官/GelMA组新形成的骨小梁水平最高,其次是GelMA组,空白组最低。修复关节组织的定量分析表明,类器官/GelMA组获得最高的ICRS组织学评分和骨相关BV/TV及Tb.T水平,证实了该组的优越骨软骨再生能力。H&E染色、番红O/快速绿染色、甲苯胺蓝染色和II型胶原免疫组织化学分析进一步揭示了三组在软骨层、过渡层和软骨下骨层的显著差异。类器官/GelMA组表现出完美整合的软骨和过渡层,以及完整的软骨下骨层,软骨层呈橙红色强染,表明成熟软骨沉积,软骨下骨呈蓝色,表明成熟骨形成。过渡层显示自然梯度,与软骨和软骨下骨层完美整合。生物安全性评估证实类器官/GelMA圆柱体的使用安全,12周后兔主要器官的结构形态正常,血常规、肝功能和肾功能测试无显著系统毒性。
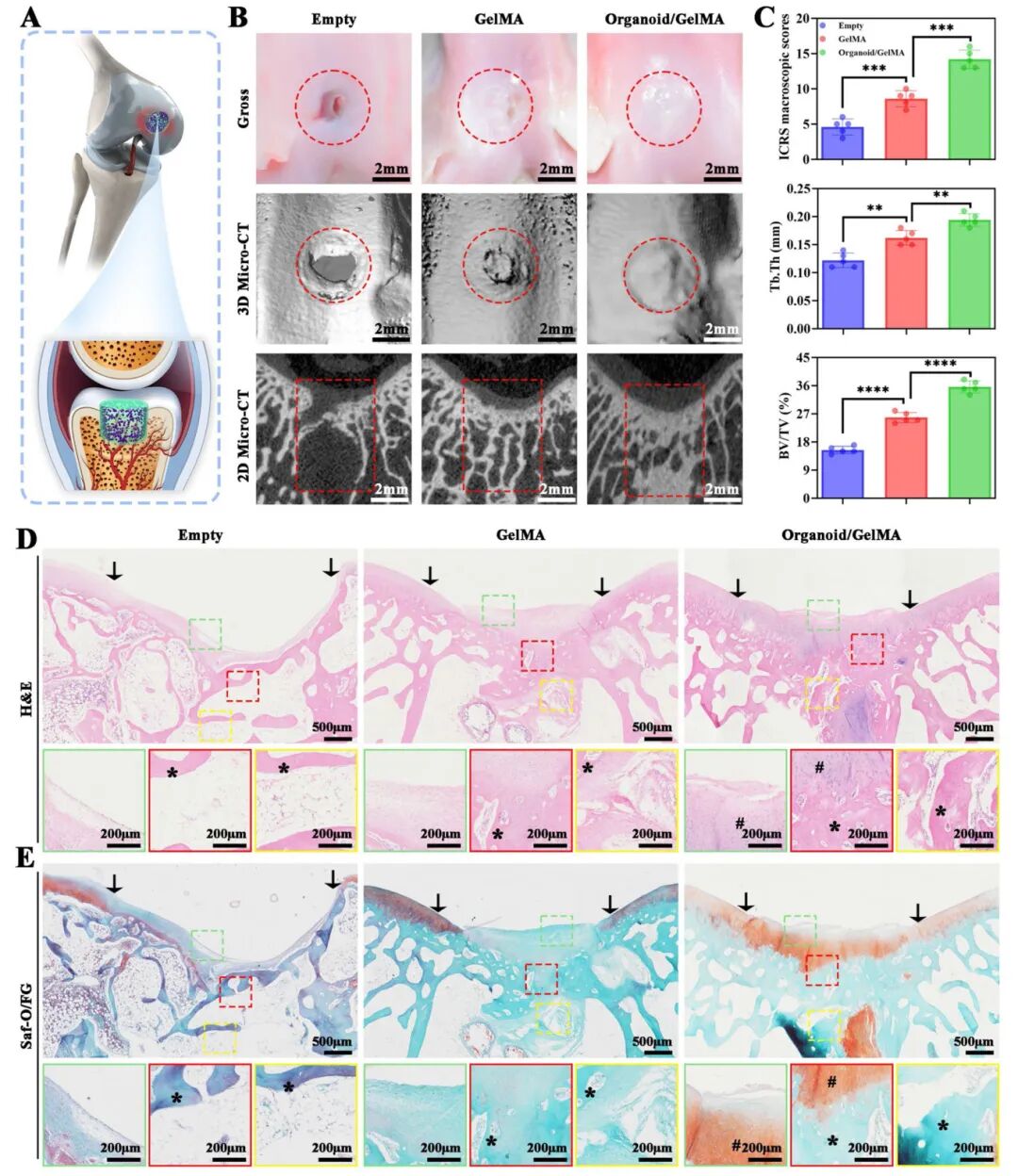
图6 在兔OCD模式下,由梯度血管微环境引导的类器官/凝胶MA圆柱梯度异质性骨软骨再生
本研究成功展示了利用单一骨髓间充质干细胞衍生的软骨类器官实现梯度异质性骨软骨再生的可行性和有效性。通过利用骨软骨组织内天然的血管化梯度,研究团队成功引导了软骨类器官的部位特异性分化,同时实现了软骨和骨的再生。使用前血管和抗血管微环境进一步凸显了血管化在调节骨生成和软骨生成分化过程中的关键作用。类器官/GelMA复合物植入兔骨软骨缺损部位,证实了这一策略的转化潜力,为解决异质性骨软骨修复的挑战提供了一种强大且临床相关的方法。本研究不仅提供了一种新的骨软骨修复策略,而且深入探索了血管微环境在调控干细胞分化中的机制,为今后的再生医学和组织工程领域提供了重要见解和方向。通过利用自然存在的梯度微环境而非人工构建复杂异质性结构的方法,这一研究开辟了一条更简单、更有效的途径,有望改善临床上骨软骨损伤的治疗结果。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:利用人类诱导多能干细胞工程化氧化应激报告器官样体进行毒性测试