常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-10-21 09:10:04 细胞资源库平台 访问量:145
人诱导多能干细胞(hiPSCs)通过重编程人体体细胞产生,类似于人胚胎干细胞(hESCs),具有自我更新和分化为几乎所有人类细胞类型的能力,同时避免了免疫排斥、伦理问题和病原体污染等风险。hiPSCs可以通过形成胚样体(EBs)模拟早期胚胎发育阶段,生成类器官(微型器官样结构)。目前,hiPSCs可诱导分化为多种类器官,包括肝脏、大脑、心脏和肠道,这些类器官在组织学和生理学上都与人体组织和器官高度相似。
然而,获取大规模、可重复且高质量的功能性hiPSC衍生类器官仍是该领域的重大挑战。传统方法包括在超低粘附板中让hiPSCs自我组装,但这导致EBs大小和形态的可变性。均匀的EBs大小和形状对促进hiPSCs的同质和同步体外分化至关重要。另外,"悬滴"方法和AggreWell™板方法可生产高质量的EBs,但当需要大量EBs时,这些方法可能耗时且劳动密集。
目前所用的水凝胶材料,如藻酸盐和羟丙基壳聚糖,已导致hiPSCs存活率低和EBs生成无法控制。虽然电喷雾和微流控技术展示了高通量生产微珠和微胶囊的潜力,但电喷雾方法面临系统稳定性差、细胞球体大小不均匀和水凝胶材料选择有限的挑战。因此,开发一种适合微流控制造并适合hiPSCs培养和分化的生物相容性材料至关重要。
近期,清华大学深圳研究院徐弢/陈建伟发布在Lab on a Chip期刊,题为A high-throughput microfluidic platform for functional hiPSC-derived liver organoids with bile duct- and lobule-like structures的研究介绍了一种高通量制造平台,用于hiPSC衍生的类器官,具有生成功能性类器官以供治疗应用和药物筛选的潜力。
1,HCSM的制备与表征。研究团队开发了一种新型微流控平台,用于高通量制造HAMA核壳微球(HCSM),实现hiPSCs的包封和分化。平台采用HAMA、鱼明胶和玉米油分别作为壳层、核心和连续相材料。通过调节核心、壳层和油流的流速,研究人员成功制造了具有均匀且可控大小的HCSM。在固定油流速率下,随着核心和壳层流速的增加,HCSM的外径从443.4±8.3扩大到534.4±8.2μm,内径从308.6±9.9增加到425.0±9.9μm。当核心和壳层流速保持恒定时,随着油流速的增加,HCSM的直径减小。此外,随着HAMA溶液浓度的增加(从4%到10%),微球直径逐渐减小。采用荧光聚苯乙烯纳米颗粒标记显示,HCSM具有明确的核壳结构。
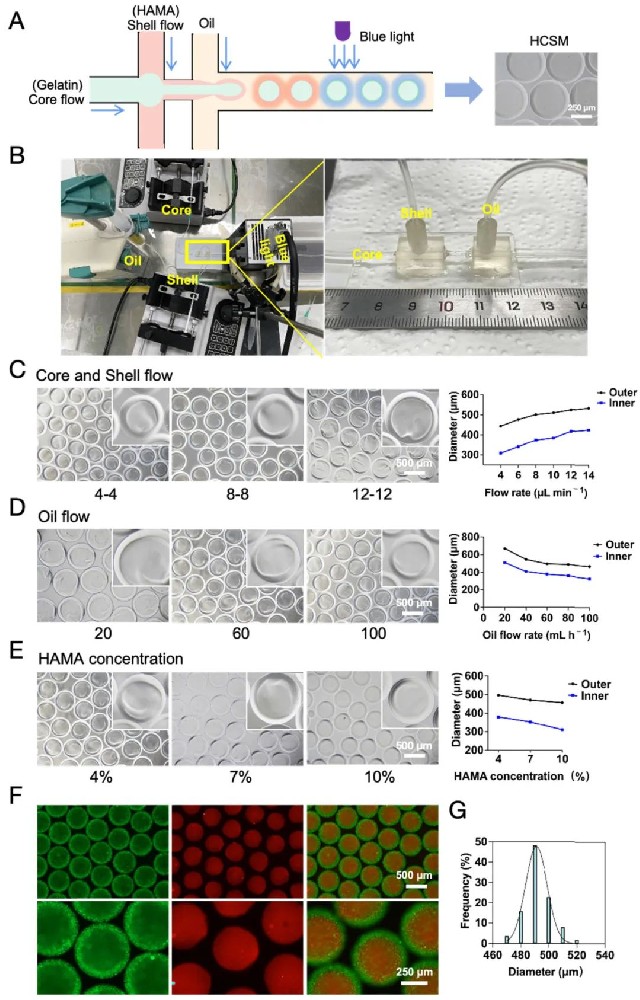
图1 HCSM的制备
2,hiPSCs在HCSM中的生物打印与活性。研究通过微流控生物打印平台将hiPSCs包封在HCSM中。实验设置涉及将不同浓度的hiPSCs与鱼明胶作为核心流,而4% HAMA溶液作为壳层流。在无明胶的情况下,生成的HCSM大小不均匀,约7.1%不含hiPSCs;而当引入3%和6%明胶浓度时,载有hiPSCs的HCSM表现出均匀大小和一致的细胞分布,包封率达100%。比较生物打印前后的单个hiPSCs存活率显示,细胞保持高存活率(~98.4%),表明HCSM打印平台对细胞损伤最小。生物打印后4小时,单个hiPSCs开始自组装成细胞球体,到第4天时,这些细胞增殖并完全占据了微球的核心部分。
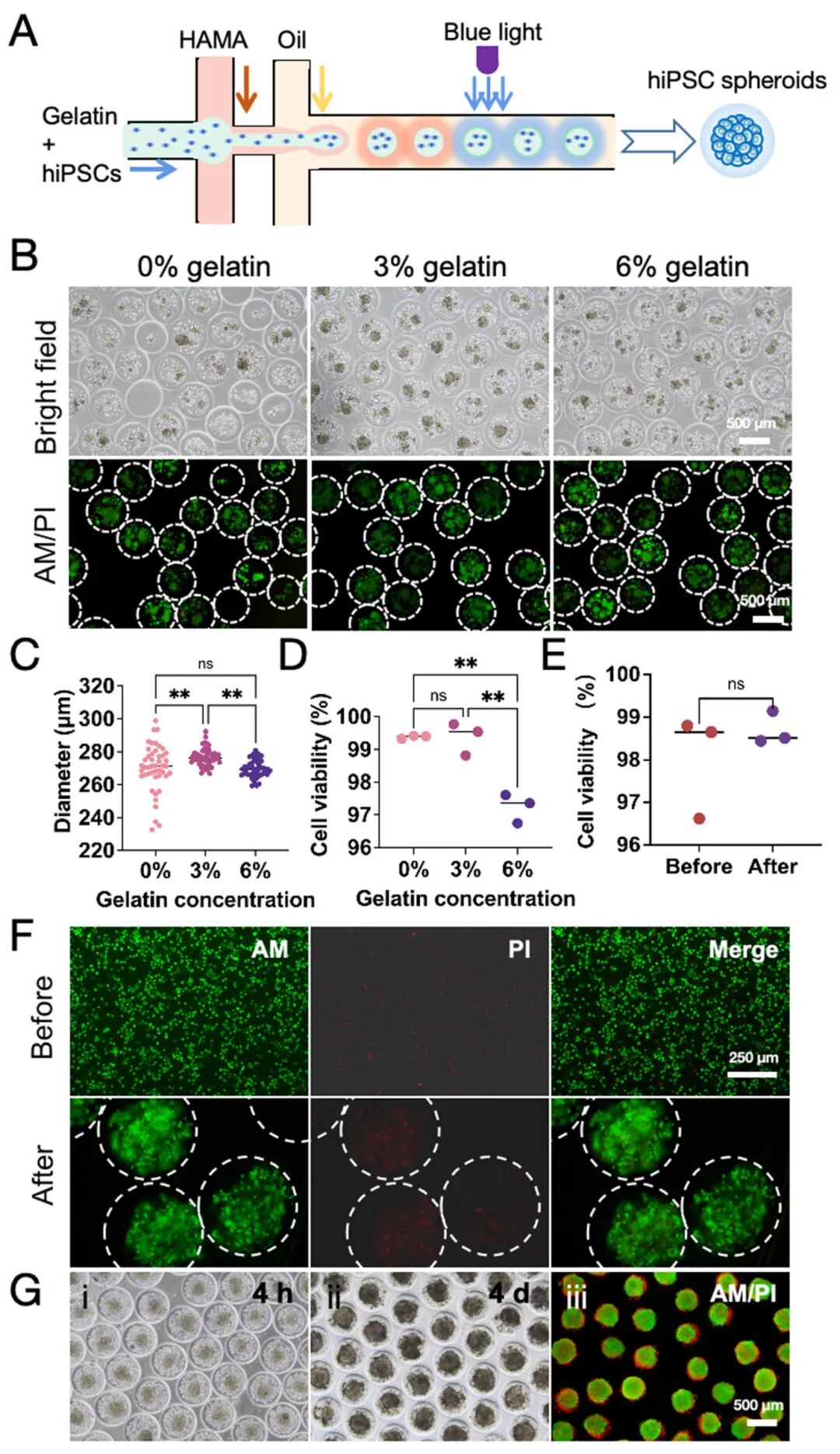
图2 HCSM中高活力的生物打印hiPSCs
3,hiPSCs包封与胚样体(EBs)形成。通过将不同浓度的hiPSC悬液(最终浓度为0.5×10^7和5×10^7细胞/mL)与6%鱼明胶以1:1体积比混合制备HCSM。生物打印后24小时内,hiPSCs在HCSM中形成一个或多个细胞球体,细胞浓度越高,球体直径越大。为促进适当的气体和营养交换,将球体进一步培养在适配到12孔板的3D生物反应器中,实现悬浮培养。相比静态培养,悬浮培养中的hiPSCs形成紧凑的EBs,具有一致的大小、明确的边缘且无散布的死细胞,并且表现出更高程度的腔隙生成。实时PCR分析显示,2D培养的hiPSCs与HCSM中包封的hiPSCs在干细胞多能性基因(NANOG、OCT4和SOX2)表达上无显著差异。免疫荧光染色也证实了HCSM中包封的hiPSC球体保持高水平的干细胞多能性蛋白表达。
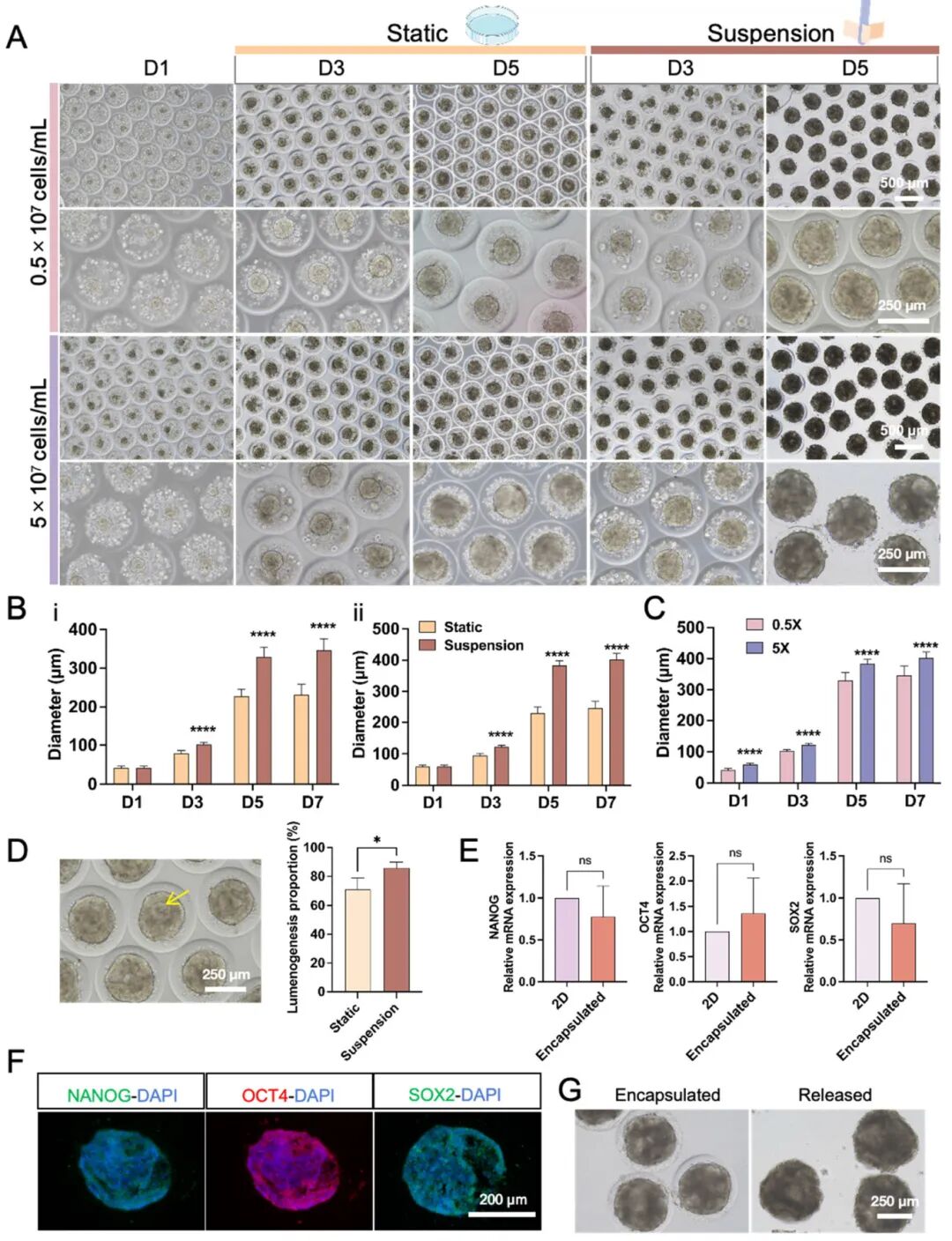
图3 HCSM中HiPSC衍生的EBs形成
4,三胚层类器官分化。为探索HCSM中EBs的三胚层分化潜力,研究人员生成了脑类器官(外胚层)、心脏类器官(中胚层)和肝脏类器官(内胚层)。脑类器官分化过程中,随着分化的进展,脑类器官的大小和形态发生演变,形成形态一致的脑类器官。心脏类器官通过三步过程分化,包括中胚层分化、心肌诱导分化以及心肌成熟和维持培养。分化第8天开始观察到规律跳动的心脏类器官,并持续跳动至少20天。肝脏类器官采用改良的三步分化方案:首先,HCSM中的EBs用activin-A处理5天;随后,在bFGF和HGF存在下,内胚层球体分化为肝细胞;最后,将OSM和地塞米松引入培养基以进一步促进肝细胞的分化和成熟。这些肝脏类器官能在体外维持长达1个月,同时保持适当的形态。
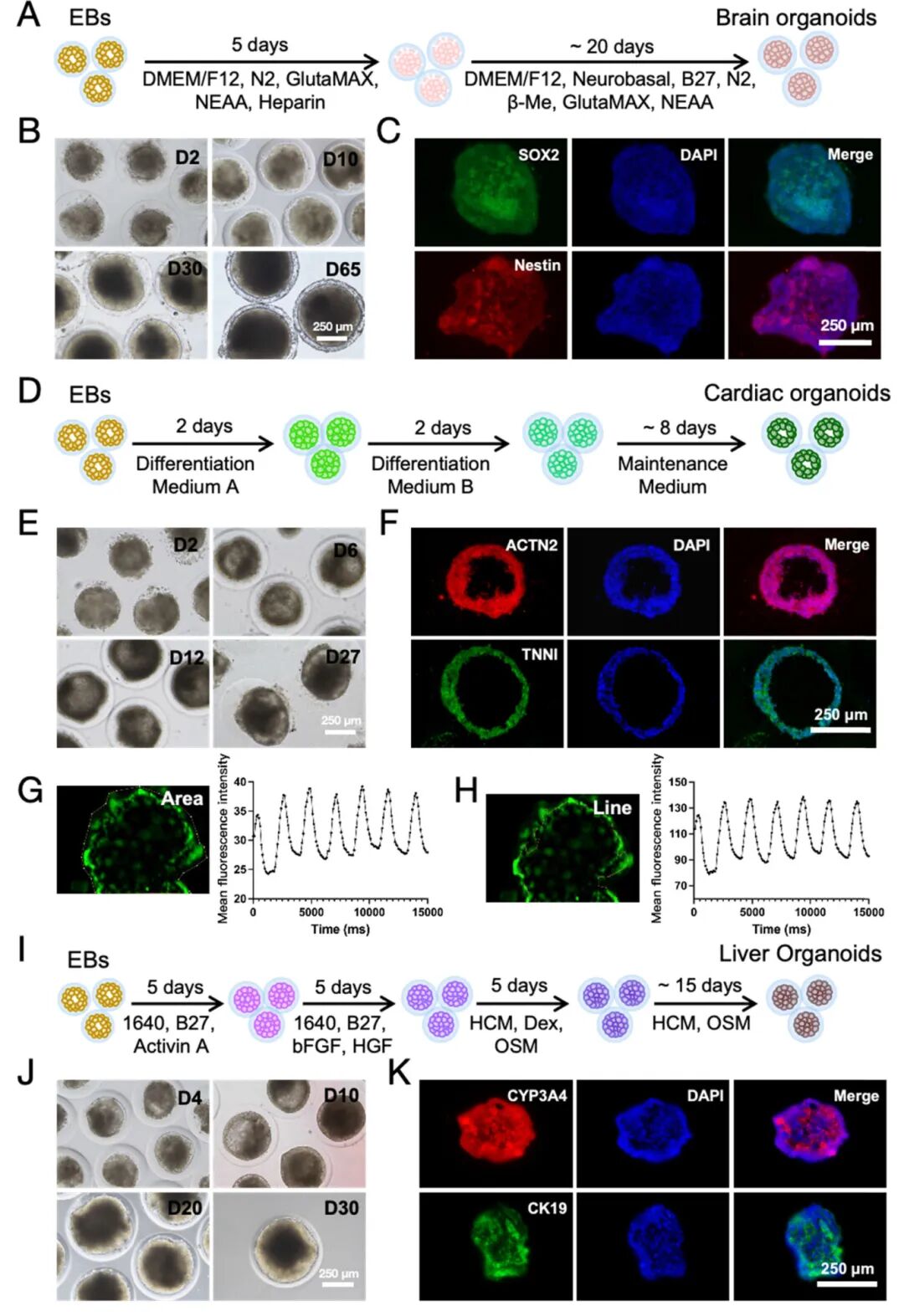
图4 HCSM中从EBs分化出的三层器官
5,肝脏类器官的表征。研究调查了分化过程中肝脏类器官的基因和蛋白表达。RT-PCR结果显示NANOG表达下降,SOX17表达在D10达峰值,AFP表达在D20达峰值。对肝脏发育至关重要的白蛋白表达从D20到D30逐渐增加。此外,CK19和CYP3A4表达水平从D10到D30稳步上升。D25的免疫荧光染色证实了蛋白分布,白蛋白存在于整个类器官中,观察到肝小叶样结构。CK19蛋白在肝脏类器官中呈管状分布,表明胆管样结构的发展。还观察到上皮细胞表面标记物E-cadherin和间充质星状细胞标记物VIM在肝脏类器官中的存在和排列。这些发现表明hiPSCs能在HCSM中直接分化为肝脏类器官,创建一个包含肝细胞样、胆管上皮样、上皮样和星状细胞样细胞的多细胞微环境,以及明显的胆管和肝小叶样结构。
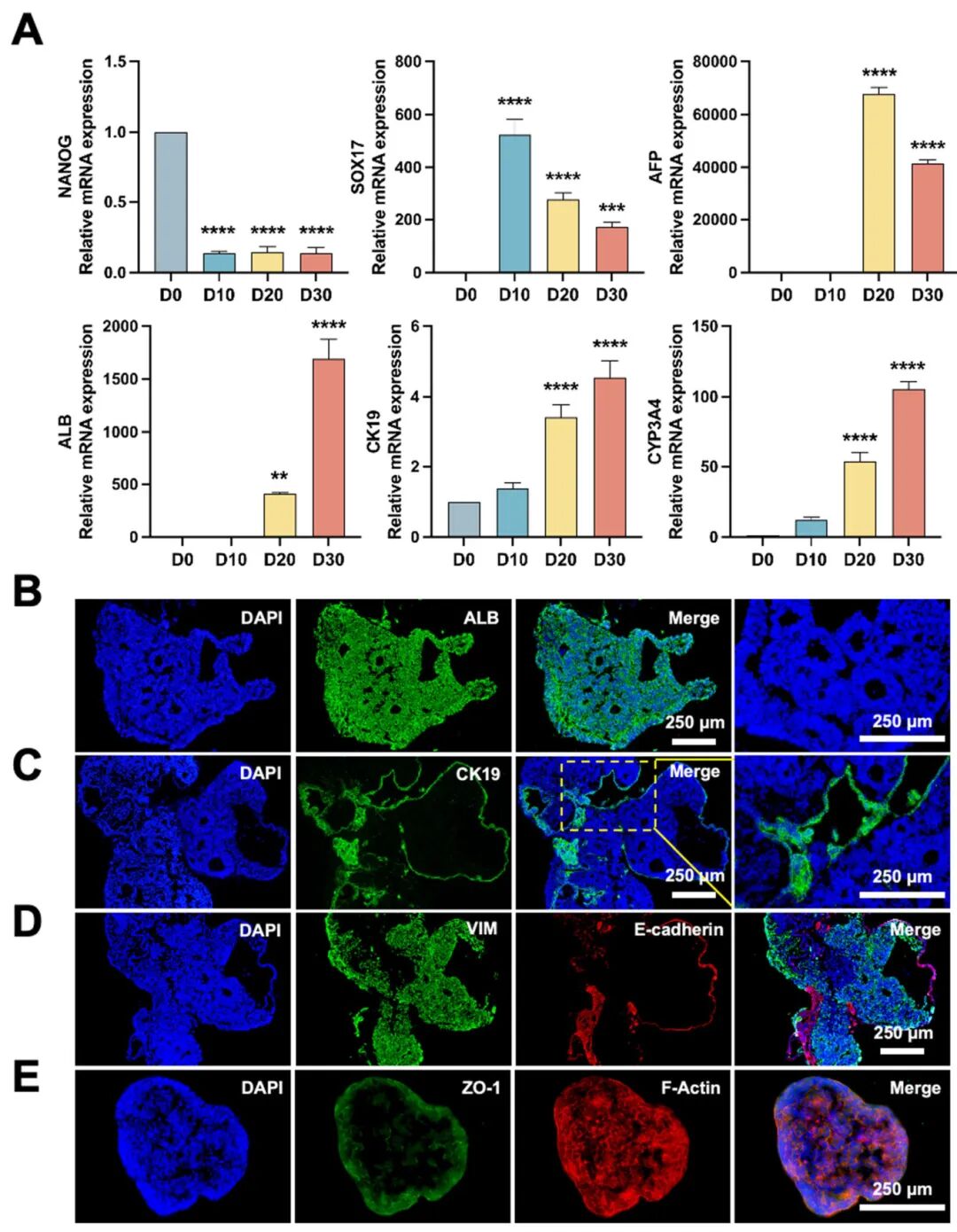
图5 HCSM中肝类器官的表征
6,肝脏类器官的功能鉴定。D30的肝脏类器官在油红O和PAS染色中均呈阳性,证实了脂滴和糖原的存在。ICG处理显示肝脏类器官能够摄取和释放ICG。悬浮培养的肝脏类器官在D25和D30表现出显著高于静态培养的白蛋白分泌。尿素产生在D20达高峰,悬浮培养在D25和D30显示更高的尿素合成。此外,用不同浓度的APAP(0、20、40和80mM)处理24小时的肝脏类器官显示细胞活力随APAP浓度增加而剂量依赖性下降。利福平诱导的CYP3A4酶活性在静态和悬浮培养中分别增加了5.2倍和20.3倍,悬浮培养显示比静态培养高4.2倍的酶活性。CYP3A4基因表达在静态和悬浮培养中分别增加了2.0倍和11.6倍,CYP2C9基因表达分别增加了3.1倍和8.9倍。这些发现表明,来自核壳微球的肝脏类器官具有肝脏药物代谢相关功能,使其成为药物筛选和开发的有希望候选物。
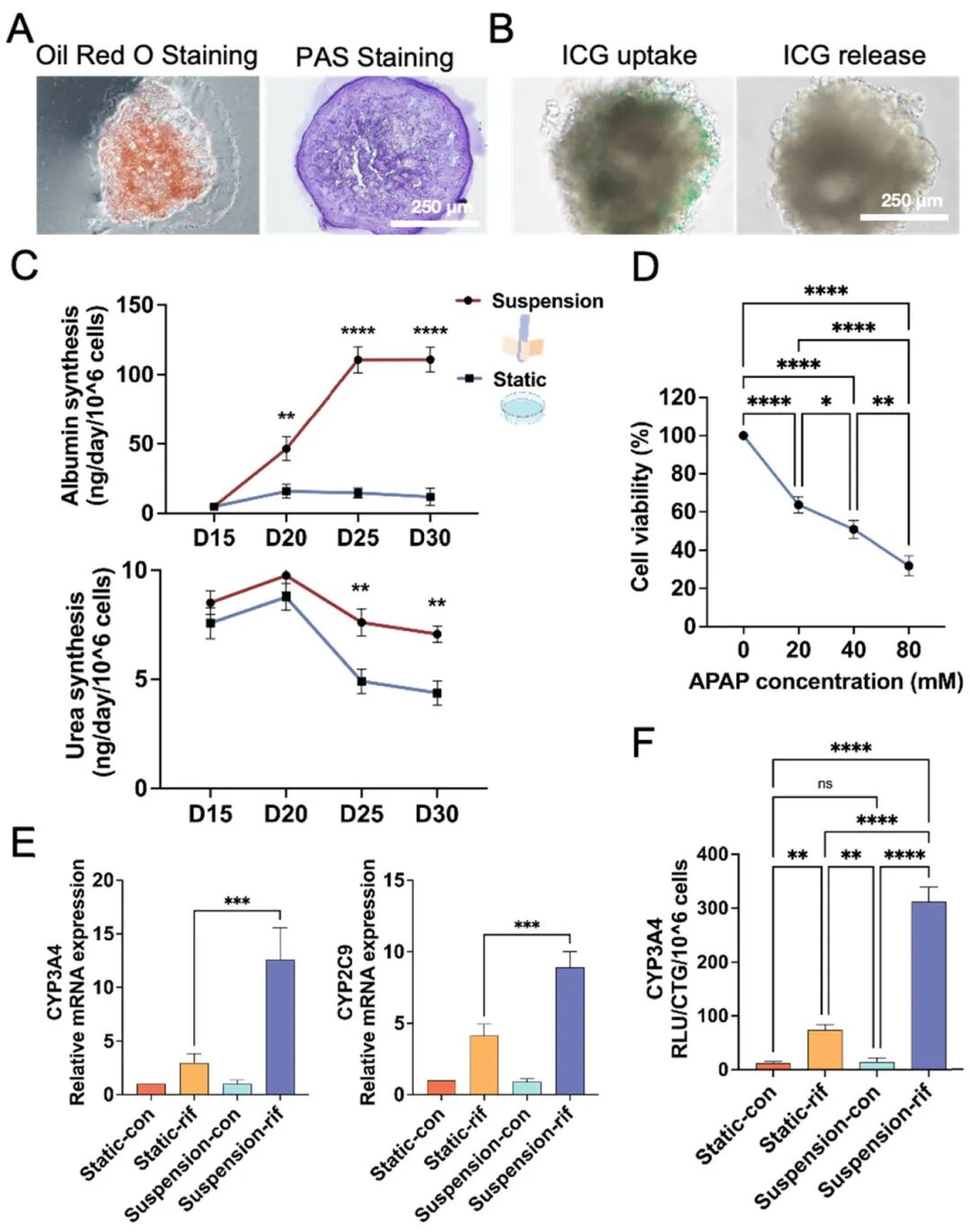
图6 肝类器官的功能鉴定
本研究介绍了一种创新的微流控平台,用于高通量生产HAMA核壳微球(HCSM),实现了hiPSCs的均匀包封和分化。该平台优势在于能够以高通量方式生产尺寸均匀且可控的微球,为大规模生产功能性hiPSC衍生类器官提供了可能。研究团队成功地在HCSM中诱导hiPSCs分化为代表三个胚层的类器官(脑、心脏和肝脏),并详细表征了肝脏类器官的结构和功能特性。所产生的肝脏类器官展示了肝样小叶和胆管样结构,并表现出多种肝脏特定功能,包括脂滴和糖原累积、ICG摄取和释放、白蛋白和尿素分泌以及对APAP和利福平的代谢反应。该研究的重要贡献在于开发了一种能够在一个流程中高通量生产均匀、可控大小的HCSM的平台,使hiPSC衍生的EBs和三胚层类器官的生成变得简化和标准化。这一技术进步对再生医学、药物筛选和疾病建模具有显著意义,为开发更复杂且功能性更强的人体组织模型提供了基础,有潜力支持个体化医疗和药物开发。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:利用类器官定义肠道细菌致病机制:柠檬酸杆菌使用非典型黏蛋白水解酶EspC穿透小鼠结肠黏液
下一篇:利用人类诱导多能干细胞工程化氧化应激报告器官样体进行毒性测试