常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-10-20 17:12:57 细胞资源库平台 访问量:170
肠道细菌病原体对人类健康构成重大威胁,然而它们如何在面对宿主强大防御机制的情况下感染哺乳动物肠道的机制尚未被完全阐明。对于附着和剥离(A/E)细菌家族成员和小鼠病原体柠檬酸杆菌(Citrobacter rodentium),其毒力策略似乎涉及穿透结肠黏液屏障以到达下方的上皮细胞。
长期以来,在体外创建相关的黏液屏障一直是一个挑战,因为很少有肠上皮细胞系产生Muc2。然而,最近从3D肠道类器官衍生的2D单层模型被用于研究微生物-黏液相互作用。通过在分化培养基存在下培养融合的类器官单层,可以诱导黏液层形成。另一种产生黏液的方法是通过气-液界面(ALI)培养,其中单层的顶端暴露于空气,而基底端保持浸没在生长培养基中。这种方法促进了肠上皮细胞内的氧化磷酸化,导致细胞分化增加、杯状细胞形成和Muc2分泌,以及上层黏液层的形成。
肠杆菌科菌属的丝氨酸蛋白酶自转运蛋白(SPATEs)是许多肠道细菌病原体分泌的毒力蛋白超家族。SPATEs基于其结构和功能特性分为两类:第I类SPATEs,包括EspC、Pet、Sat和SigA,对肠上皮细胞表现出肠毒素和细胞毒素活性;第II类SPATEs,如Pic、Hbp和EatA,具有O-糖蛋白酶活性,通常参与黏膜定植。C. rodentium携带至少三种SPATEs,即EspC、Pic和AdcA(第II类),尽管在体外培养中只能检测到EspC和Pic。
为了更好地定义这些相互作用,研究者利用气-液界面(ALI)条件培养结肠类器官,产生了一个厚黏液层,模拟了体内黏液的成分和糖基化状态。相关结果以题Defining enteric bacterial pathogenesis using organoids: Citrobacter rodentium uses EspC, an atypical mucinolytic protease, to penetrate mouse colonic mucus发布在Gut Microbes期刊。研究结果揭示了ALIderived粘液在肠道粘膜表面模拟微生物-宿主相互作用的效用,并确定EspC是一种非典型的I类SPATE,对ALIderived粘液具有显著的粘蛋白溶解活性。
1,ALI培养的结肠类器官产生生理相关的黏液层。研究团队从Muc2+/+小鼠结肠生长3D结肠类器官,在transwell上培养2D单层,然后移除顶部培养基,在ALI条件下维持1-3周。ALI培养21天后,免疫染色显示形成了厚度为140±25μm的黏液层,而从Muc2-/-小鼠生长的ALI单层没有检测到Muc2阳性染色或黏液层。对21天ALI培养收集的黏液进行蛋白质组学分析显示,总凝胶形成黏蛋白中87.8%为Muc2,剩余的是Muc5b(11.2%)和Muc5ac(1%),这些在体内结肠黏液中也存在。此外,在ALI衍生黏液中鉴定出先前从小鼠结肠黏液中恢复的多种蛋白质,包括IgG结合蛋白Fc片段(Fcgbp)、激肽释放酶-1(Klk1)等杯状细胞产生的蛋白质,以及各种抗菌肽。糖基化分析发现三种主要类型的糖基,包括唾液酸化(9.7%)、硫酸化(25.6%)和中性(64.7%)糖基,与直接从小鼠结肠分离的黏液中鉴定的相似。这些数据证明了ALI结肠类器官单层产生的黏液层在组成上与体内结肠黏液高度相似。
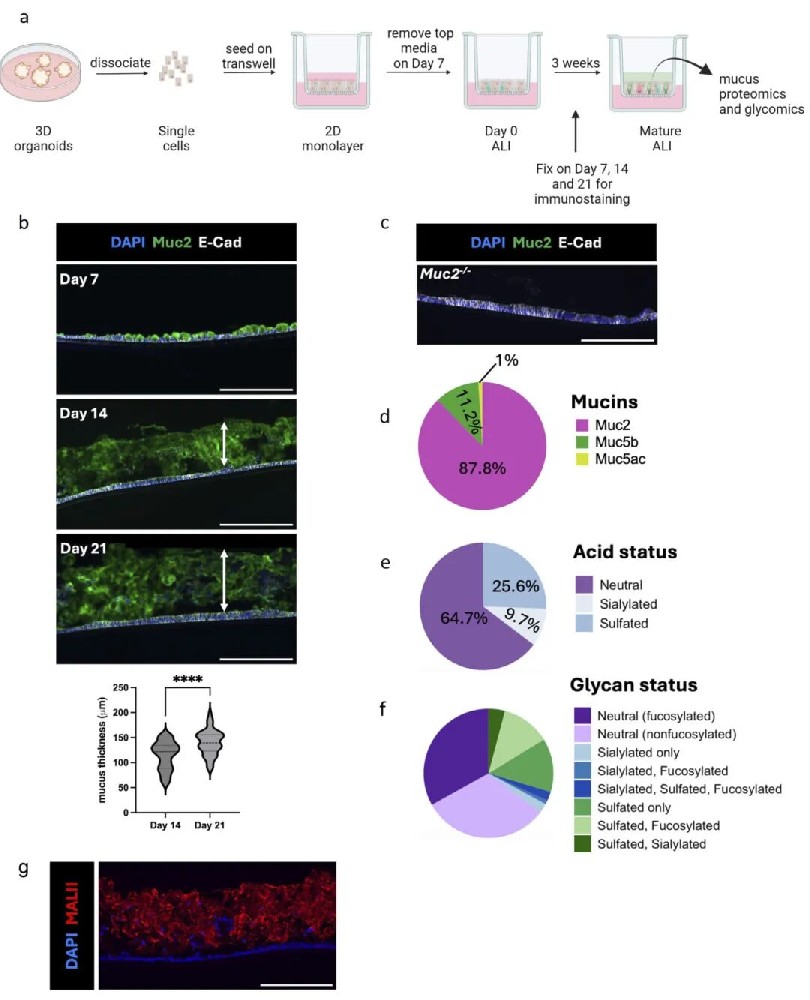
图1 ALI模型产生生理相关的粘液层
2,ALI衍生黏液保护下层肠上皮细胞免受C. rodentium感染。为了测试C. rodentium感染ALI单层的能力,研究者将野生型C. rodentium加入到Muc2+/+和Muc2-/-小鼠衍生的ALI单层。在感染6小时后,大部分C. rodentium仍留在Muc2+/+ ALI单层黏液表面,只有少量细菌可在黏液层内检测到。而当感染Muc2-/- ALI单层(缺乏黏液层)时,大多数C. rodentium在6小时内就接近肠上皮细胞,伴随广泛的上皮损伤和脱落。这些发现表明ALI单层,而非浸没单层,产生黏液保护下层肠上皮细胞免受C. rodentium感染。
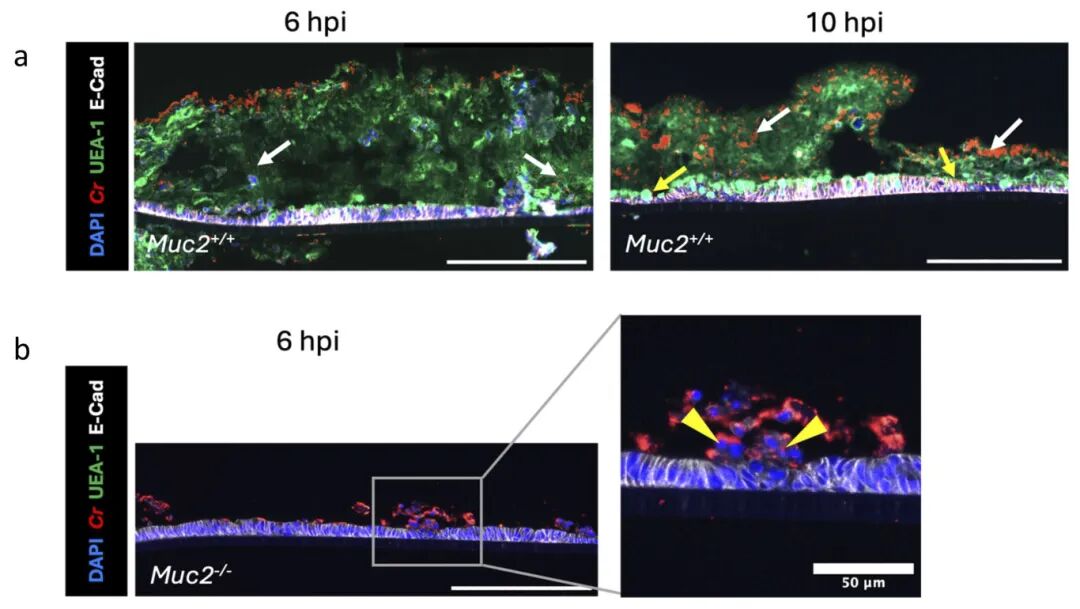
图2 ALI模型能够重现病原体-粘液在体内的相互作用
3,唾液酸暴露加速C. rodentium感染ALI结肠类器官单层。研究者之前确定,暴露于单糖唾液酸可增强C. rodentium降解牛颌下腺黏蛋白(BSM)的能力,并增强其对肠上皮细胞的粘附。测试唾液酸是否也能使C. rodentium更有效地降解ALI衍生黏液,结果显示,在唾液酸条件下预培养的C. rodentium上清液诱导更大程度的黏液降解,相比于葡萄糖条件下预培养的C. rodentium。此外,唾液酸预处理的C. rodentium几乎完全降解了黏液层,并大量粘附于上皮细胞,伴随广泛的细胞脱落。这些结果表明,唾液酸促进C. rodentium介导的ALI衍生黏液降解和对下层肠上皮细胞的感染。
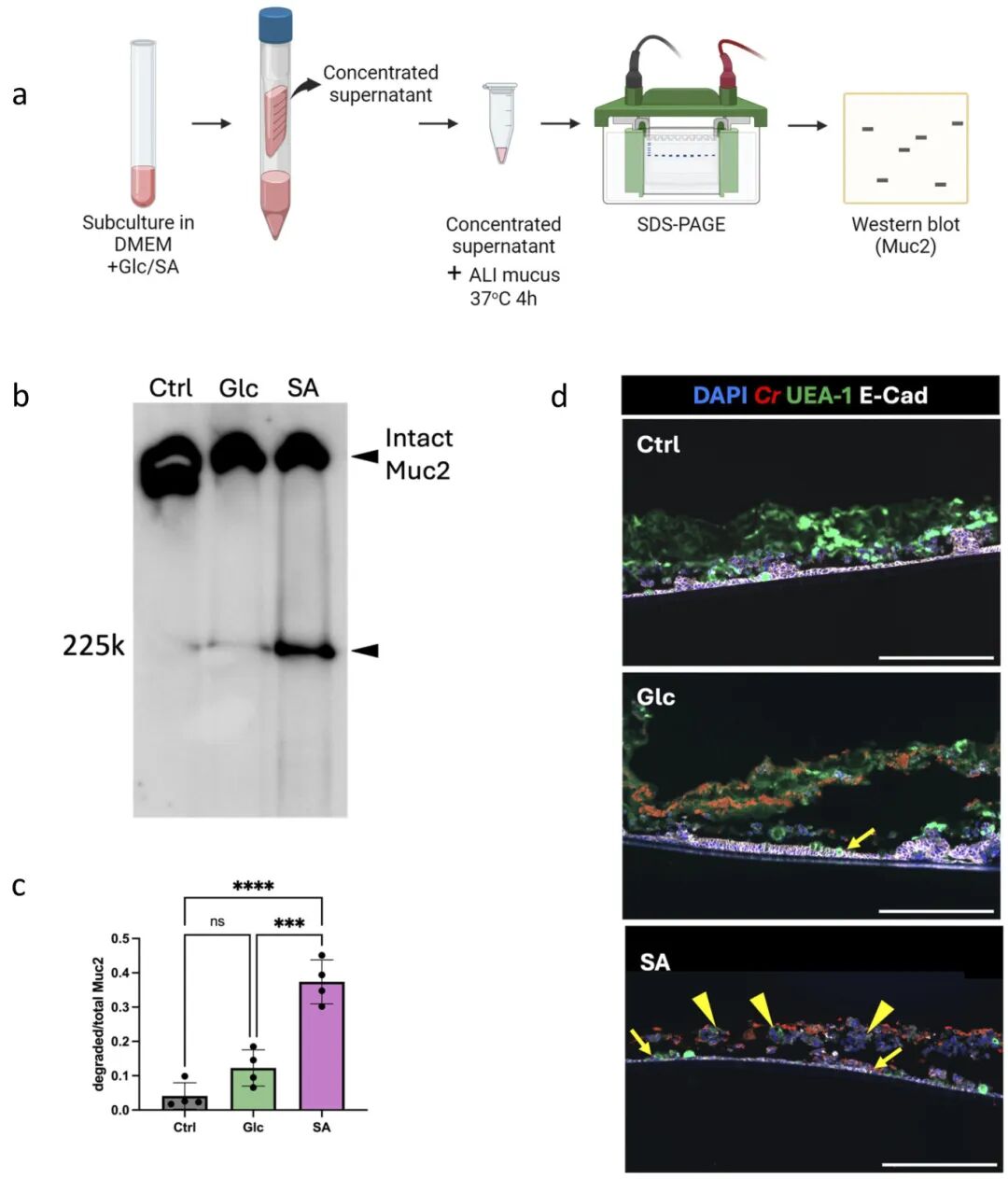
图3 唾液酸增强了啮齿动物C.rodentium降解ali衍生粘液和感染IECs的能力
4,C. rodentium降解ALI衍生黏液的能力依赖于EspC。研究者发现,尽管Pic作为第II类SPATE已被认识为黏蛋白酶,但在降解ALI衍生黏液方面,EspC(第I类SPATE家族成员)发挥更重要作用,这出人意料,因为第I类SPATEs此前未被证明具有黏蛋白酶活性。感染实验显示,Δpic菌株与野生型C. rodentium表现相似,几乎完全丧失ALI衍生黏液层,而ΔespC和ΔpicΔespC双突变(ΔΔ)菌株仍留在黏液表面,很少穿透黏液或造成ALI单层损伤。蛋白质降解试验也证实,与WT和Δpic相比,ΔespC和ΔΔ感染样品中的完整Muc2条带更强,降解Muc2条带更弱或不存在。
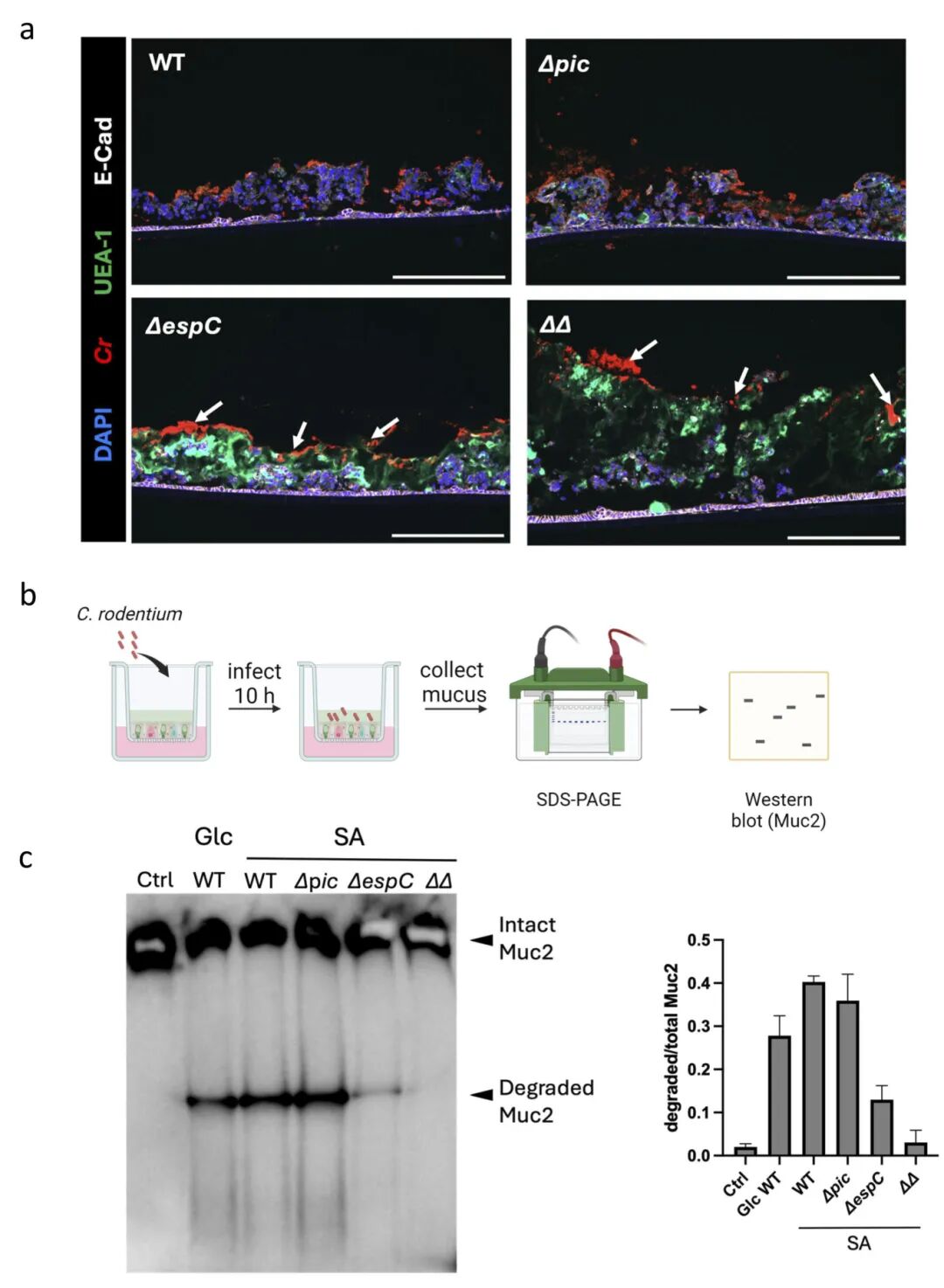
图4 WT、Δpic、ΔespC和ΔpicΔespC C.rodentum菌株感染小鼠ALI培养物和降解ALI衍生粘液的能力比较
5,在E. coli DH5α中表达的EspC降解ALI衍生黏液。为进一步探索EspC和Pic降解ALI衍生黏液的不同能力,研究者将C. rodentium espC(CrespC)和pic(Crpic)基因克隆到pBAD30载体中,转化到E. coli DH5α(无已知黏蛋白酶活性的菌株)。结果显示,含有WT CrespC质粒的E. coli DH5α上清液能显著降解Muc2,而CrespC-S251I点突变体上清液失去了降解能力,表明GDSGS结构域对EspC的黏蛋白水解活性是必需的。此外,含有EPEC espC质粒的E. coli DH5α上清液也表现出对ALI衍生黏液的黏蛋白水解活性,尽管强度不及CrespC。
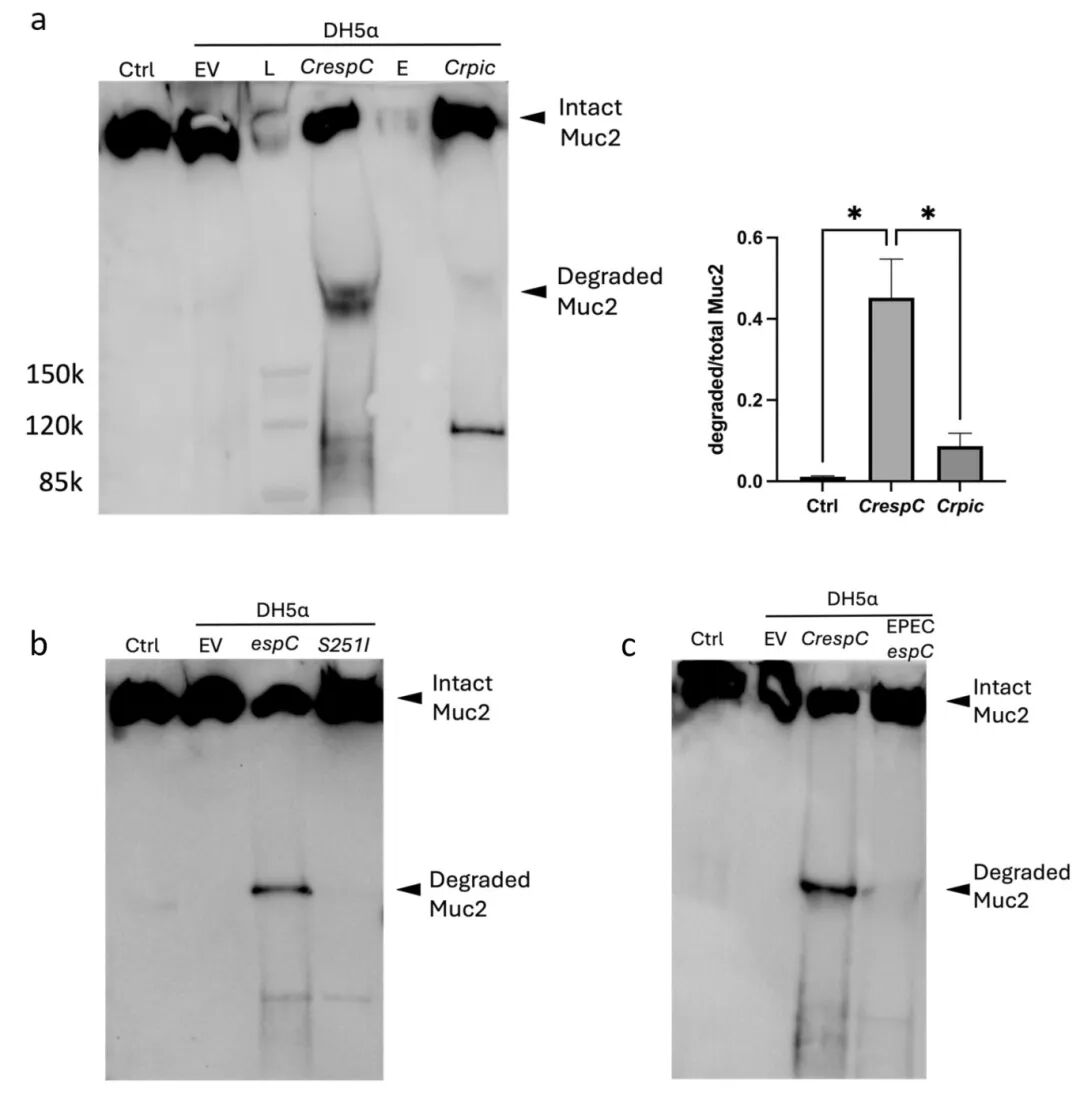
图5 使用表达大肠杆菌DH5α的SPATEs分泌的蛋白质进行粘液降解试验
6,重组CrEspC单独足以降解ALI衍生黏液。为证实C. rodentium EspC能否独立于任何其他细菌产物降解黏液,研究者使用E. coli BL21表达纯化的重组CrEspC蛋白。0.05μg重组CrEspC与小鼠ALI衍生黏液孵育2小时即可诱导Muc2降解,孵育时间越长(8小时和24小时),降解越明显。此外,当同量黏液与递增量的重组CrEspC(0.0025、0.0125、0.05μg)孵育2小时时,观察到Muc2降解呈剂量依赖性增加。这些发现表明,重组CrEspC单独足以降解小鼠ALI衍生黏液。
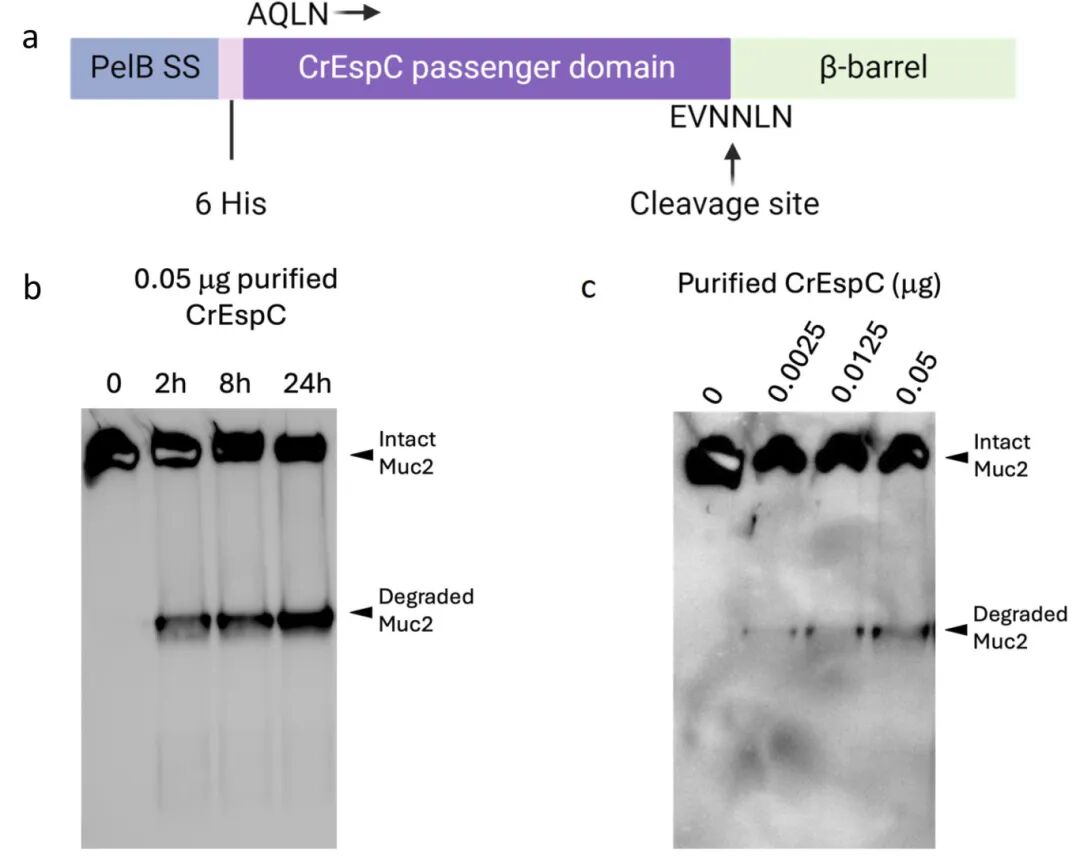
图6 重组CrEspC能够降解小鼠ALI衍生的粘液
本研究突显了ALI结肠类器官单层作为模型揭示病原体-黏液相互作用分子基础的有效性。研究者证明,C. rodentium主要通过EspC介导的黏液(Muc2)降解穿透ALI衍生黏液,而非通过Pic,从而增强其对上皮细胞的粘附和破坏。尤其重要的是,研究首次揭示了EspC——最初被归类为第I类SPATE——表现出第II类SPATEs的典型特征,即黏蛋白水解活性,能够降解ALI衍生黏液。这项工作对理解肠道病原菌如何克服宿主防御机制具有重要意义。结果表明,在感染早期阶段,C. rodentium分泌EspC作为穿透宿主保护性黏液层的手段,促进病原体接触和粘附于下层肠上皮细胞。这一发现补充了先前关于EspC在肠上皮细胞中的肠毒素作用和对T3SS介导的孔形成调节的研究,为理解A/E病原体的综合感染策略提供了新见解。
此外,本研究建立了ALI培养系统作为研究肠道黏膜表面微生物-宿主相互作用的有效工具,为揭示肠道感染的早期事件提供了有价值的平台。这种方法有望促进对其他肠道病原体穿透黏液机制的研究,推动新治疗策略的开发,以防止或减轻肠道感染。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:覆盖 7 类生物制品!NF-κB 报告细胞系成热原检测新工具
下一篇:开发高通量微流控平台用于具有胆管和小叶样结构的功能性hiPSC衍生肝脏类器官