常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-10-16 17:30:49 细胞资源库平台 访问量:164
骨组织工程学领域虽然发展迅速,但由于骨具有有限的自我修复能力,处理临界大小的颅骨缺损仍然面临挑战。目前临床上用于修复大型骨缺损的方法,如金属植入物、异体移植物和人工移植物,存在供体有限、疾病传播风险和骨整合不良等问题。传统骨组织工程通常采用"自上而下"方法,将细胞种植在生物材料支架上,并辅以信号分子,为组织形成提供结构框架。尽管这些支架提供了强大的机械支持,但它们往往面临多重限制,如细胞分布不均匀、营养物质扩散不足、长期难以降解以及无法复制骨骼的复杂结构等问题。
近年来,骨组织工程学、干细胞研究和生物制造领域的进展将该领域从简单骨支架转变为"发育工程"方法,该方法将发育生物学与工程原理相结合,从细胞组件重建生物模拟结构。早期骨发生过程中,间充质干细胞(MSCs)聚集形成"器官芽",然后与毛细血管整合完成膜内和软骨内骨化。受此启发,多项研究采用高通量微球群体作为"自下而上"策略的构建模块来构建骨组织。然而,大规模组织构建物通常需要延长体外培养时间,而由于无法充分接触诱导培养基,球体中心的成骨作用可能受限。另外,移植后干细胞的不受控分化可能导致形成纤维组织或脂肪组织等非目标组织,阻碍骨再生。
为应对这些挑战,共递送生长因子或骨诱导性纳米材料提供了更实用的策略,用于定向成骨和减少分化时间。此外,缺乏血管化是另一个挑战:核心区域的血管化不足可能导致氧气和营养物质供应不足,最终导致细胞坏死或生长停滞。因此,需要开发新策略来提高球体构建物中的血管化,促进其在临床相关尺度上用于骨组织工程。
近期,中国医学科学院北京协和医学院杨斌/清华大学机械工程系熊卓/方永聪等发布在Advanced healthcare materials期刊,题为3D Bioprinting of Prevascularized Bone Organoids for Rapid In Situ Cranial Bone Reconstruction的研究提出了一种结合间充质干细胞、人脐静脉内皮细胞和成骨微粒的新型策略,通过制备具有自组织血管化和增强成骨特性的预血管化骨类器官,来实现颅骨的快速体内重建。
1,预血管化成骨聚集体的表征与优化。研究团队通过力聚集技术形成了含有间充质干细胞(MSCs)、人脐静脉内皮细胞(HUVECs)和不同微粒(MPs)的多细胞聚集体,包括羟基磷灰石(HAP)、生物活性玻璃(BG)、氧化石墨烯(GO)和聚多巴胺(PDA)包覆的HAP微粒。在聚集过程中,研究者发现GO和PDA包覆的微粒与细胞具有更好的亲和性,无机颗粒聚集较少,因此整体稳定性更好。细胞聚集体在3天内形成稳定直径,含微粒的聚集体(直径116-133μm)比纯细胞聚集体(89.69±9.27μm)更大。活/死细胞检测确认所有组别在14天培养期内均保持良好的细胞活力,表明微粒具有良好的细胞相容性。CCK-8实验显示聚集体的增殖率随时间增加,表明细胞与微粒成功适应。通过实时定量PCR评估了预血管化聚集体的成骨特性,分析了碱性磷酸酶(ALP)、I型胶原(COL-1)、Runx-2、骨形态发生蛋白2(BMP-2)和骨桥蛋白(OPN)等特异性基因。结果显示,14天后,GO组的ALP、COL-1、Runx-2、BMP-2和OPN表达水平分别增加了6.42、8.72、2.86、3.42和3.81倍,明显高于其他微粒组。免疫荧光染色也证实GO组的COL-1表达显著高于其他组,表明GO在基因和蛋白质水平上都增强了成骨作用。综合评估表明,GO表现出最佳的成骨效果,其次是PDA包覆的HAP微粒、纯HAP和BG,因此研究选择将GO微粒与预血管化聚集体结合以进一步优化成骨过程。
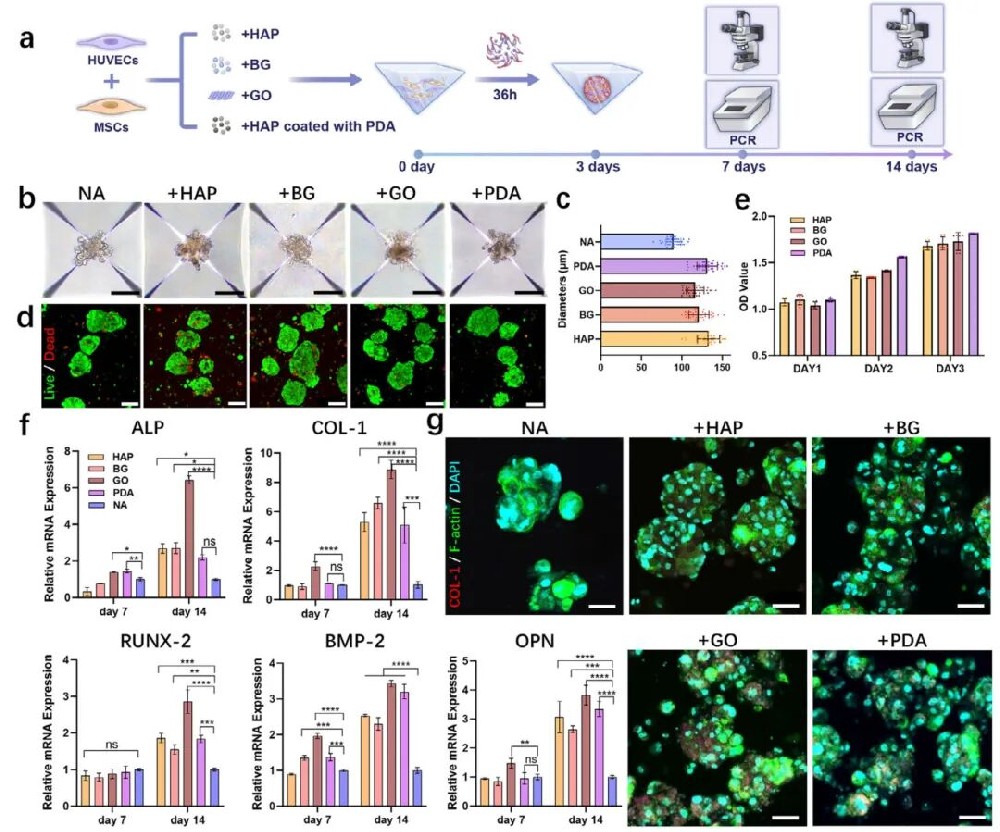
图1 血管前成骨聚合物的表征
2,GO负载预血管化骨类器官的制备与评估。研究者成功制备了含有GO微粒的预血管化骨类器官(M+H+GO),其外观比纯细胞聚集体(M+H)更暗,呈球形结构,具有紧凑、光滑的外层。活/死染色显示添加GO微粒不影响细胞聚集体形成或活力。碱性磷酸酶(ALP)和茜素红染色(ARS)显示,GO微粒增强了成骨分化和矿化。透射电镜和扫描电镜证实了GO的薄层结构,以及片状GO微粒与细胞的充分接触,有利于相互作用。将细胞聚集体嵌入胶原I-Matrigel基质3小时后,观察到血管网络形成。单纯MSCs不形成管状结构,而含HUVECs的预血管化聚集体则发展出毛细血管样网络。3和8小时的定量分析显示,预血管化组(M+H和M+H+GO)在分支数量、管长和交叉点方面与仅含MSCs的组相比有显著差异,而带或不带GO的球体之间无显著差异。这表明添加GO不干扰预血管化细胞聚集体的生长和自组织血管生成能力。CD31免疫荧光染色进一步证实聚集体内高表达的CD31,显示良好的血管化特性。总体而言,这些GO负载的预血管化细胞聚集体表现出明显的血管生成和成骨特性,具有自组织血管网络和增强的骨形成潜力,可被视为预血管化骨类器官。
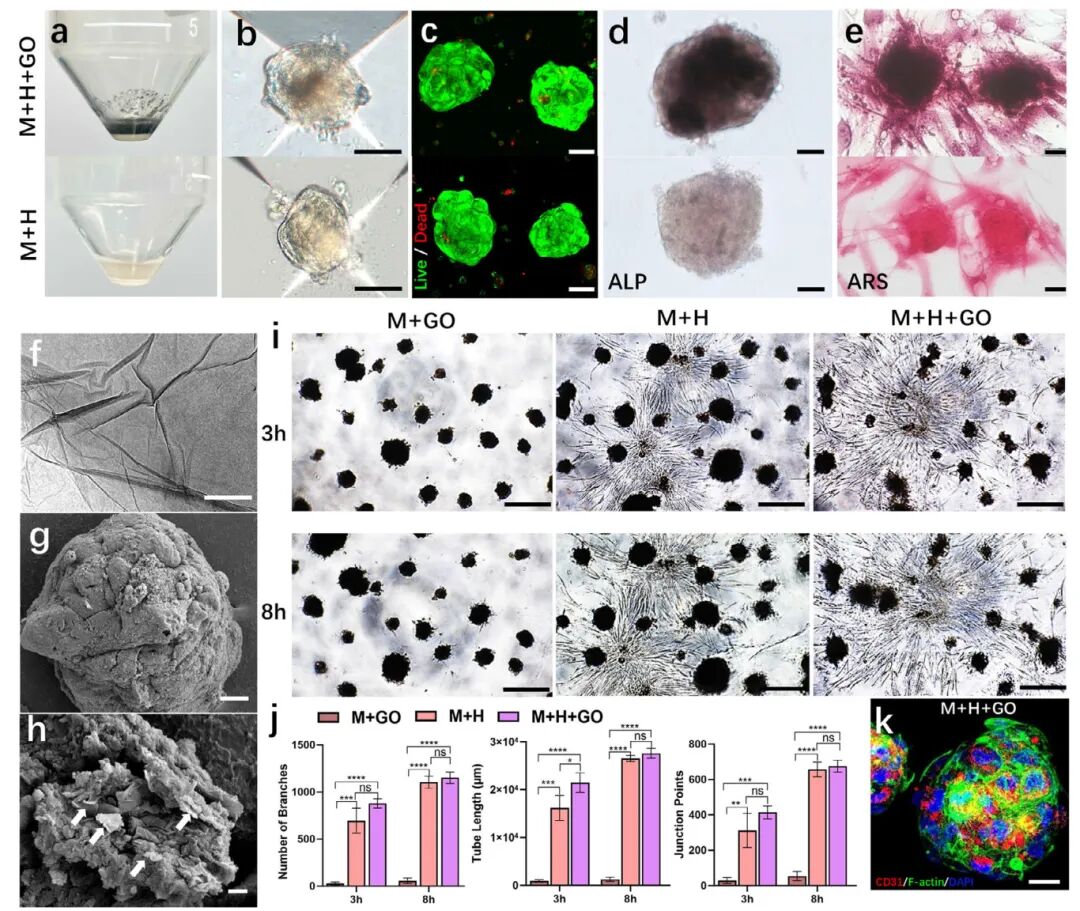
图2 载GO的预血管化骨类器官具有成骨和血管生成特性
3,预血管化骨类器官体外培养机制探索。为阐明GO促进成骨分化和矿化的分子机制,研究者对含GO微粒和不含GO微粒的细胞聚集体进行了mRNA测序。主成分分析(PCA)显示GO组(M+H+GO)和对照组(M+H)之间的基因表达有明显区别。共发现1523个差异表达基因(DEGs),其中879个上调,644个下调。关键基因如COL1A1、BMP8A和RUNX3上调,表明在成骨分化中发挥重要作用。基因本体论分析显示细胞组分如"ECM"和"含胶原ECM",以及与骨矿化、成骨细胞分化和血管生成相关的术语显著上调。京都基因与基因组百科全书(KEGG)分析进一步揭示了"细胞因子-细胞因子受体相互作用"、"粘着斑"、"PI3K/Akt信号通路"和"细胞周期"等通路的富集。粘着斑和细胞因子-细胞因子受体相互作用的上调表明增强了细胞-基质相互作用和信号转导,支持成骨和再生。基因集富集分析(GSEA)和通路基因热图评估表明,GO微粒通过调节"粘着斑通路"和"PI3K/Akt信号通路"等关键通路影响成骨作用。研究发现了粘着斑和PI3K/Akt信号通路中的关键富集基因,包括COL1A1、FAK、PI3K、Actinin、Paxillin、MLC、Rac和Pak。qPCR和Western blot分析证实,M+H+GO组中PI3K、AKT、FAK、β-catenin和COL1A1的表达水平显著高于M+H组。这些发现表明GO显著上调了成骨相关基因和蛋白质,通过激活PI3K/Akt和粘着斑通路促进骨再生。
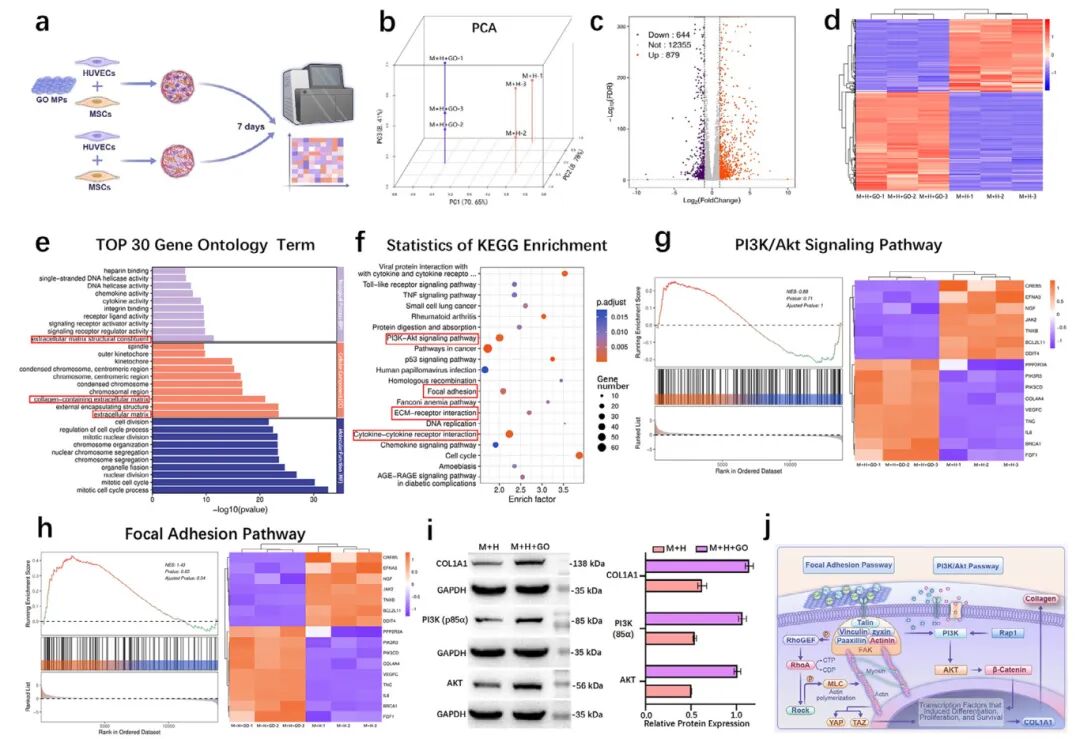
图3 一周后有或没有GO MPs的细胞聚集体的转录组分析
4,预血管化骨类器官的3D生物打印放大应用。研究者将预血管化骨类器官与3D生物打印和生物材料结合,生成厘米级植入物,用于体内修复临界大小的不规则骨缺损。预血管化骨类器官作为生物墨水可打印成复杂的3D移植物。为确保最佳打印性能、生物相容性和机械特性,研究者选择了明胶甲基丙烯酸酯(GelMA)作为载体,并评估了其5.0%、7.5%和10%浓度的流变学特性。所有浓度均表现出温度响应性、剪切变稀和应变屈服特性,但7.5%GelMA在挤出稳定性和温度控制之间提供了最佳平衡,支持平滑生物打印并维持细胞活力。研究者选择7.5%GelMA封装的预血管化骨类器官作为功能性生物墨水进行3D生物打印,球体体积分数为60%。挤出温度保持在15-30°C,优化的打印参数为1.2mm/s和0.1mm³/s挤出速度。构建物通过30秒405nm光交联稳定,活/死染色显示细胞活力约为85.63±4.2%。通过免疫荧光染色检查打印后水凝胶中固定的细胞聚集体的长期形态,观察到丝状肌动蛋白(F-actin)细胞骨架逐渐形成应力纤维,随时间过渡到更结构化的皮质肌动蛋白网络。7天后,水凝胶内的预血管化骨类器官逐渐扩展、拉伸并连接形成复杂的3D细胞网络。CD31免疫荧光染色证实了打印构建物的血管化潜力。通过荧光标记的HUVECs和MSCs进一步观察细胞形态,证实预血管化骨类器官在7天观察期内通过内皮细胞萌芽维持了原始毛细血管网络。
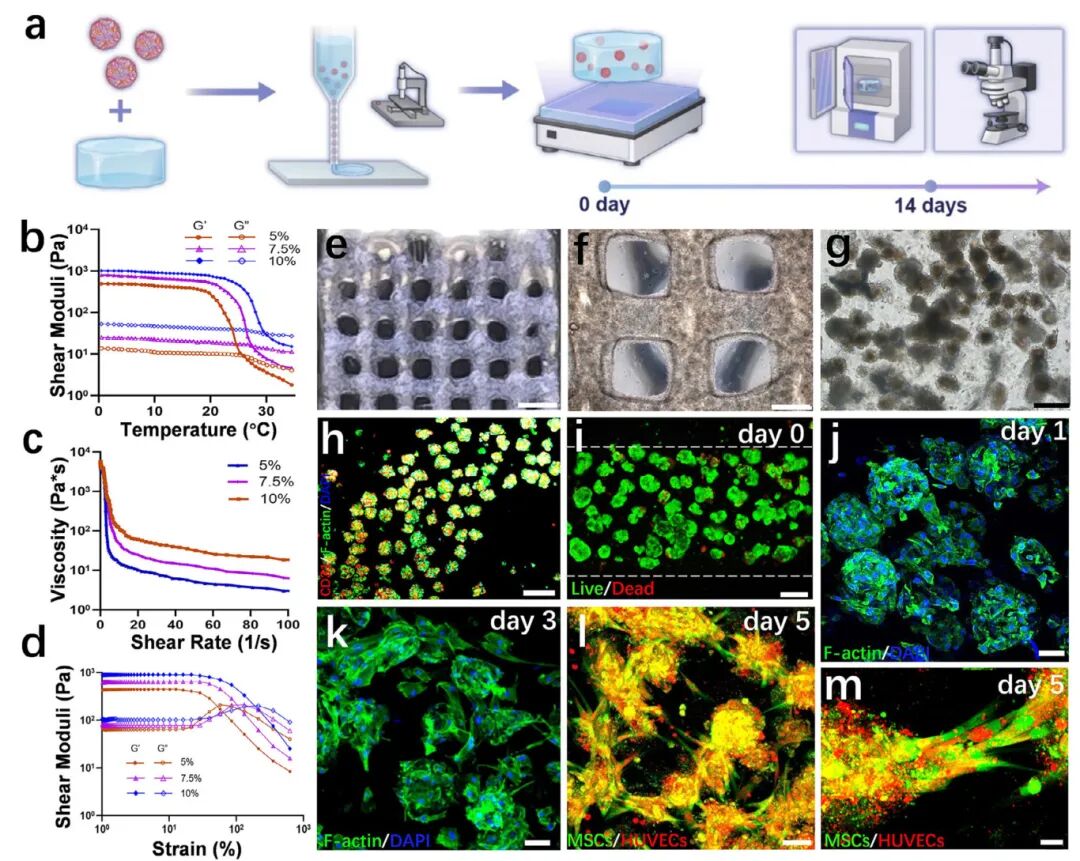
图4 血管前骨类器官负载生物墨水的三维生物打印
5,预血管化骨类器官促进颅骨缺损的快速体内成骨。研究者在大鼠颅骨上创建了直径4mm、深度1mm的缺损,填充三种不同的生物打印构建物:含预血管化聚集体的GelMA(MSCs和HUVECs,简称M+H)、含成骨MSCs聚集体的GelMA(MSCs和GO微粒,简称M+GO)和含预血管化骨类器官的GelMA(HUVECs、MSCs和GO微粒,简称M+H+GO)。对照组(NA)不填充任何材料。通过微CT、组织学染色和免疫荧光评估骨再生情况。微CT成像显示,移植后4和8周,对照组骨形成有限,而实验组显示明显更多的骨形成。M+H+GO组新骨覆盖率最高,大量新骨填充缺损。8周定量分析显示,M+H+GO组的骨体积/总体积(BV/TV)比为32.28±4.48%,显著高于M+H、M+GO和对照组,分别为2.13、2.32和4.11倍。骨矿物质密度(BMD)和新骨面积也遵循这一趋势,突显M+H+GO组增强的骨再生能力。H&E和Masson三色染色的组织学评估证实了这些发现。H&E染色显示对照组有纤维化和最小骨形成,而M+GO和M+H组表现出中等骨形成。M+H+GO组在缺损处表现出最广泛的骨发育。Masson三色染色显示类似趋势,突出了使用预血管化骨类器官治疗的缺损中增加的骨形成。此外,OCN表达水平在M+H+GO组(6.11±0.27%)显著高于M+GO(2.48±0.15%)、M+H(2.47±0.36%)和对照组(1.33±0.22%)。
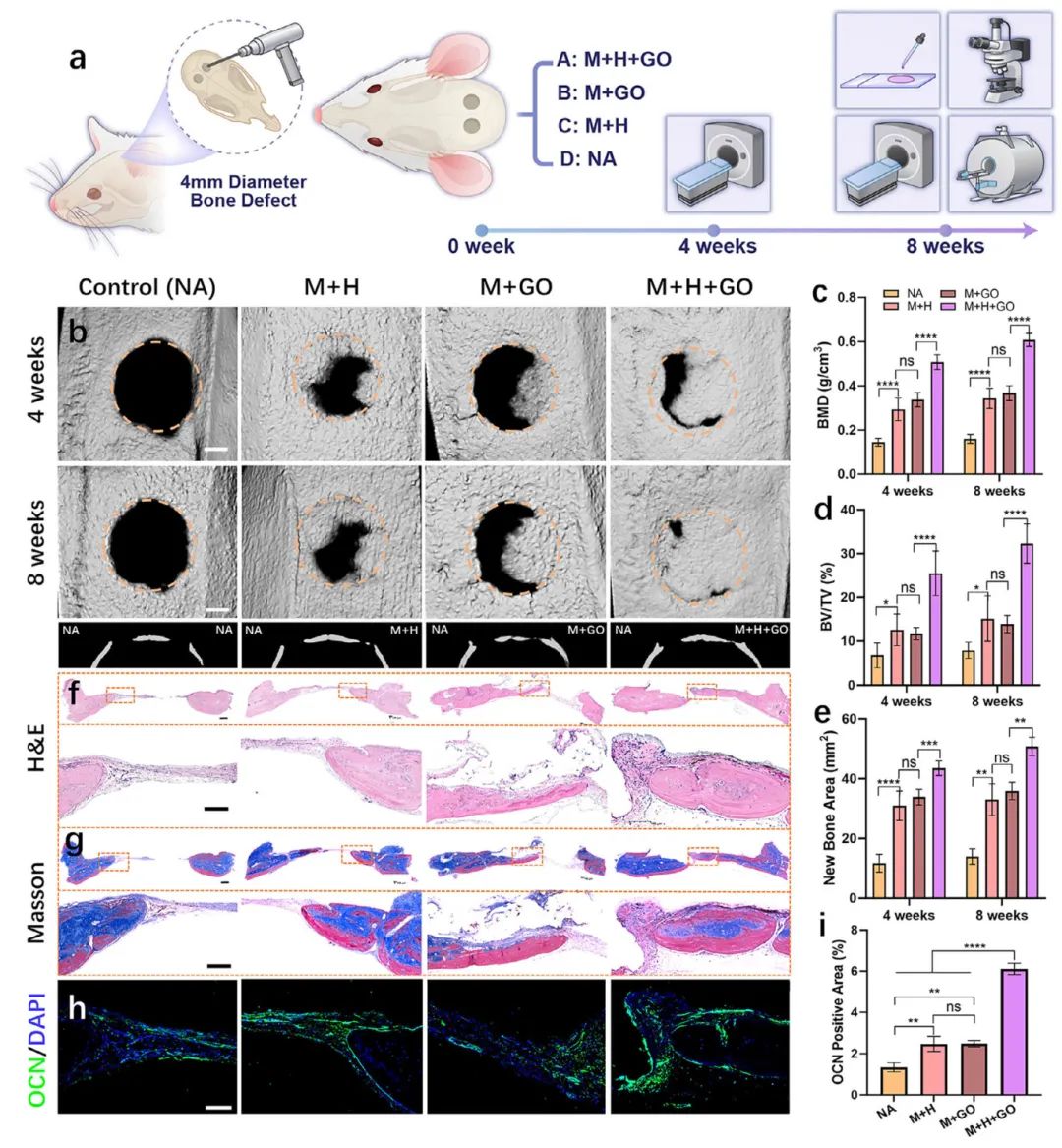
图5 利用大鼠颅骨缺损模型评价体内骨再生
6,预血管化骨类器官增强颅骨缺损的血管化和抗炎作用。充足的血液供应对骨再生至关重要,提供必要的营养物质、生长因子和氧气支持组织修复。研究采用磁共振成像(MRI)分析移植8周后颅骨缺损区域的血管网络形成。3D重建图像显示所有组别都有血管网络,但对照组和M+GO组血管密度有限,而M+H和M+H+GO组的血管密度和体积明显增加。定量评估表明M+H和M+H+GO组的新生血管体积显著大于其他组。CD31免疫荧光染色进一步证实了血管化情况。尽管所有组都检测到CD31表达,但M+H和M+H+GO组的染色更明显。定量分析证实M+H(3.06±0.08%)和M+H+GO(3.77±0.21%)组的CD31荧光信号显著高于M+GO(1.26±0.22%)和对照组(1.11±0.18%)。这些发现凸显了预血管化聚集体在M+H和M+H+GO组中的卓越血管化能力,从而增强其在颅骨缺损中的治疗潜力。免疫细胞在组织损伤中积极迁移到伤口,驱动炎症阶段并通过平衡分解和合成过程调节骨形成和重塑。巨噬细胞从促炎M1表型转变为抗炎M2表型,通过免疫调节因子调节骨再生。含GO的支架促进这种转变并通过促进M1向M2巨噬细胞极化支持早期成骨。CD163(M2)/CD68(M1)巨噬细胞标记的免疫荧光染色显示,GO负载组中CD163-M2表达显著增高,CD68-M1表达较低。定量分析表明,使用预血管化骨类器官(2.06±0.03%)和M+GO组(2.05±0.15%)治疗的缺损中CD163/CD68巨噬细胞的百分比超过了M+H组(0.50±0.03%)和对照组(0.45±0.05%)。M2巨噬细胞表达高水平的血管内皮生长因子(VEGF)和血小板衍生生长因子(PDGF-BB),对稳定血管生成至关重要。因此,含GO的预血管化骨类器官有效促进M2巨噬细胞极化,表明在增强血管生成方面具有协同作用。
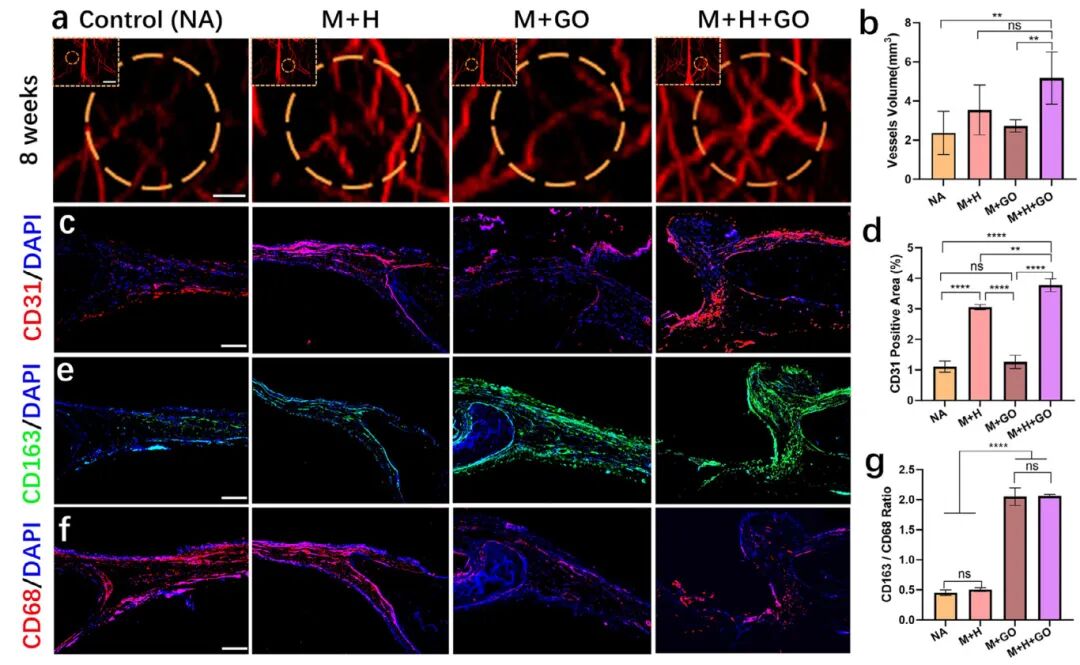
图6 用预血管化骨器官修复颅缺损区的血管化和免疫反应评价
本研究提出了一种新颖的方法,通过结合预血管化骨类器官与3D生物打印技术,实现快速体内颅骨再生。利用发育工程原理,成功制备了具有自组织血管生成和增强成骨分化特性的预血管化骨类器官,可作为骨再生应用的血管化骨单元。将预血管化骨类器官整合到水凝胶中,通过3D生物打印制造出缺损定制、大尺度骨植入物,产生具有近生理细胞密度的血管化骨组织。这种方法最终通过战略性地结合细胞聚集与成骨颗粒和预血管化,实现了快速体内骨形成。
该策略通过将球体与生物打印技术相结合,解决了传统支架基方法的局限性,能够准确复制骨的复杂结构同时确保细胞均匀分布。此外,在之前研究单细胞球体的基础上,同时实现了成骨潜力和预血管化,加速了骨再生中的成骨分化和血管化,从而改善治疗效果。未来,这种创新方法可以进一步与微生物打印技术结合,创建具有内部血管网络的复杂骨结构,解决骨再生中血管化的关键挑战。这种创新的发育工程策略有望为骨再生提供一种有前景的、可扩展且有效的方法,为临床环境中的再生疗法提供强大平台,从而大大加速生物制造和组织工程的治疗应用进展。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:胆酸-FXR信号通路促进人源诱导多潜能干细胞衍生肝脏类器官的肝特性长期维持