常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-10-16 09:08:34 细胞资源库平台 访问量:191
人源诱导多潜能干细胞(iPSCs)可以分化为肝细胞样细胞(iPS-Heps),这些细胞可用于药物筛选、疾病建模和再生医学。然而,iPS-Heps的基因表达谱和功能与成人原代肝细胞相比仍不够成熟,且无法长期增殖和培养。目前,FXR(法尼醇X受体)和甲状腺激素信号通路被证明对iPS-Heps的功能成熟非常重要,但是iPS-Heps仍然保留着与不成熟小肠上皮细胞相关的基因表达,难以长期维持肝细胞特性。
近年来,研究人员通过三维培养有机体系尝试解决iPS-Hep维持问题,但在已报道的iPSC衍生肝脏类器官中,囊性特征明显,表明在生长阶段丧失了肝细胞表型。此外,一些包含多种肝脏细胞类型(如肝星状细胞和Kupffer细胞)的iPSC衍生肝脏类器官也被报道,但这些类器官一旦形成就缺乏增殖能力。
胆酸作为FXR的激动剂,在肝脏再生中发挥重要作用。基于这一点,研究团队尝试建立一种新型的iPSC衍生肝脏类器官(iHO)培养方法,利用胆酸介导的FXR信号,实现iPS-Heps肝特性的长期维持。在这种新型培养系统中,研究者通过胆酸-FXR信号的激活,成功实现了iPSC衍生类器官的长期培养,这些类器官保持了肝细胞样特性,同时抑制了iPS-Heps分化后不久观察到的导管表型。这一创新方法为肝脏组织工程和疾病建模提供了一个有价值的平台。相关研究结果由东京科学研究所研究人员以题Bile acid-FXR signaling facilitates the long-term maintenance of hepatic characteristics in human iPSC-derived organoids发布在Cell reports期刊。
1,人源肝脏类器官(iHO)的建立。研究团队首先优化了iHO的培养条件,他们将人源iPSC分化为2D肝细胞样细胞,然后将其嵌入Matrigel中进行3D培养。通过改良人源胎肝类器官(FO)的培养基,他们建立了一种新的培养条件,称为iHO培养基,其中包括Wnt3a代替CHIR99021并添加胆酸。在这种培养条件下,研究者观察到类器官形成独特的"葡萄状"结构,与原始的人胎肝类器官相似。葡萄状类器官在iHO培养基中的生长明显优于其他培养条件,而在FO条件或不含胆酸的培养基中,主要形成球形和囊性结构。为了优化iHO培养系统,研究者筛选了包括奥贝胆酸(OCA)在内的胆酸和FXR激动剂,发现添加奥贝胆酸显著增加了白蛋白(ALB)这一代表性肝脏标志基因的表达。因此,在后续实验中,他们使用了牛磺奥贝胆酸(TOCA)进行iHO培养。在iHO条件下培养一次传代后,肝脏标记物(ALB、AHSG、TAT和TF)的表达显著增加,相比于2D-iPS-Heps、不含胆酸培养的类器官和FO条件下培养的类器官都有明显提高。值得注意的是,TF的表达水平显著高于培养的原代人肝细胞。这些葡萄状类器官可以通过机械分散和扩增,从小碎片形成完整的类器官。这些现象在多个iPSC系中得到了一致的重现,表明本研究建立的iHO条件是一种更有效且可重复的类器官培养系统,能够增强iPSC衍生细胞的肝特性。
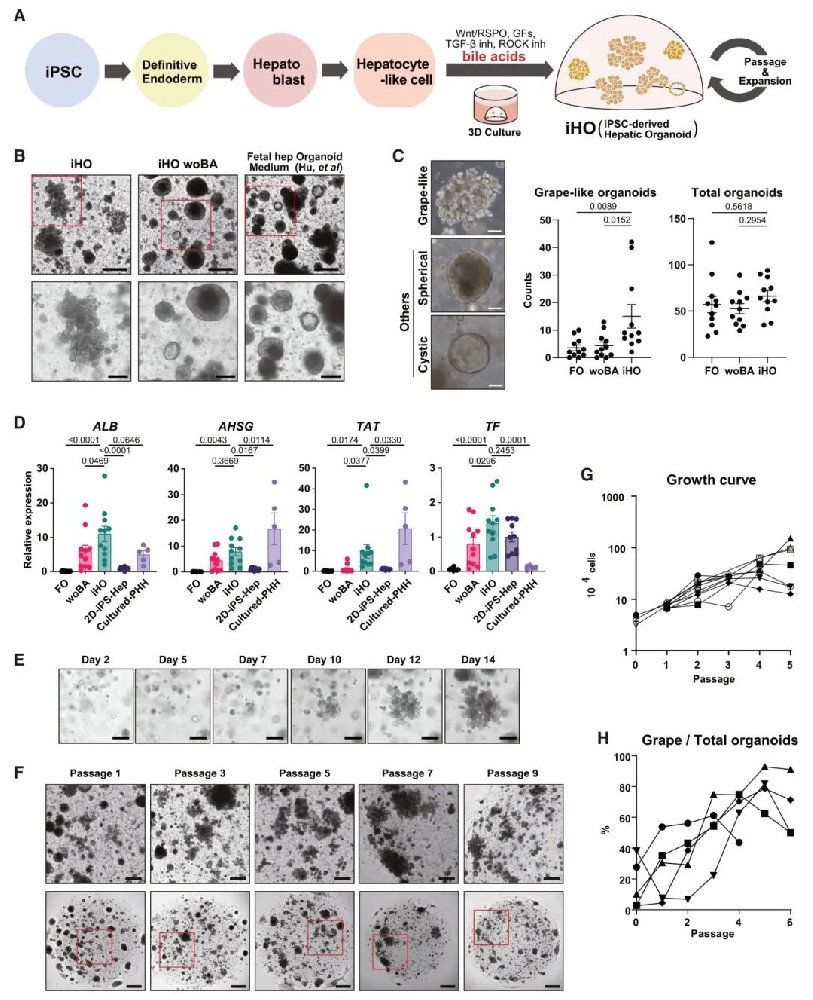
图1 人iPSC衍生肝类器官培养的建立
2,iHO的长期增殖能力和葡萄状类器官的富集。研究者成功建立了具有高表达肝细胞标记基因的iHO。实现肝细胞样特性和持续增殖能力是公认的挑战目标。iHO培养系统显示了在维持以葡萄状类器官为主的培养物的长期增殖能力。几乎所有从不同iPSC系派生的独立iHO系都能在5次以上传代中保持增殖能力。部分iHO系在培养后期增殖逐渐减缓,生长曲线达到平稳期,而其他一些iHO系则能维持9次以上的传代。随着传代的增加,葡萄状类器官的比例逐渐增加,表明iHO中的类器官异质性减少。尽管iHO培养系统无法完全排除形态学上非葡萄状的类器官,但葡萄状类器官在iHO条件下得到了富集和长期维持,保留了肝细胞样表型。
3,iHO长期维持肝特性。在iHO长期培养过程中,肝细胞标记物如ALB、AHSG、补体3(C3)和α-1抗胰蛋白酶(SERPINA1)的表达水平持续且显著高于2D-iPS-Heps,尽管尚未达到人肝脏样本中的高表达水平。TF在iHO中的表达与人肝脏样本相当。相比之下,胎儿标记物α-胎蛋白(AFP)的表达相对于2D-iPS-Heps显著降低,但仍高于人肝脏样本。这些结果表明,虽然iHO显示出持续且更成熟的肝特性,但它们尚未完全复制体内人肝细胞的表型。进一步的详细分析显示,H&E染色证实类器官由小叶状细胞簇组成,且葡萄状iHO由均匀且强烈表达ALB的细胞组成。电子显微镜展示了iHO中的线粒体和粗面内质网,以及糖原颗粒,这些都是肝细胞的代表性微观结构。线粒体DNA定量分析证实iHO与2D-iPS-Heps和培养的原代肝细胞相当。此外,在iHO中还观察到由紧密连接和微绒毛锚定的腔状结构,类似于肝细胞的胆小管。MRP2免疫染色和氯甲基荧光素二乙酸酯(CMFDA)的积累也表明iHO中存在类胆小管结构,尽管未形成完整的胆小管网络。功能评估显示,iHO与2D-iPS-Heps相比表现出显著更高的白蛋白产生,并能摄取低密度脂蛋白(LDL)。此外,为了展示iHO的肝功能,研究团队建立了一个利用iHO的丙型肝炎病毒(HCV)感染模型。HCV在iHO中的感染和复制被观察到,而在FO中完全不检测到HCV复制。从微观结构特征到基因表达和功能方面,这些数据证明iHO能够维持肝细胞样功能。
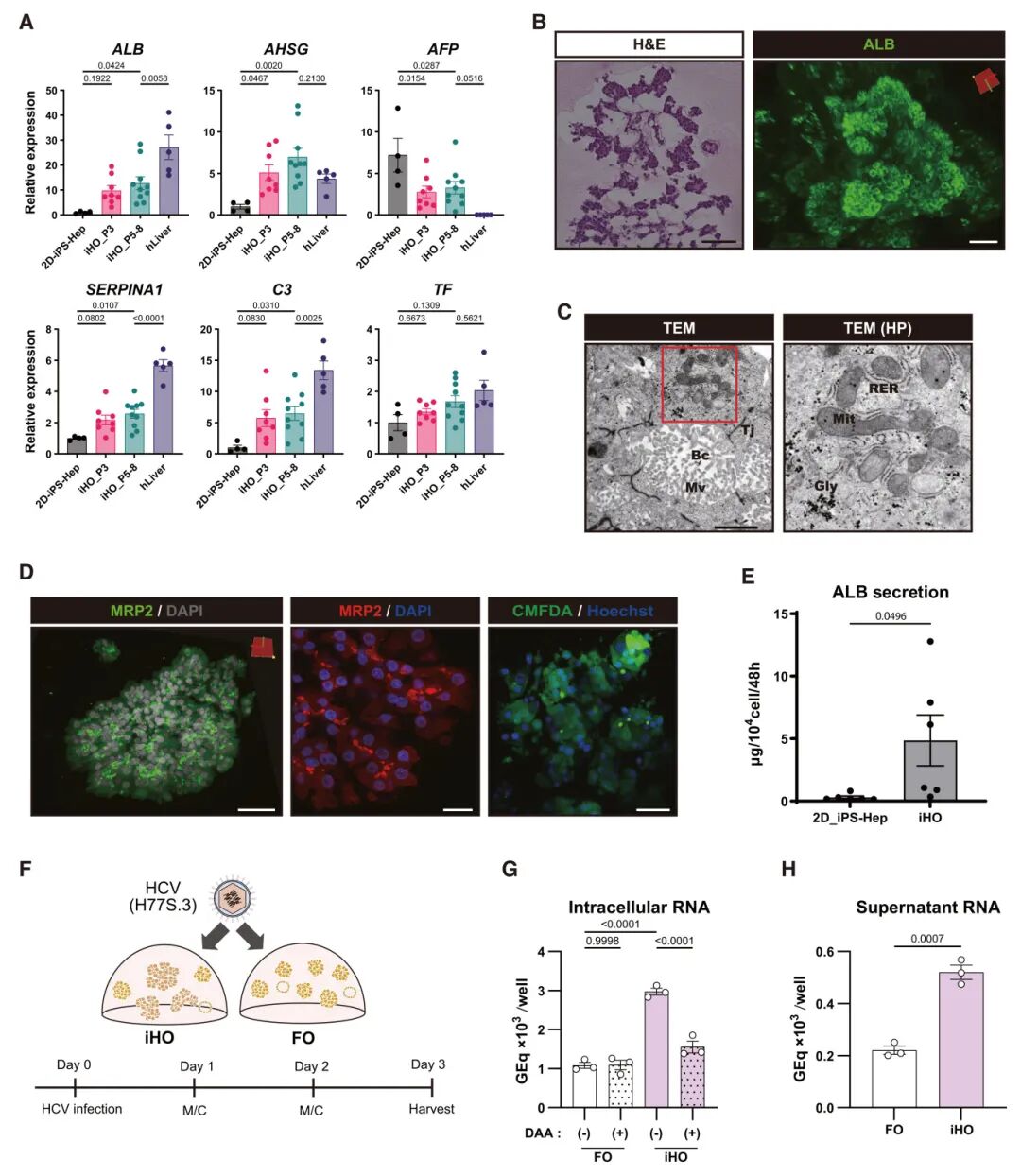
图2 iHO可长期维持肝脏特征
4,RNA测序分析揭示iHO具有胎肝细胞样基因表达谱。通过综合分析,研究团队探索了iHO的基因表达谱。与其他3D和2D培养组相比,iHO具有独特的基因表达谱,与胎肝细胞密切相似,而其他3D类器官培养组则接近导管组(胆管、肠和结肠)。发育标记基因的热图显示,iHO表达更高的肝细胞标记物,而其他条件下的类器官则表现出更高的胆管、肠和胰腺细胞标记物的表达。基于肝母细胞、胎肝细胞和成体肝细胞标记物的热图证实iHO模拟了胎肝样本的表达谱。使用其他胎肝和成体肝细胞标记基因,iHO也高度表达胎肝细胞标记基因,与胎肝细胞密切相似。基因集变异分析(GSVA)显示,iHO相比其他类器官表现出肝细胞基因特征的富集,尽管相比原代肝细胞的肝细胞基因特征富集度更低,这与qPCR和RNA-seq分析的热图结果一致,表明iHO未完全分化为成熟肝细胞。具体来说,iHO对成体肝细胞标记基因(包括CYPs(药物代谢)、ADH1B(酒精代谢)和CES1(脂质代谢))的表达较低,与其他类器官(FOs和不含胆酸的iHOs)类似。与传代3的不含胆酸的iHOs相比,KEGG富集分析也显示补体和凝血级联、各种代谢通路和胆汁分泌的显著富集。通过基因集富集分析(GSEA)观察到iHO中肝细胞基因集的显著富集。这些发现表明,源自iPS-Heps的iHO强烈模拟了体内人胎肝细胞,并能够在长期培养中维持肝表型。
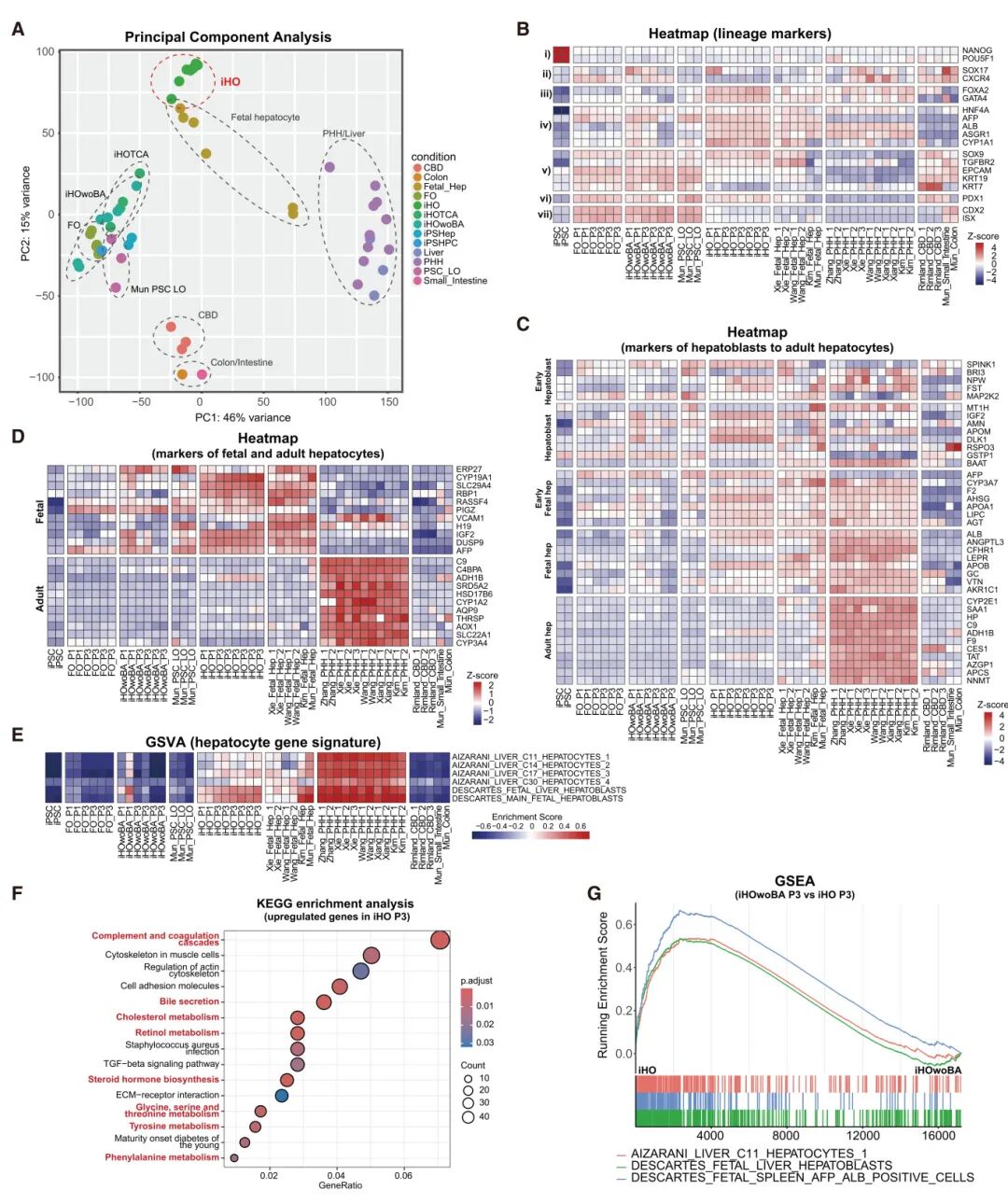
图3 iHOs的RNA测序分析
5,iHO条件下长期培养中导管分化的抑制。使用RNA-seq分析,GSVA显示iHO相比其他条件下培养的类器官,导管基因特征的富集分数较低,表明iHO中导管分化被抑制。在早期传代(P1),EPCAM和KRT19的表达水平保持不变,而CDX2和ISX的表达水平下降。随着iHO的长期培养,这些基因表达的显著降低证实了导管分化的抑制。此外,RNA-seq分析显示不含胆酸传代3的iHO与含有胆酸的iHO相比,导管基因特征显著富集。这些发现表明,iHO促进了肝细胞的进一步富集,同时抑制了导管分化。
6,单细胞分析确定iHO中的肝细胞样细胞与体内胎肝细胞相当。为了更详细和全面地分析基因表达谱和细胞异质性,研究团队对iHO(n=3;P0,P1和P4)和FO(n=1;P0)进行了单细胞RNA测序(scRNA-seq)。鉴定了两种类型的细胞:肝细胞样细胞和导管样细胞,通过肝脏(ALB,AHSG,TF和GC)、胎肝(AFP,DLK1,GPC3和IGF2)和导管(EPCAM,KRT19,CDX2和KLF5)标记物的表达得到确认。肝细胞样簇在iHO组中更为丰富,并在iHO P4中成为主导(导管样细胞<3%)。相比之下,导管样簇在培养早期阶段更为明显,在FO中表现为更高水平。导管样细胞占FO细胞的>80%。使用scRNA-seq数据的富集分析(单样本GSEA [ssGSEA])也显示肝细胞样簇中肝细胞相关基因集的显著富集。此外,研究者将自身类器官的数据与来自CRA002443的公开人胎肝数据整合。人胎肝细胞根据其特定标记基因进行聚类,包括肝细胞(AFP和ALB)、红细胞(GATA1和GYPA)、间充质细胞(DCN和HGF)、Kupffer细胞(CD68)、髓系细胞(ITGA2B)和造血干细胞(CD34)。在类器官细胞中,鉴定了一个与肝细胞重叠的细胞簇,这个簇主要在iHO中观察到,并表现出高ALB表达,表明其身份为肝细胞样细胞。相比之下,与胎肝细胞不同的其余类器官细胞表现出导管标记物的高表达。这些簇的差异表达分析和富集分析进一步证实了一种导管表型,表明这些细胞是导管样细胞。
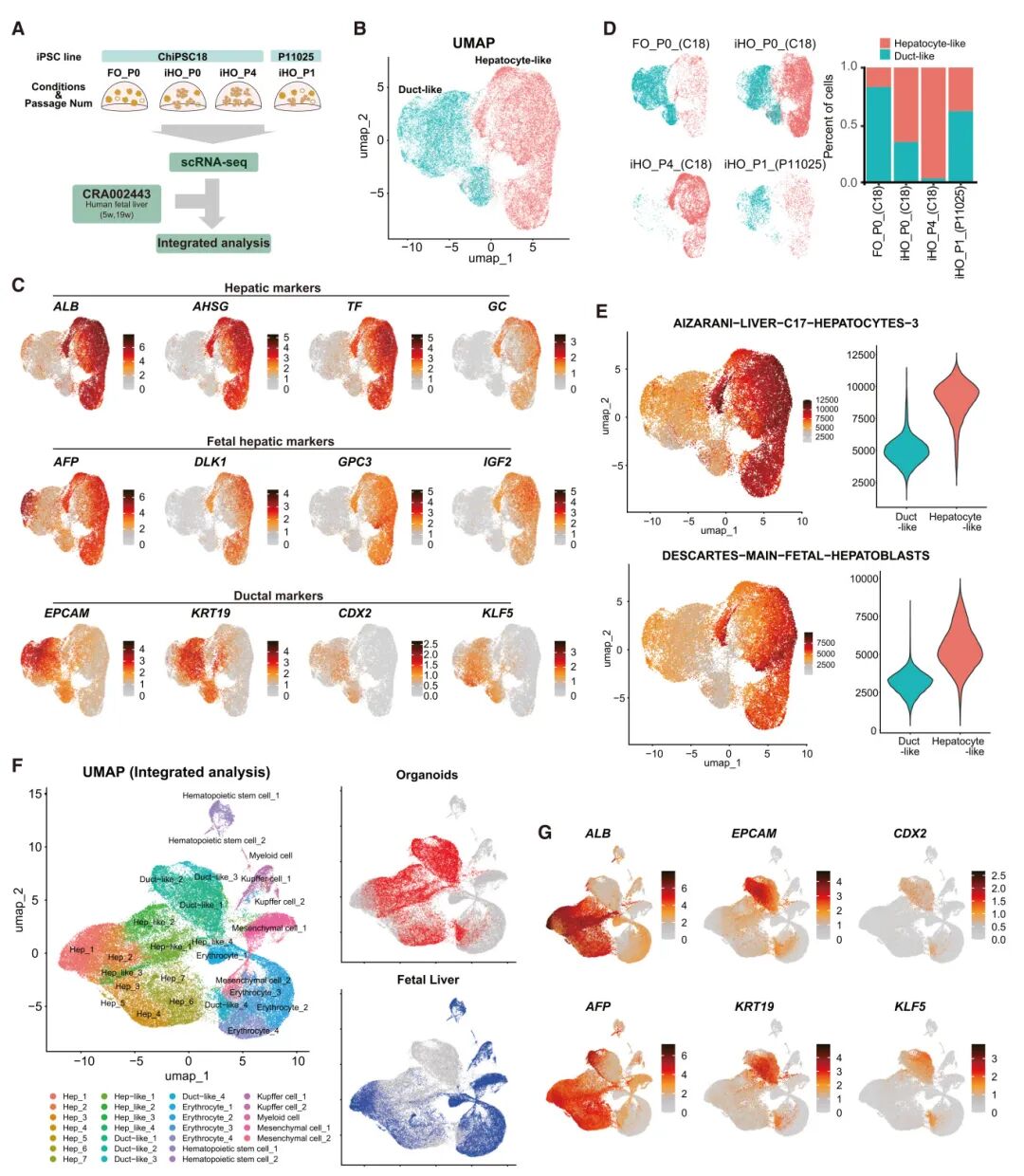
图4 iHOs的单细胞RNA序列分析
7,iHO中的肝细胞样细胞在维持肝特性的同时增殖。scRNA-seq数据的详细聚类显示,肝细胞样和导管样簇分别进一步细分为五个和四个亚簇。肝细胞样簇表现出肝标记物的高表达和胆管细胞和前体标记物的中等表达,而导管样簇则表现出胆管标记物的高表达以及特定肠道标记物表达。在肝细胞簇中,鉴定了一个"Hep-cycling"簇,特征是增殖标记物如MKI67、CCNA2、PCNA和FOXM1的高表达。Hep-cycling细胞保持肝细胞标记物的高表达,没有上调前体或胆管细胞标记物,表明这些细胞获得了增殖能力,而没有去分化为导管样状态。这一发现与免疫染色观察一致,显示细胞强烈表达AFP和Ki-67。虽然与其他肝细胞亚簇相比,Hep-cycling簇的肝特征略有减少,但没有观察到主要的去分化,因为Hep-cycling簇保持了比导管样亚簇高得多的肝细胞特征富集。此外,Hep-cycling簇表现出导管细胞特征的低富集。这些发现表明,iHO有效地维持了肝细胞的增殖能力和功能特性。
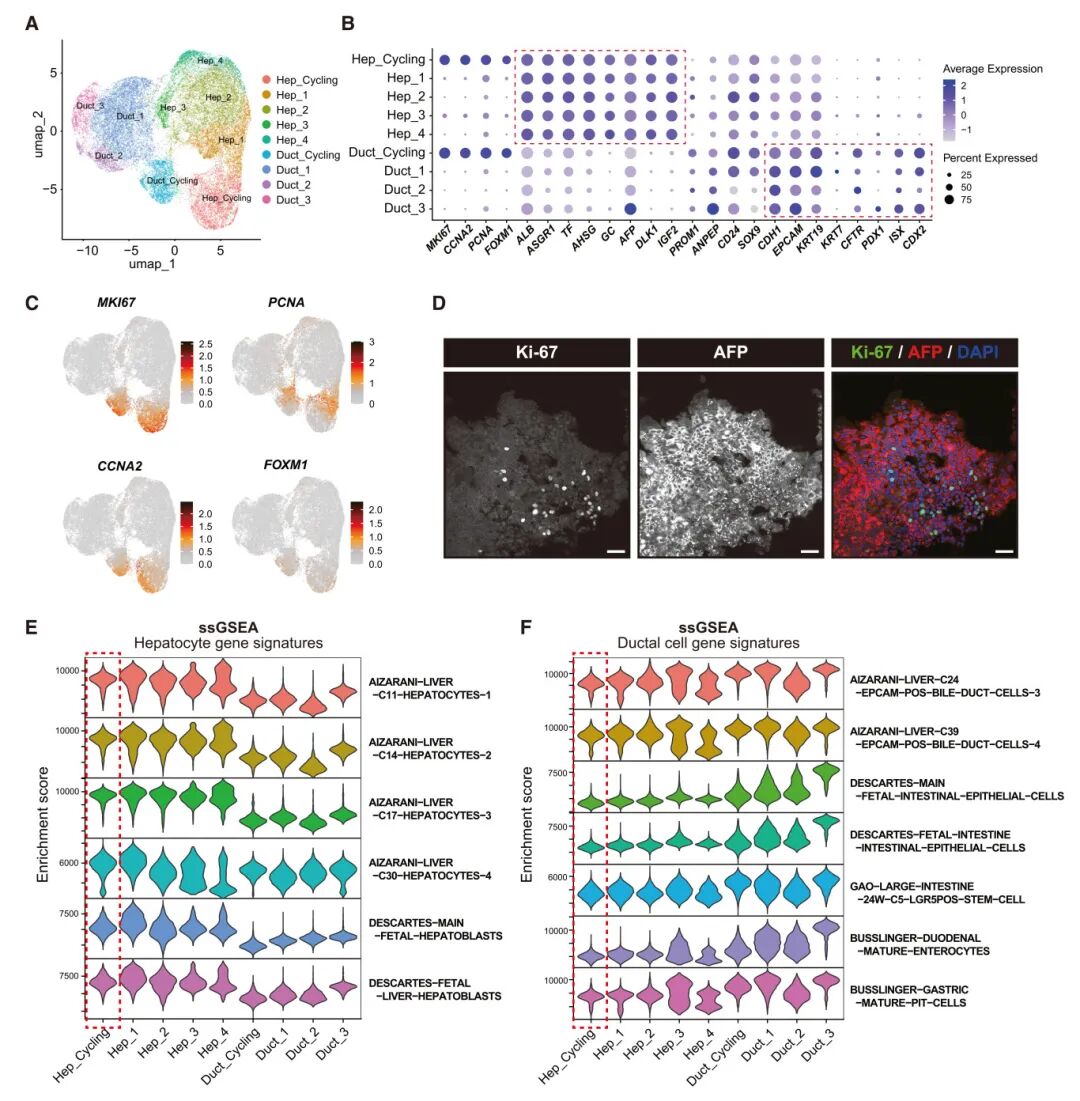
图5 单细胞RNA序列分析肝细胞样簇
8,葡萄状类器官是由肝细胞样细胞组成的肝脏类器官。scRNA-seq数据显示,iHO P4中几乎所有细胞都被聚类为肝细胞样细胞。从形态学上看,iHO P4主要由葡萄状类器官构成,表明葡萄状类器官由肝细胞样细胞组成,这与其他形态学异质的样本不同。为了验证这一点,研究团队从iHO中分离了形态学上的葡萄状类器官(iHO_grapes)并将其与其余类器官(iHO_others,包括球形和囊性类器官)进行比较。对这些分离的类器官进行的全面RNA-seq显示,iHO_grapes中肝标记基因的表达高于iHO_others。iHO_grapes表现出肝特征的显著富集,而iHO_others则表现出导管特征的显著富集。此外,与图3中的批量RNA-seq分析整合显示,iHO_grapes明显接近iHO和胎肝细胞。scRNA-seq和这些分选的RNA-seq上调差异表达基因的比较显示,肝细胞样与iHO_grapes之间以及导管样细胞与iHO_others之间没有重叠。相反,scRNA-seq鉴定的肝细胞样细胞和RNA-seq中的iHO_grapes共享210个上调基因,表明肝特征的强烈富集。免疫染色证实,ALB和HNF4α在葡萄状iHO中均匀表达,而EpCAM和KRT19在葡萄状iHO中的染色强度较低。其他类器官表现出EpCAM和KRT19的增强染色,ALB染色相对较低。总之,scRNA-seq中的肝细胞样簇构成了iHO中葡萄状类器官的细胞群体。分选的葡萄状iHO主要生长出葡萄状iHO,同时也有少量其他形状的类器官生长。相比之下,非葡萄状iHO只培养出球形和囊性类器官。尽管iHO培养系统随着传代促进葡萄状类器官的富集,但这些结果表明,手动选择葡萄状类器官提供了一种有效的替代方法,可以在早期传代中实现纯肝脏类器官培养。
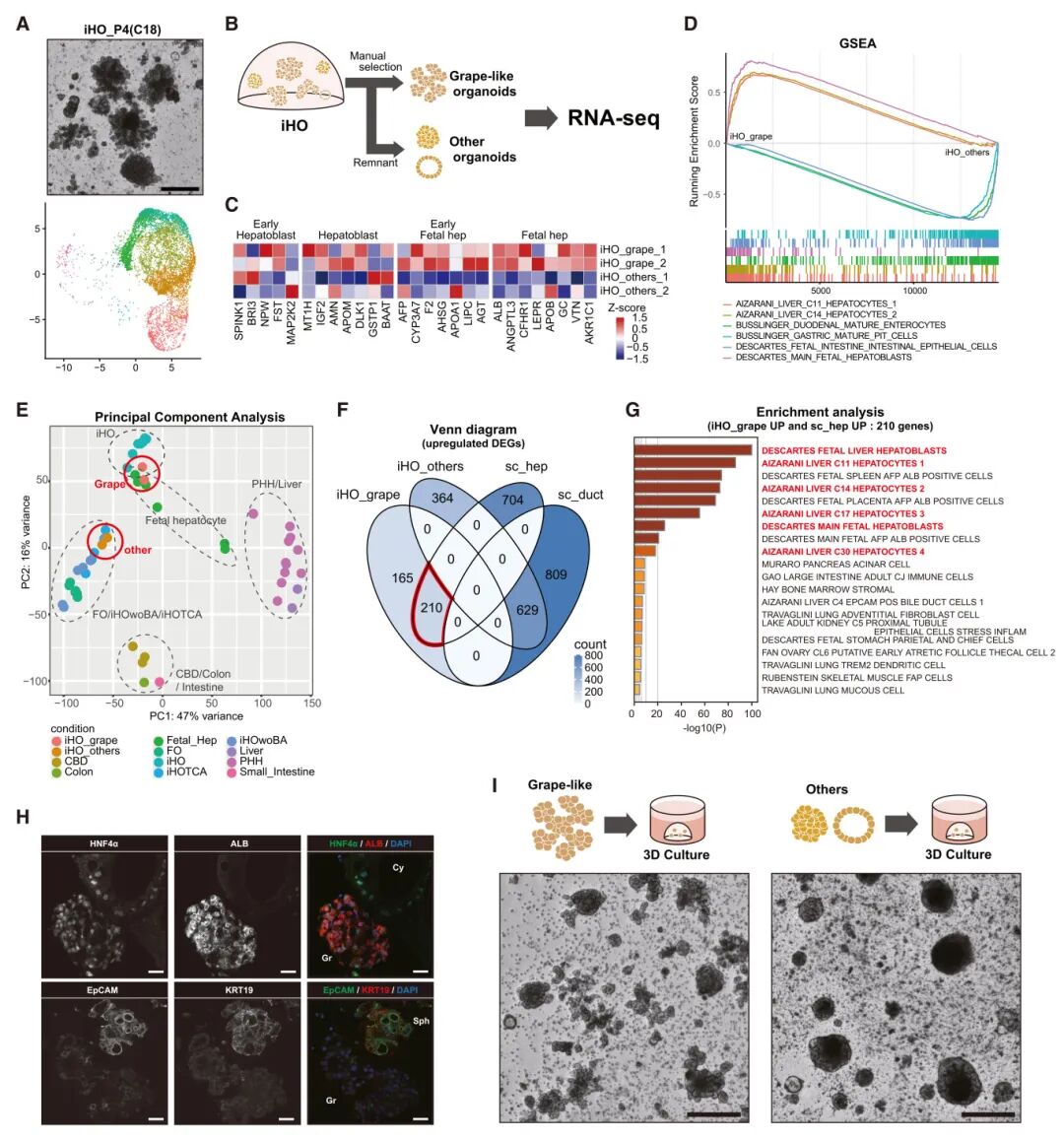
图6 iHOs中葡萄样类器官的分析
9,iHO中肝特性的维持依赖于胆酸-FXR信号通路。从批量RNA-seq分析的PCA图来看,添加生理胆酸TCA的条件与添加TOCA的iHO相比,表现出更接近的表达谱,而不含胆酸和FO条件则更远。除了GSVA显示的iHO强烈的肝特征外,FXR(NR1H4)靶基因集和OCA靶基因在iHO条件下强烈富集,水平相当于原代肝细胞。在iHO的scRNA-seq中,FXR靶基因NR0B2和FGF19在肝细胞样细胞中表达显著增高。ssGSEA也显示肝细胞样簇中NR1H4靶基因的显著富集。这些发现表明,通过添加TOCA增强FXR信号有助于培养iHO。为了评估FXR信号在iHO培养系统中的作用,研究者通过添加两种不同的FXR抑制剂DY268和Z-guggulsterone(ZGG)抑制了iHO中的FXR信号。添加FXR抑制剂显著减少了葡萄状类器官的数量。qPCR显示肝基因表达(ALB,AHSG和TF)的显著抑制,并证实FXR抑制剂组中FXR信号成功抑制。此外,研究者还关注FXR的下游基因NR0B2(small heterodimer partner,SHP),该基因在肝细胞样簇中表达显著增加。为了确定SHP在iHO中的功能,研究团队建立了一个在doxycycline(Dox)处理下过表达SHP的iPSC系。类器官,包括葡萄状iHO,在Veh和Dox条件下培养。用RNA-seq进行了全面分析,差异基因表达的火山图显示过表达SHP后许多基因的表达显著下降。差异基因的富集分析显示,下调基因中导管特征显著富集,上调基因中肝特征富集。这些结果表明胆酸-FXR-SHP轴在iHO培养系统中的重要性,并表明SHP作为FXR下游的转录抑制因子,减少了iPS-Heps中非肝基因的表达,使iHO能够维持肝特性。
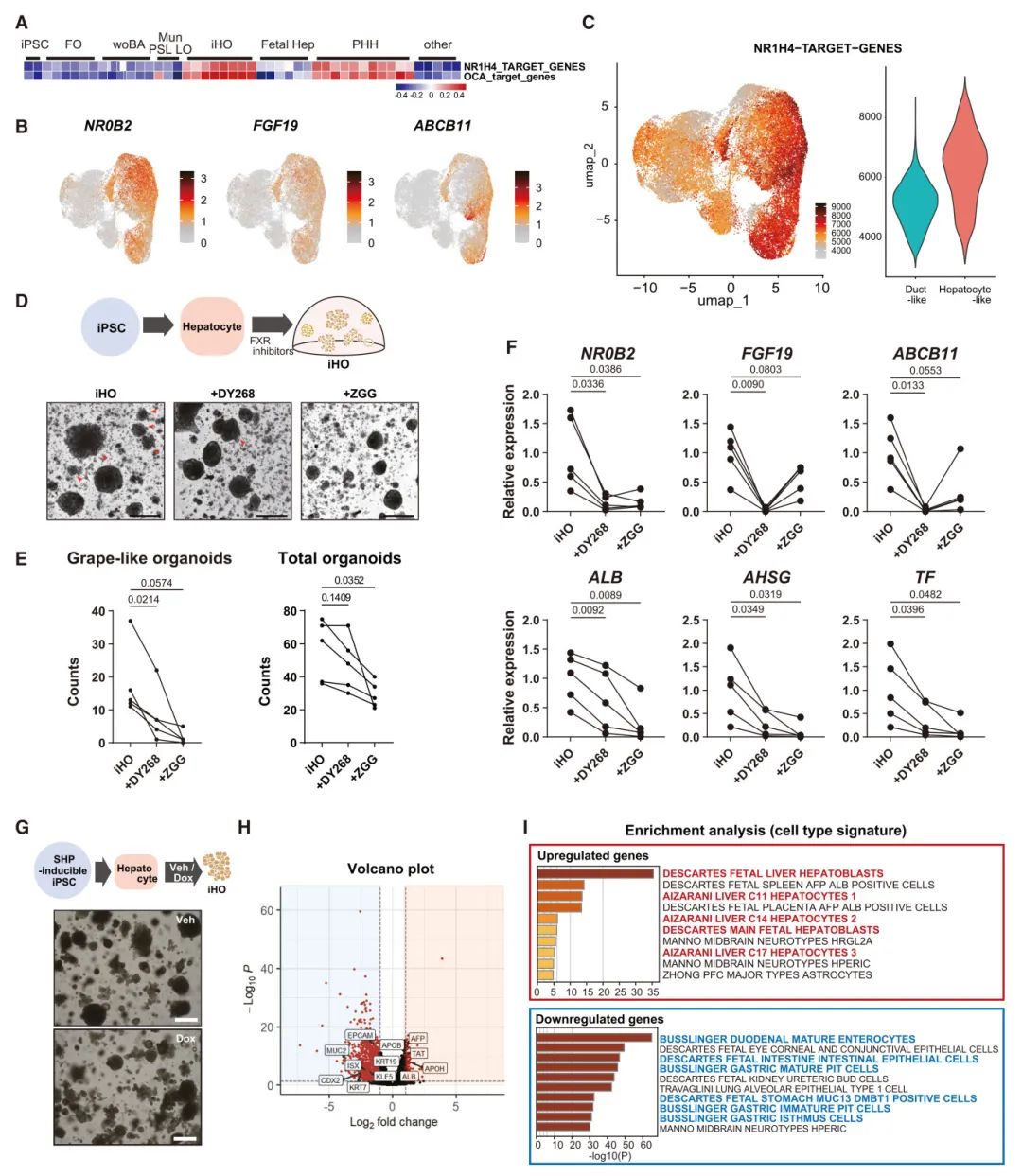
图7 iHOs中肝特性的维持依赖于胆汁酸-FXR信号
本研究成功建立了iPSC衍生肝脏类器官(iHO)系统,通过增强FXR信号,实现了携带肝细胞样特性的类器官长期培养。研究结果表明,胆酸-FXR信号促进iHO产生和肝特性的长期维持,这两个状态通常被认为是相互排斥的。利用全面的功能分析,研究者证明iHO与生理胎肝细胞表型密切相似,并包含一群在保持肝特性的同时能够增殖的细胞。此外,研究还证明了增强的FXR信号在iHO中促进葡萄状类器官的形成,并且SHP的过表达抑制非肝基因表达。
这种iHO系统具有维持肝特性和支持长期培养的独特能力,为再生医学和作为慢性肝病模型(包括肝癌发生研究)提供了巨大的潜力。从临床应用角度看,能够长期维持肝细胞特性的类器官系统可以为药物测试、疾病建模和潜在的肝脏组织工程提供宝贵的平台。通过这种方法培养的iHO不仅维持了肝特性,而且显示出增殖能力,这是传统肝细胞培养系统面临的主要挑战。此外,研究确定的胆酸-FXR-SHP信号通路为进一步优化肝器官培养提供了分子机制,这可能导致更成熟、功能更完善的肝组织体外模型的开发。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:揭示复杂的病毒宿主相互作用和推进治疗发展的创新工具-巨噬细胞增强类器官