常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-10-15 09:08:30 细胞资源库平台 访问量:164
肠道病毒感染是全球公共卫生领域的重大挑战,每年造成大量的发病率和死亡率。轮状病毒是全球范围内导致两百多万儿童住院的主要原因,也是儿童腹泻相关死亡的首要病因。肠道病毒(如回声病毒)虽然很少导致肠道疾病,但通常会在传播到其他部位后引起临床疾病。而非肠道病毒如SARS-CoV-2和季节性冠状病毒OC43主要感染呼吸系统,但也能侵入肠道并引起胃肠道症状。
病毒入侵后常激活宿主先天免疫应答,干扰素介导的应答作为对抗病毒感染的普遍性一线防御机制,会导致数百种干扰素刺激基因(ISGs)的转录以抵抗感染。炎症反应作为另一种宿主保护机制,涉及免疫细胞清除入侵病原体。然而,这种反应必须在不再需要时及时终止,以防止组织损伤。在严重急性病毒感染期间,这种反馈机制的失调可能导致病理性炎症。不同类型的病毒病原体协调不同的病毒-宿主相互作用特征,进而影响感染过程和临床结果。
在肠道病毒感染中,严重的临床结果通常涉及局部或全身性炎症,以及肠道中的病毒复制。巨噬细胞,特别是由浸润单核细胞分化的巨噬细胞,在协调这种病理性炎症中发挥关键作用。巨噬细胞可以形成多种炎症小体,其中NLRP3炎症小体与病毒感染的识别特别相关。此外,肠道中的微生物组产生大量代谢物,一些特定的肠道代谢物已知会通过抑制或加剧病理性炎症来影响局部和全身性病毒感染。
对于患有严重病毒感染的患者,病毒传播和由此产生的炎症同时导致死亡率和发病率。然而,治疗病毒性疾病的一线疗法主要基于抗病毒方案,仅抑制病毒。以COVID-19为例,常用的抗病毒药物奈玛特韦尔通常无法有效治疗重症患者。近期证据表明,将抗病毒疗法与抗炎类固醇药物结合可能会在SARS-CoV-2感染患者中取得更好的效果。
研究病毒病理生理学和开发先进治疗方法需要强大的实验模型。3D培养的肠道类器官为研究肠道疾病开辟了新途径。然而,这些类器官主要是上皮结构,本质上缺乏免疫组分,虽然能支持病毒生命周期,但无法捕捉复杂的病毒-宿主相互作用,特别是免疫细胞介导的宿主反应。肠道粘膜不仅排列有上皮细胞,还拥有最大的免疫细胞区,如巨噬细胞。这些免疫细胞和上皮细胞之间的相互作用对抵抗肠道病毒感染和维持肠道稳态至关重要。
近期,四川大学华西医院李鹏飞团队发布在Nature communications期刊,题为Macrophage-augmented intestinal organoids model virus-host interactions in enteric viral diseases and facilitate therapeutic development的研究揭示巨噬细胞增强类器官(macrophage-augmented organoids,MaugOs)是研究复杂的病毒宿主相互作用和推进治疗发展的创新工具。
1,巨噬细胞增强的肠道类器官的建立与表征。研究人员开发了巨噬细胞增强的肠道类器官(MaugOs),通过将人类巨噬细胞整合到原代肠道类器官中,以同时模拟病毒感染和由此产生的炎症反应。他们使用回声病毒1型、回声病毒6型、轮状病毒、季节性冠状病毒OC43和新型冠状病毒SARS-CoV-2作为疾病模型。这些病毒都能有效地在MaugOs中传播并刺激宿主抗病毒应答。通过优化细胞活力和生物学功能,他们采用相对较低浓度的Matrigel基质,随后将巨噬细胞和类器官碎片接种在基质表面,使它们能够在24小时内物理迁移并整合形成MaugOs。研究人员通过光学成像、免疫荧光和免疫组织化学染色进一步观察了MaugOs的形态。堆叠Z维度图像显示巨噬细胞整合到类器官的多个层次中,而非仅仅围绕表面。基因组转录组测序分析显示,MaugOs表达了9,400多个与巨噬细胞或类器官相共有的基因,另有90多个基因专属于MaugOs,表明巨噬细胞和类器官之间存在主动交互作用。为评估MaugOs产生炎症反应的功能,研究人员用细菌脂多糖(LPS)处理MaugOs,发现THP-1衍生的巨噬细胞对LPS刺激有显著反应,而类器官则无明显反应。重要的是,MaugOs能对LPS刺激产生强烈的炎症反应,大多数测试的炎症基因在刺激后1小时至12小时内上调。此外,研究人员还建立了使用不同来源巨噬细胞的MaugOs:从外周血单核细胞分离的原代巨噬细胞,以及从人诱导多能干细胞(iPSCs)生成的单核细胞分化的巨噬细胞。这些MaugOs同样能有效响应LPS刺激,显示炎症基因显著活化。
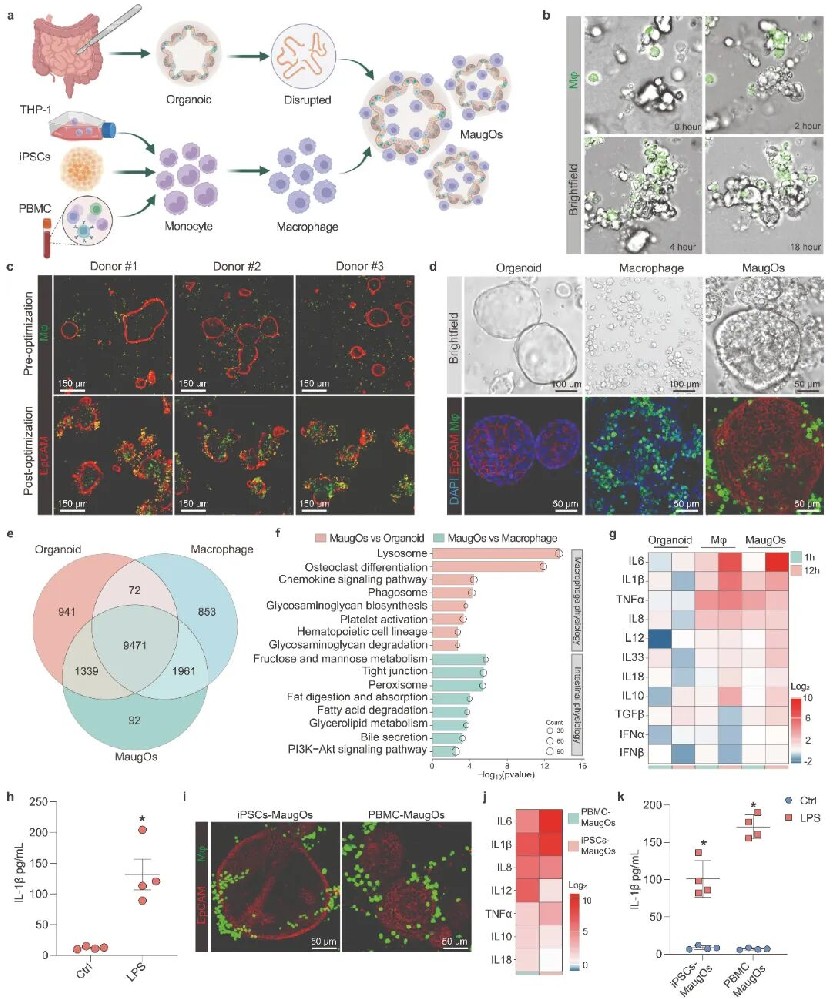
图1 巨噬细胞增强肠类器官的建立及表征
2,MaugOs对不同肠道病毒的感染及反应。研究人员首先测试了两种肠道病毒—回声病毒1型(EV1)和回声病毒6型(EV6),这两种病毒主要通过粪-口途径传播并在生命周期早期感染肠道上皮。结果显示,类器官和THP-1巨噬细胞独立支持EV1和EV6的感染。两种回声病毒感染触发了类器官中显著的抗病毒反应,但在THP-1巨噬细胞中,回声病毒未能引起明显的炎症反应。在MaugOs中,EV1和EV6能有效复制,并且引发了强烈的抗病毒反应,但炎症反应有限。随后,研究人员评估了MaugOs对轮状病毒和冠状病毒OC43感染的反应。轮状病毒在MaugOs中持续复制,并通过TCID50测定法显示培养上清液中有显著的感染性病毒产生。有趣的是,免疫染色轮状病毒VP6蛋白显示病毒从最初感染的类器官传播到相邻巨噬细胞。轮状病毒感染触发了抗病毒ISGs的显著表达和温和的炎症反应。类似地,冠状病毒OC43在MaugOs中有效复制,但与轮状病毒相比,OC43病毒能够引发更强烈的抗病毒和炎症反应。
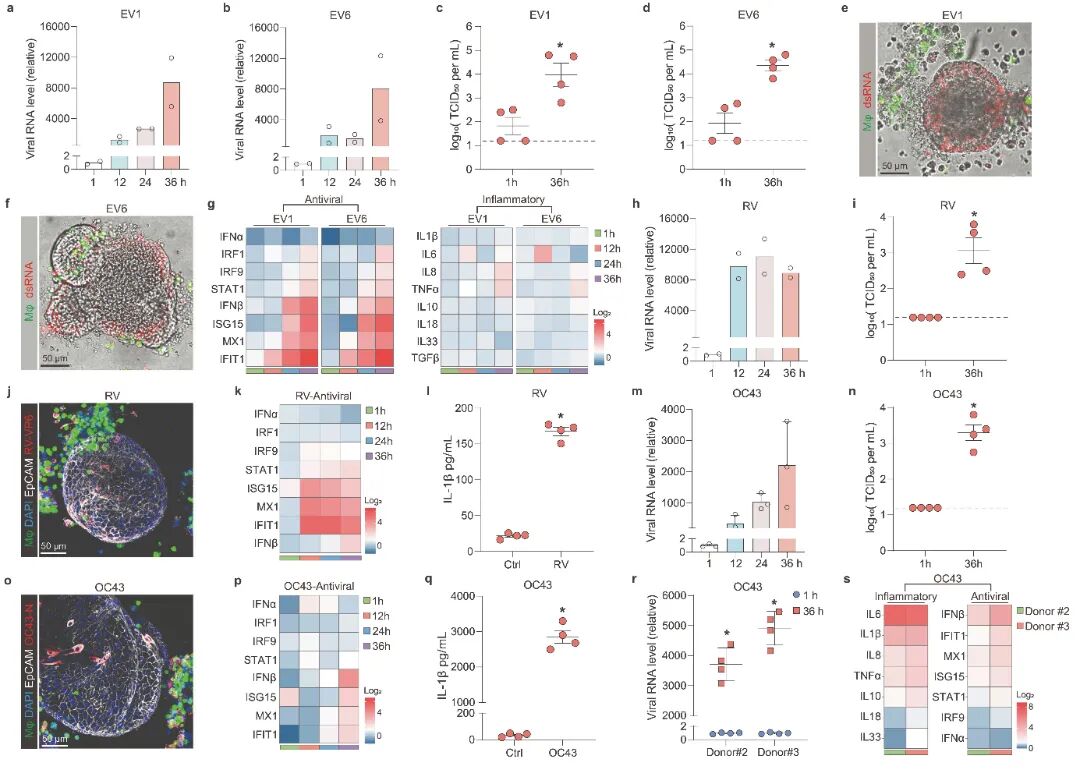
图2 MaugOs回顾了肠道病毒感染和病毒-宿主相互作用
3,复杂病毒-宿主相互作用的表征。为进一步表征病毒-宿主相互作用,研究人员选择冠状病毒OC43和回声病毒EV1作为疾病模型,对感染和非感染的THP-1巨噬细胞、类器官和整合的MaugOs进行了全基因组转录组分析。RNA测序映射了EV1和OC43病毒基因组片段的读数,揭示了这些模型中的强烈病毒感染。主成分分析(PCA)明显区分了感染和非感染的类器官和MaugOs,表明OC43感染后上调的基因主要是与炎症相关的基因和抗病毒ISGs,而EV1主要激活抗病毒ISGs并下调肠道生理相关基因。研究人员进一步探究了OC43病毒在MaugOs中的NLRP3炎症小体激活。OC43病毒刺激NF-κB途径活化,介导NLRP3和前IL-1β的转录,随后激活的NLRP3炎症小体诱导caspase-1自激活,导致前IL-1β裂解和成熟IL-1β的分泌。西方印迹法证明了NLRP3、前IL-1β和前caspase-1细胞内水平随时间增加,以及裂解的IL-1β和裂解的caspase-1在上清液中分泌。此外,抗病毒元件如磷酸化STAT1、IRF-9、PKR和磷酸化eIF2α也被OC43显著激活。
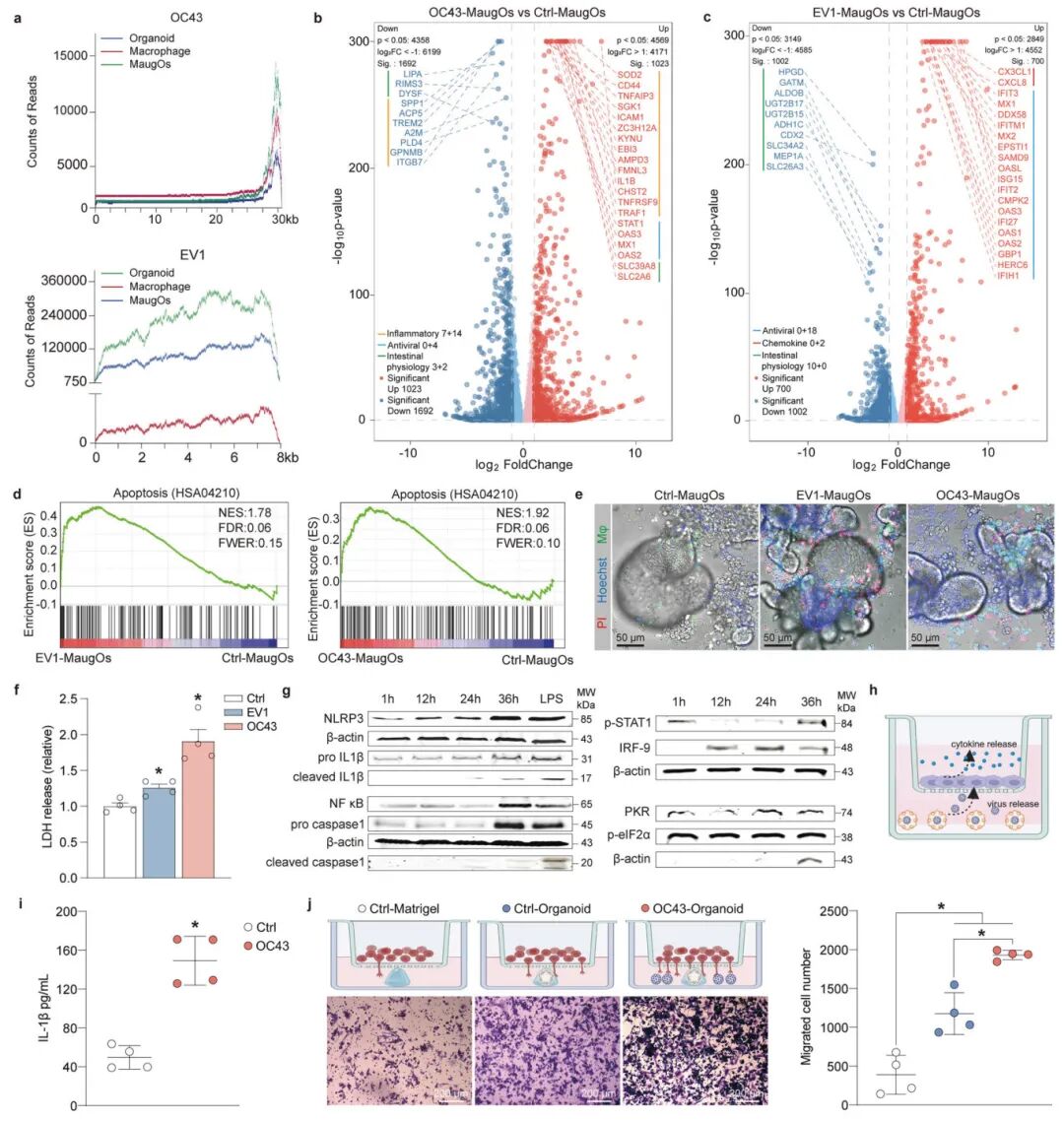
图3 描述MaugOs中复杂的病毒-宿主相互作用
4,分化型类器官构建的MaugOs对病毒感染的反应。肠道类器官来源于肠隐窝底部的干细胞,这些干细胞可以进一步分化为不同的上皮细胞类型。研究人员使类器官向肠细胞、杯状细胞和肠内分泌细胞方向分化。在5天分化培养后,类器官呈现出较暗的外观和较厚的壁。特定细胞标记物的基因表达,如绒毛蛋白(肠细胞)、黏蛋白2(杯状细胞)和嗜铬粒蛋白A(肠内分泌细胞)在三种分化类器官中显著上调。免疫荧光染色证实了分化类器官中更多的肠细胞、杯状细胞和肠内分泌细胞。研究发现,OC43病毒感染在整合了未分化或肠细胞分化类器官的MaugOs中激活了强烈的炎症基因表达,而在整合了杯状细胞或肠内分泌细胞分化类器官的MaugOs中激活的炎症基因表达较弱。类似地,在整合了未分化或肠细胞分化类器官的MaugOs中,OC43感染引发了一系列ISGs的激活,而整合了杯状细胞或肠内分泌细胞分化类器官的MaugOs几乎不对感染产生抗病毒反应。这些差异可能与不同分化类器官对OC43病毒的敏感性不同有关,OC43病毒RNA水平在整合了杯状细胞或肠内分泌细胞分化类器官的MaugOs中显著低于未分化类器官。
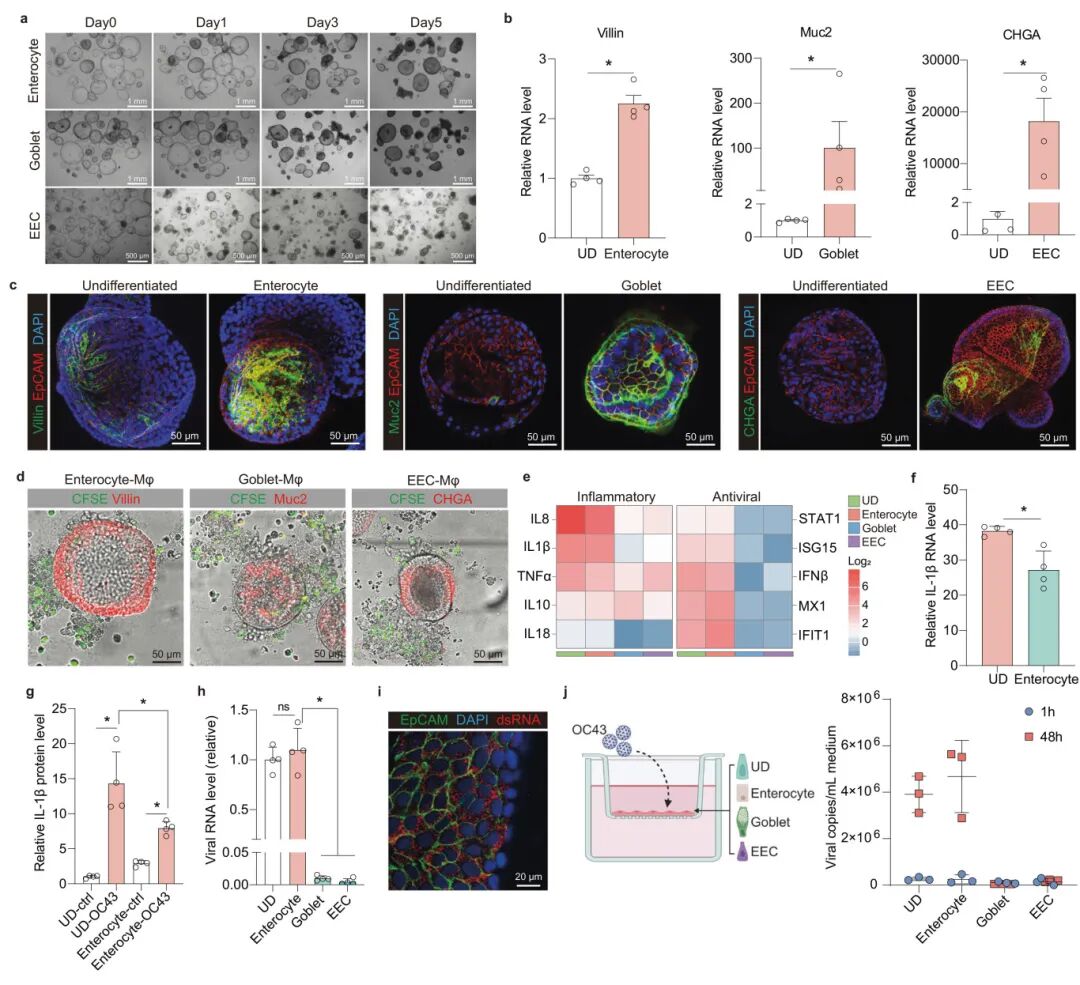
图4 利用差异化的肠道类器官建立MaugOs
5,乙酸对病毒感染和炎症反应的多效性作用。短链脂肪酸(SCFAs)是一组典型的微生物代谢物,对肠道稳态有显著影响。研究人员测试了乙酸、丙酸和丁酸对LPS诱导的MaugOs中的炎症反应的作用。与丙酸和丁酸相比,乙酸对炎症基因表达的抑制作用最强,显著阻断了所有测试炎症基因的上调,且无细胞毒性。同样,乙酸处理也显著抑制了OC43病毒或轮状病毒诱导的炎症反应。此外,严重肠道病毒感染常伴随继发性细菌感染,共同导致病理性炎症。研究人员通过同时用细菌LPS和冠状病毒OC43刺激MaugOs模拟这一情景,发现这导致了协同的炎症反应增强,而乙酸仍然能有效抑制这种增强的炎症反应。在分别分析乙酸对不同MaugOs组分中病毒感染的作用时,研究发现乙酸处理显著促进了类器官中的病毒复制,但抑制了THP-1巨噬细胞中的病毒复制,这种差异导致乙酸对MaugOs中的病毒复制有轻微抑制作用。转录组分析表明,乙酸处理上调了抗炎M2巨噬细胞相关基因和通路,下调了促炎M1巨噬细胞相关基因和通路,表明巨噬细胞在乙酸处理后从M1向M2转变。
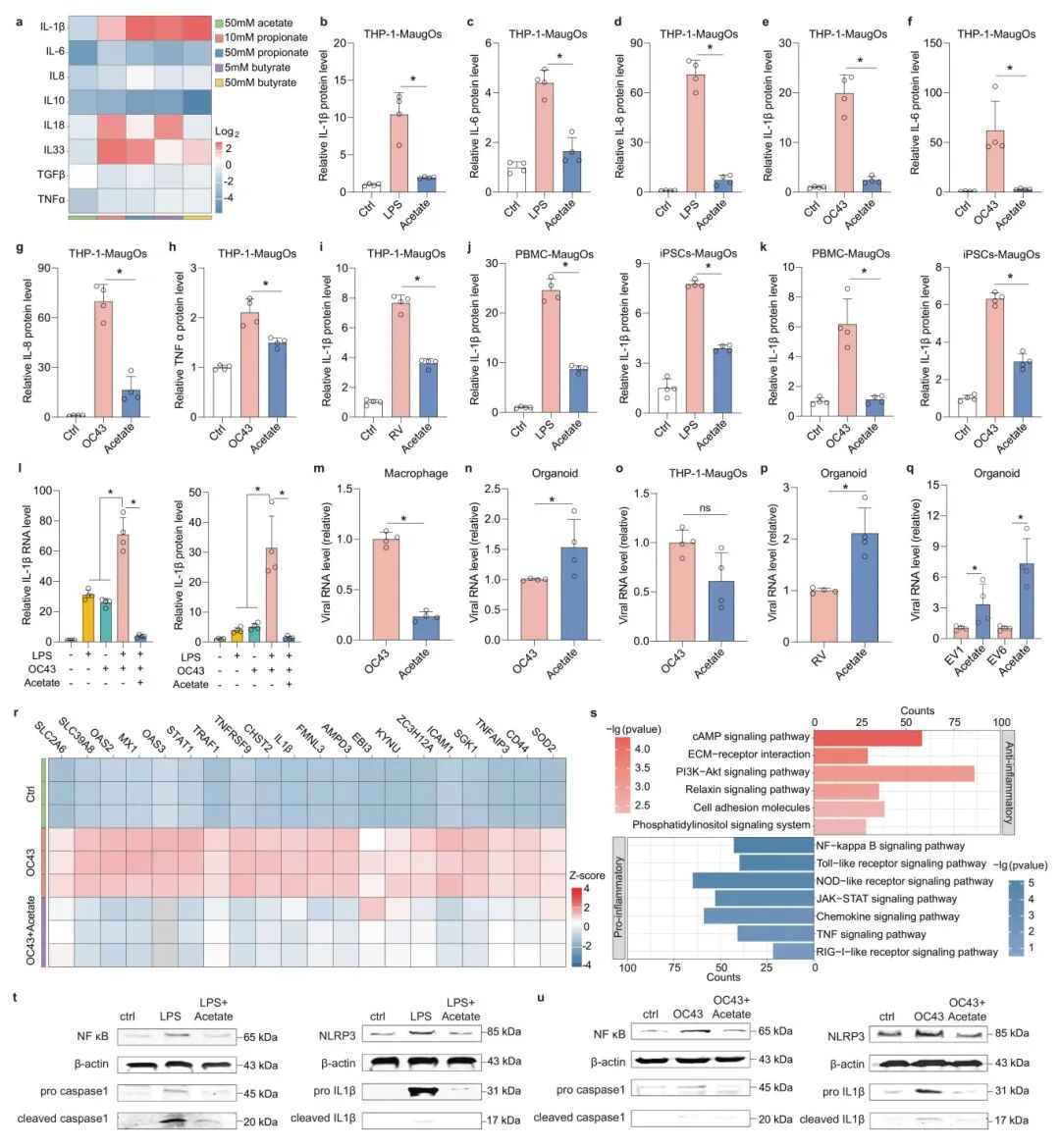
图5 表征乙酸对MaugOs肠道病毒感染和炎症反应的作用
6,肠道病毒疾病治疗策略的开发。为确定有效的抗炎药物用于治疗肠道病毒感染,研究人员筛选了10种临床使用的免疫抑制剂。结果显示,三种经典类固醇(泼尼松龙、地塞米松和布地奈德)显著减弱了IL-1β表达,但促进了病毒复制。随后,研究人员评估了抗病毒药物奈玛特韦尔的效果,该药物能完全抑制OC43在MaugOs中的复制,但进一步增强了OC43激活的IL-1β和NF-κB蛋白水平。为提供概念验证,研究人员评估了布地奈德和奈玛特韦尔联合治疗冠状病毒OC43感染的效果。这种联合治疗方案导致病毒复制和IL-1β表达同时被抑制。同样,将乙酸与奈玛特韦尔联合使用也显著抑制了OC43复制和IL-1β表达及分泌。此外,与单独的抗病毒治疗相比,乙酸和奈玛特韦尔的联合治疗上调了抗炎通路和肠道生理相关通路,下调了促炎相关通路。最后,研究人员验证了这些治疗方案在SARS-CoV-2感染模型中的效果。MaugOs支持SARS-CoV-2的有效传播,而奈玛特韦尔处理显著阻断了SARS-CoV-2复制但促进了炎症反应。将奈玛特韦尔与布地奈德或乙酸联合使用可以有效抑制SARS-CoV-2感染和并发的炎症反应。
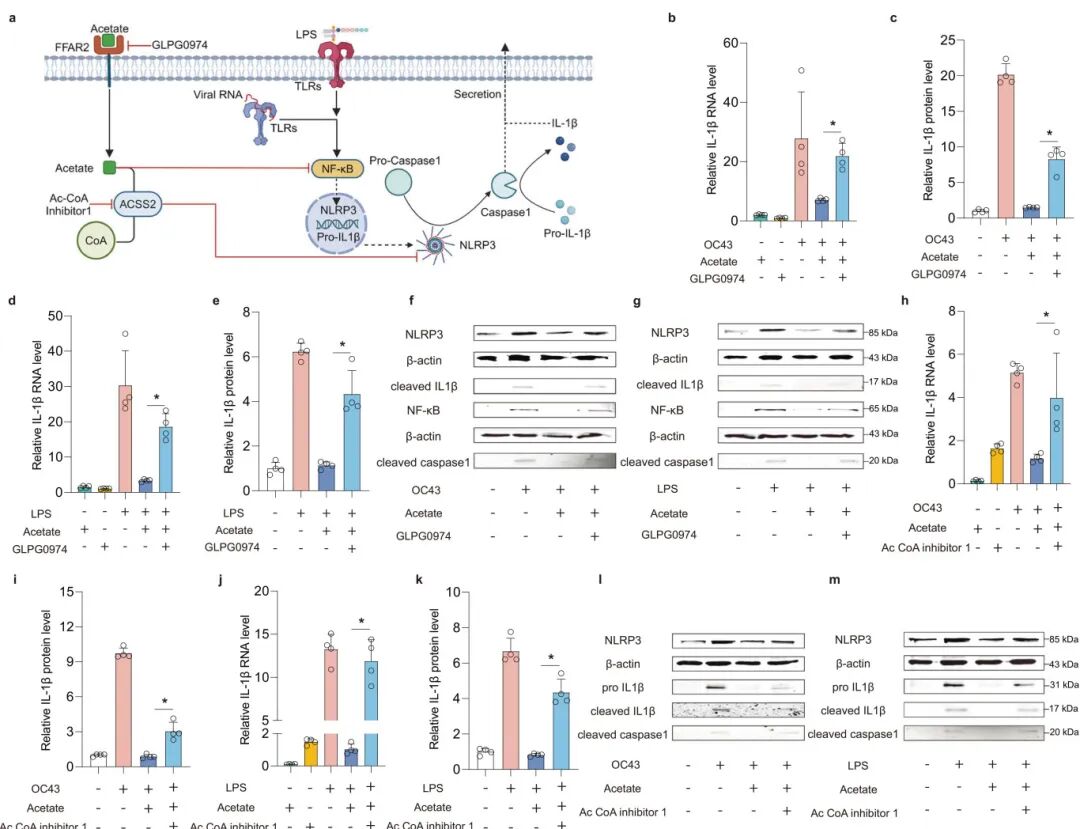
图6 剖析乙酸在肠道感染中的抗炎作用机制
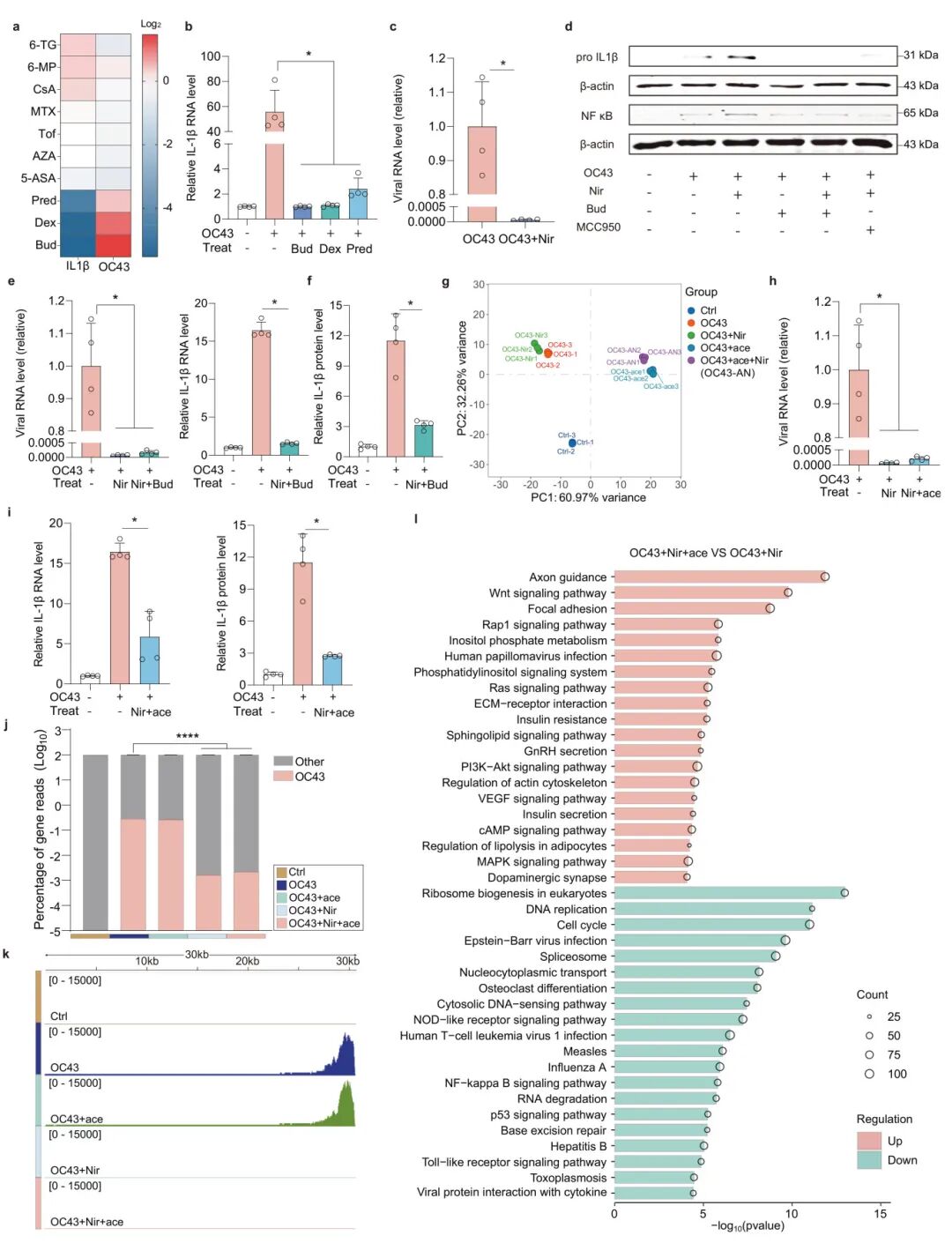
图7 MaugOs对肠道病毒感染的联合治疗
本研究建立了巨噬细胞增强的肠道类器官(MaugOs)模型,并证明该模型能有效地重现不同肠道病毒感染引起的复杂病毒-宿主相互作用。这种创新的体外模型整合了肠道上皮细胞和免疫细胞,能够同时模拟病毒感染和炎症反应,这是传统类器官所不能实现的。MaugOs能支持多种病毒的复制并模拟病毒从肠道上皮到免疫细胞的传播,这类似于自然感染过程中病毒首先穿透上皮屏障然后与免疫细胞相互作用的情况。此外,研究通过全基因组转录组分析揭示了组织和巨噬细胞之间的主动相互作用,证明MaugOs具有研究复杂病毒-宿主相互作用的潜力。
研究发现乙酸对病毒感染和炎症反应有多效性作用,它对不同细胞类型中的病毒复制有差异性影响,并且能显著抑制炎症反应。这一发现为利用微生物代谢物调节肠道炎症提供了新思路。此外,研究提出了联合抗病毒和抗炎治疗的概念,证明将奈玛特韦尔与布地奈德或乙酸联合使用可以同时抑制病毒复制和炎症反应,这对于严重的肠道病毒感染治疗具有重要意义。总之,这项研究不仅建立了一个新的体外模型用于研究肠道病毒感染的病理生理学,还为开发针对肠道病毒疾病的先进治疗策略奠定了基础,特别是强调了联合抗病毒和抗炎治疗的潜力,这对于未来应对新兴和重新出现的病毒威胁具有重要价值。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:乳腺癌细胞系与类器官模型揭示肿瘤异质性及药物反应多样性
下一篇:胆酸-FXR信号通路促进人源诱导多潜能干细胞衍生肝脏类器官的肝特性长期维持