常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-10-10 17:10:30 细胞资源库平台 访问量:174
阿尔茨海默病(AD)是全球最常见的痴呆症类型,影响超过5500万人,目前治疗手段有限。AD的主要病理特征包括细胞外淀粉样β(Aβ)斑块、细胞内tau神经纤维缠结、神经炎症、突触/神经元丢失和大脑萎缩。尽管动物模型在AD研究中发挥了重要作用,但由于人类与动物之间存在显著的物种差异,许多在动物模型中成功的治疗方法在临床试验中失败,这凸显了开发更贴近人类病理的AD模型的紧迫性。此外,目前大多数AD模型集中在家族性AD(fAD),而散发性AD(sAD)占所有AD病例的95%以上,且缺乏明确的致病基因突变,相关模型极为有限。
2025年5月2日,发表在Molecular Psychiatry上题为Alzheimer's disease patient brain extracts induce multiple pathologies in novel vascularized neuroimmune organoids for disease modeling and drug discovery的研究开发了一种基于人多能干细胞(hPSC)的血管化神经免疫类器官模型,包含人类AD大脑中受影响的多种细胞类型,如神经元、小胶质细胞、星形胶质细胞和血管。研究发现,将散发性AD患者的脑组织提取物暴露于类器官中,可在四周内诱导多种AD病理特征,包括Aβ斑块样聚集、tau缠结样聚集、神经炎症、突触/神经元丢失以及神经网络活动受损。此外,通过蛋白质组学分析揭示了类器官中与AD相关的失调通路。研究还发现,经过FDA批准的抗Aβ抗体药物Lecanemab能够显著降低类器官中的淀粉样蛋白负荷,但同时可能引发血管炎症反应。
1,血管化神经免疫类器官的生成与表征。通过共培养人多能干细胞(hPSC)衍生的神经祖细胞(NPCs)、原始巨噬细胞祖细胞(PMPs)和血管祖细胞(VPs),在3D条件下成功生成了包含多种细胞类型的类器官。免疫组织化学染色确认了PAX6+/NESTIN+神经祖细胞、CD235+/CD43+造血祖细胞样细胞、CD31+内皮细胞和PDGFRβ+周细胞的存在,以及NeuN+成熟神经元、MAP2+神经元树突、S100β+星形胶质细胞和IBA1+/CD45+小胶质细胞的形成。这些结果表明,类器官成功整合了多种细胞类型,模拟了人类大脑的复杂环境,为研究阿尔茨海默病(AD)病理提供了基础。
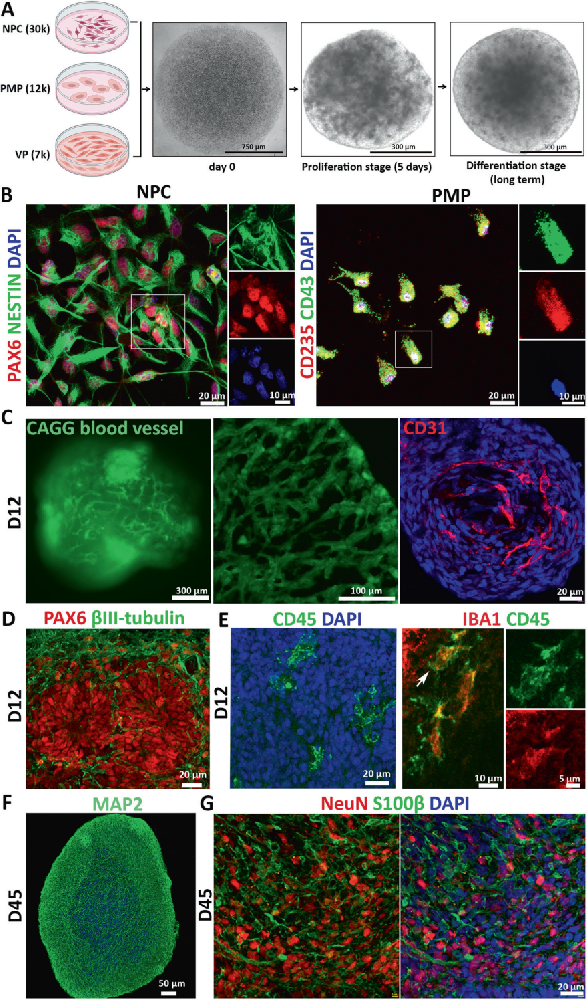
图1展示了血管化神经免疫类器官的构建过程。
2,散发性AD患者脑提取物诱导Aβ病理。研究人员将AD脑提取物暴露于类器官中,发现两周后类器官内出现神经元内Aβ聚集,四周后发展出6E10+和4G8+胞外Aβ斑块样聚集物。这些聚集物与硫黄素S染色阳性,表明形成了β折叠结构的蛋白质聚集物。定量分析显示,与对照组相比,AD组的Aβ负荷显著增加。这些结果表明,AD脑提取物中的Aβ种子能够在类器官中诱导Aβ病理,模拟AD患者大脑中的Aβ病理特征。
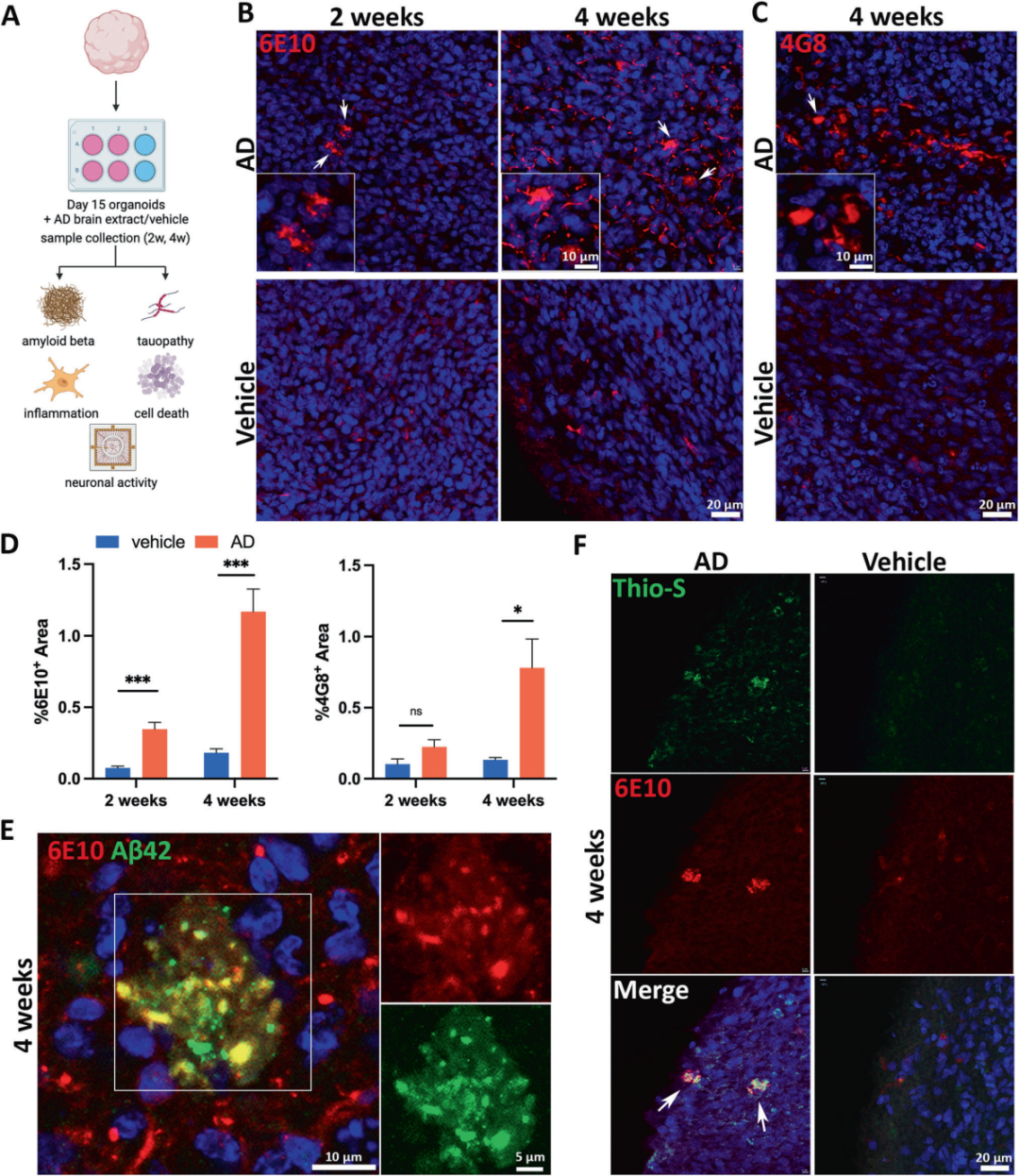
图2展示了散发性AD患者脑提取物在类器官中诱导Aβ病理的过程。
3,散发性AD患者脑提取物诱导tau病理。在AD脑提取物暴露两周后,类器官中观察到点状AT8+神经元内信号,四周后信号显著增强,表明形成了tau聚集物。通过AT8与pThr217双染色以及Gallyas银染色进一步确认了神经纤维缠结样结构的形成。这些结果表明,AD脑提取物中的tau种子能够在类器官中诱导tau病理,模拟AD患者大脑中的tau病理特征。
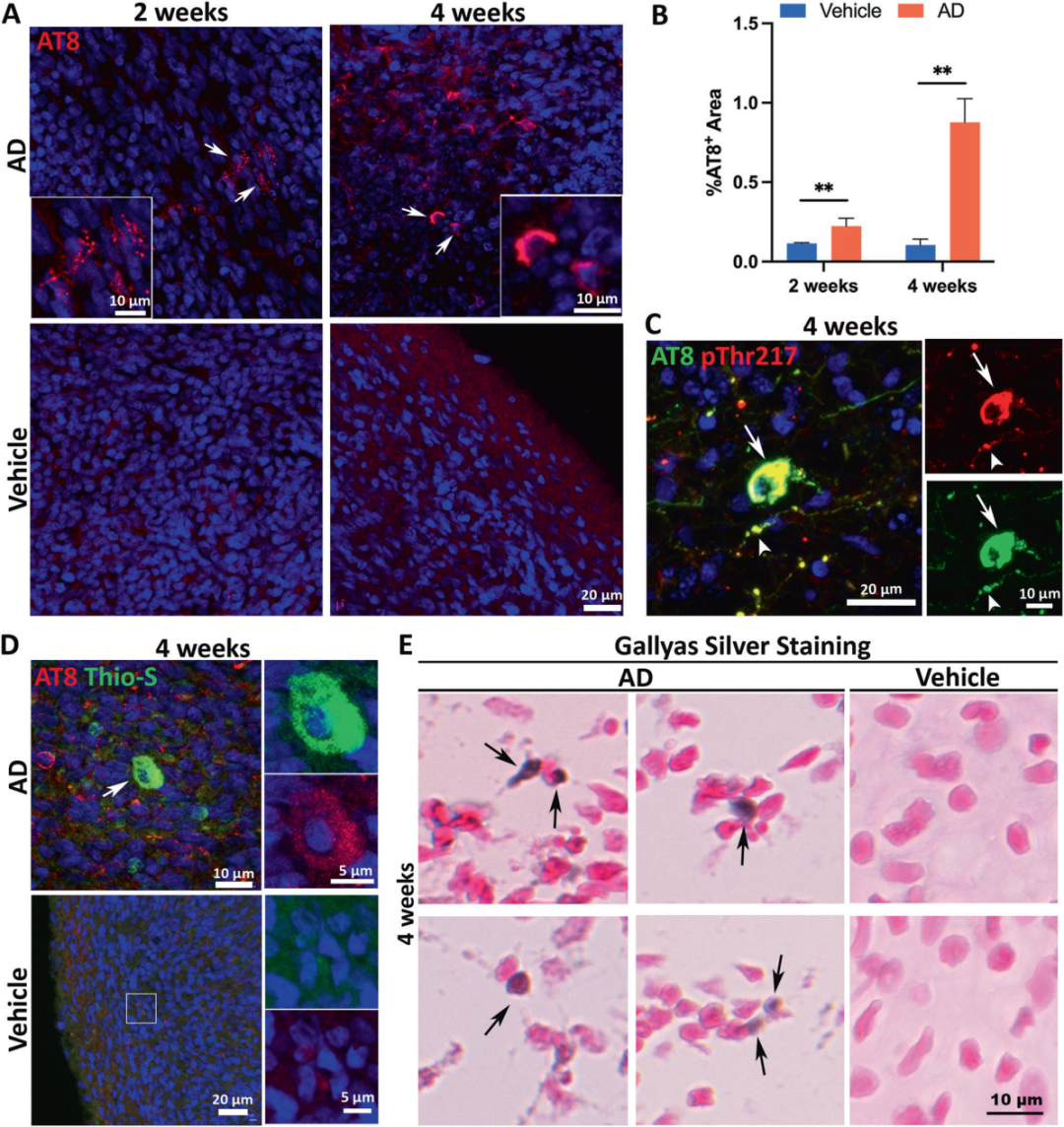
图3展示了散发性AD患者脑提取物在类器官中诱导tau病理的过程。
4,AD神经免疫类器官复现神经炎症和小胶质细胞功能。研究人员发现,暴露于AD脑提取物后,类器官中IL-6和CCL2的mRNA表达水平显著升高,表明存在神经炎症反应。三维重建图像显示,小胶质细胞可以吞噬Aβ,同时在AD组中观察到小胶质细胞内Homer1(突触后标记物)体积显著增加,表明小胶质细胞对突触的吞噬作用增强。这些结果表明,AD神经免疫类器官能够复现神经炎症和小胶质细胞的病理功能,模拟AD患者大脑中的炎症和突触修剪异常。
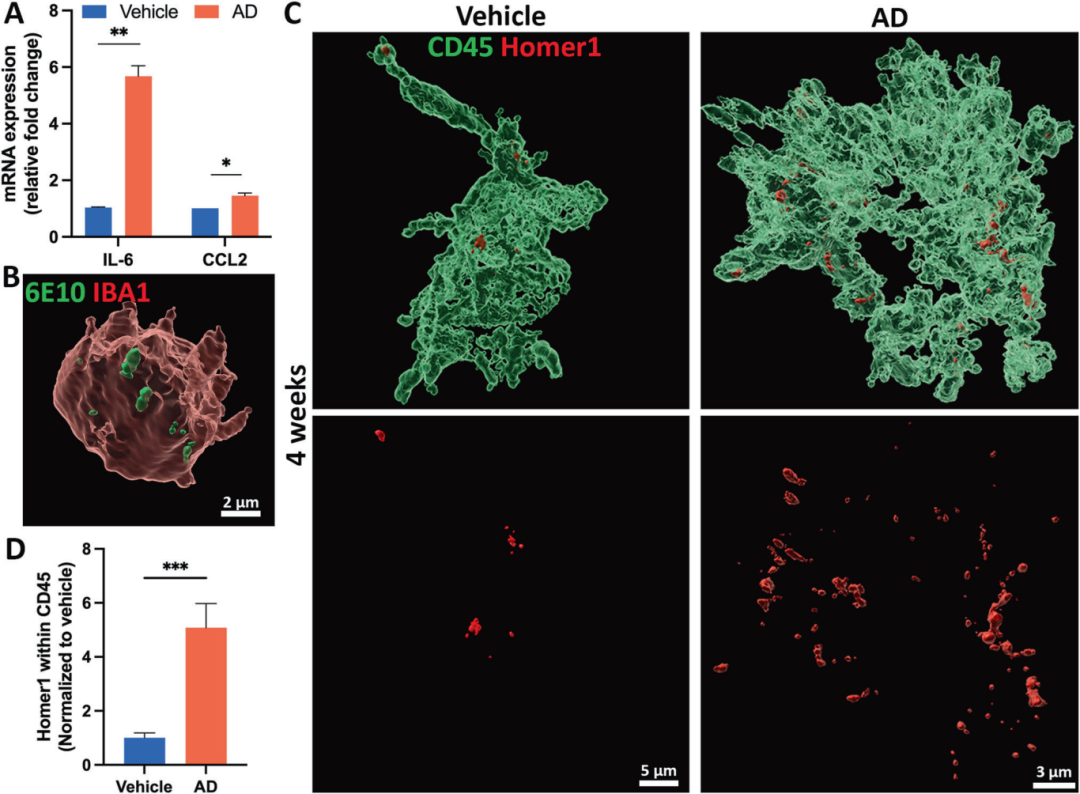
图4展示了AD神经免疫类器官复现神经炎症和小胶质细胞功能的过程。
5,AD神经免疫类器官复现突触/神经元损失和神经网络活动受损。定量分析显示,与对照组相比,AD组中每2500 μm²区域内Homer1点的数量减少,表明存在突触损失。同样,AD组中活性Caspase3+细胞显著增加,表明神经元死亡增加。微电极阵列(MEA)分析显示,AD组中神经放电数量、平均放电率和爆发次数减少,表明神经网络活动受损。这些结果表明,AD神经免疫类器官能够复现突触/神经元损失和神经网络活动受损,模拟AD患者大脑中的神经退行性变化。
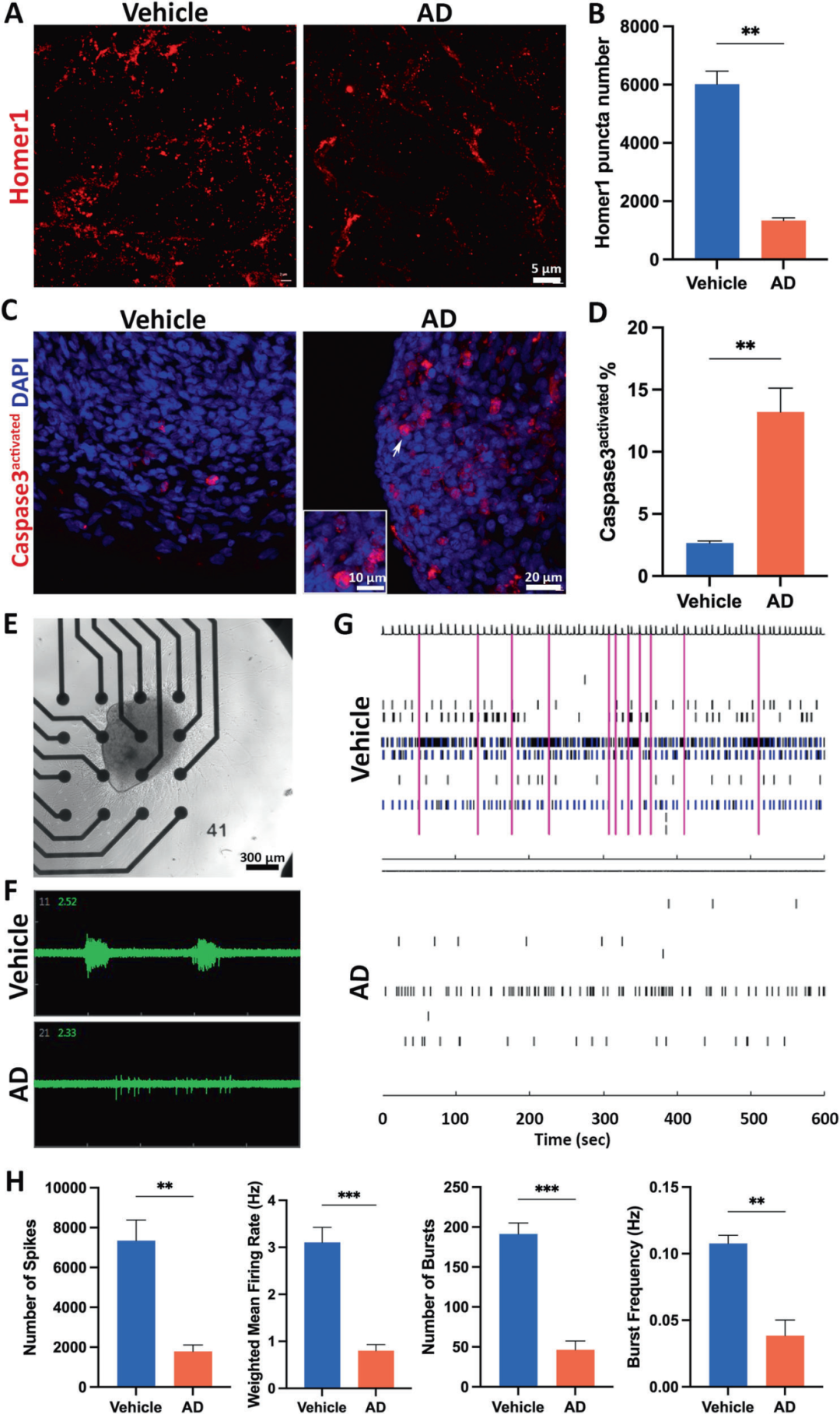
图5展示了AD神经免疫类器官复现突触/神经元损失和神经网络活动受损的过程。
6,蛋白质组学分析揭示AD神经免疫类器官中扰乱的通路。与对照组相比,AD类器官中鉴定出87个差异表达蛋白(DEPs),包括76个上调和11个下调蛋白。上调的DEPs中包括CD44、GFAP和MAPT等先前在AD人脑组织中被认为是潜在生物标志物的蛋白。KEGG富集分析表明,上调的DEPs富集在囊泡转运中的SNARE相互作用、突触囊泡循环、阿尔茨海默病、黏附连接和神经退行性疾病通路等,与AD患者的分子特征一致。这些结果表明,AD神经免疫类器官成功复现了AD患者大脑中的分子病理特征。
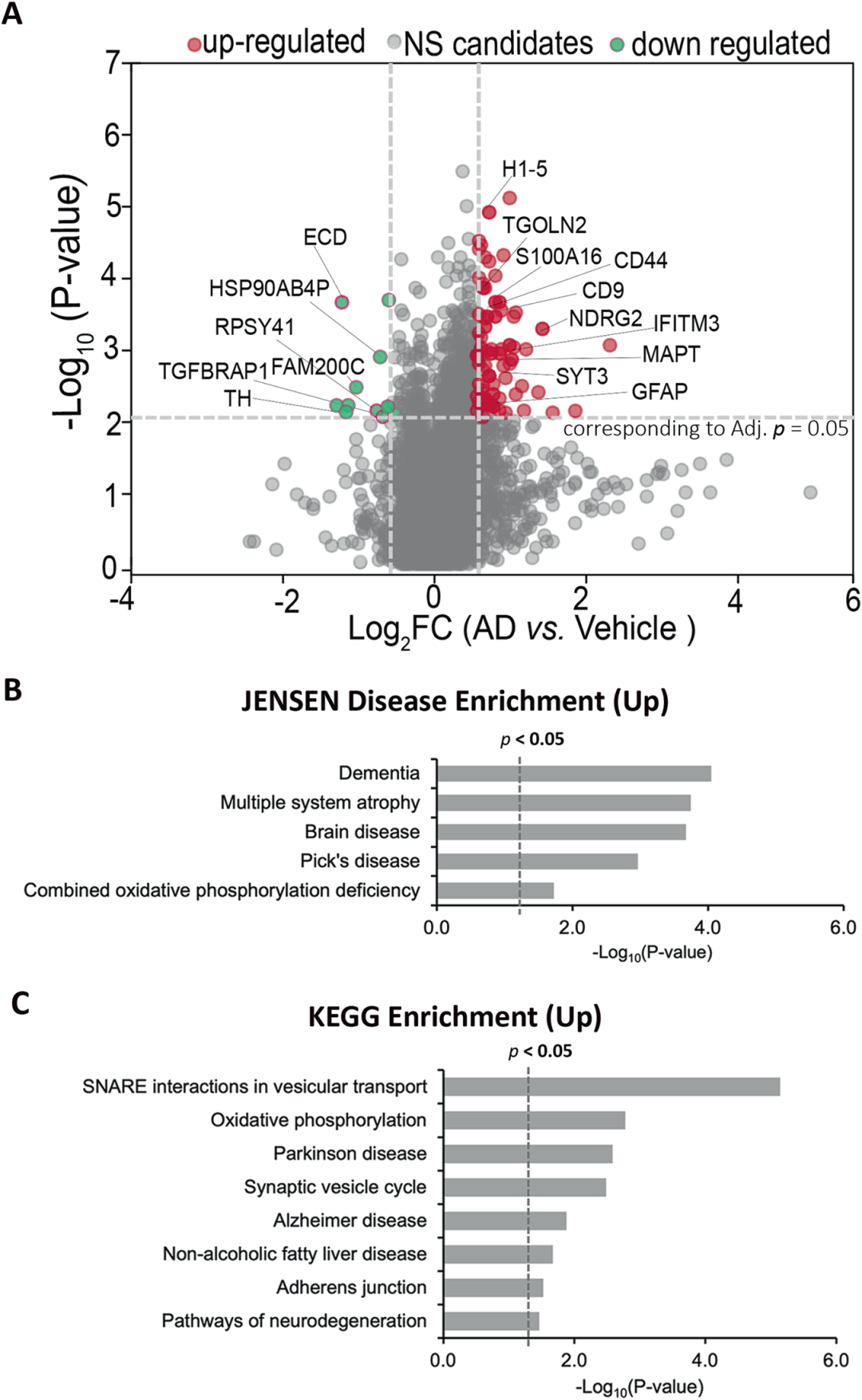
图6展示了蛋白质组学分析揭示AD神经免疫类器官中扰乱的通路。
7,抗Aβ抗体Lecanemab在AD神经免疫类器官中的应用。研究人员在暴露于AD脑提取物四周后的类器官中给予Lecanemab治疗两周,观察到淀粉样蛋白负担显著减轻,同时小胶质细胞对Aβ的吞噬作用增加。有趣的是,Lecanemab治疗组的类器官表现出血管炎症反应增强(VCAM-1 mRNA表达水平升高)和血管完整性潜在破坏(VE-Cadherin mRNA表达趋于下调),这可能与临床上观察到的与淀粉样蛋白相关的成像异常(ARIA)副作用相关。这些结果表明,类器官模型不仅能够用于评估AD药物的疗效,还能够模拟药物的潜在副作用。
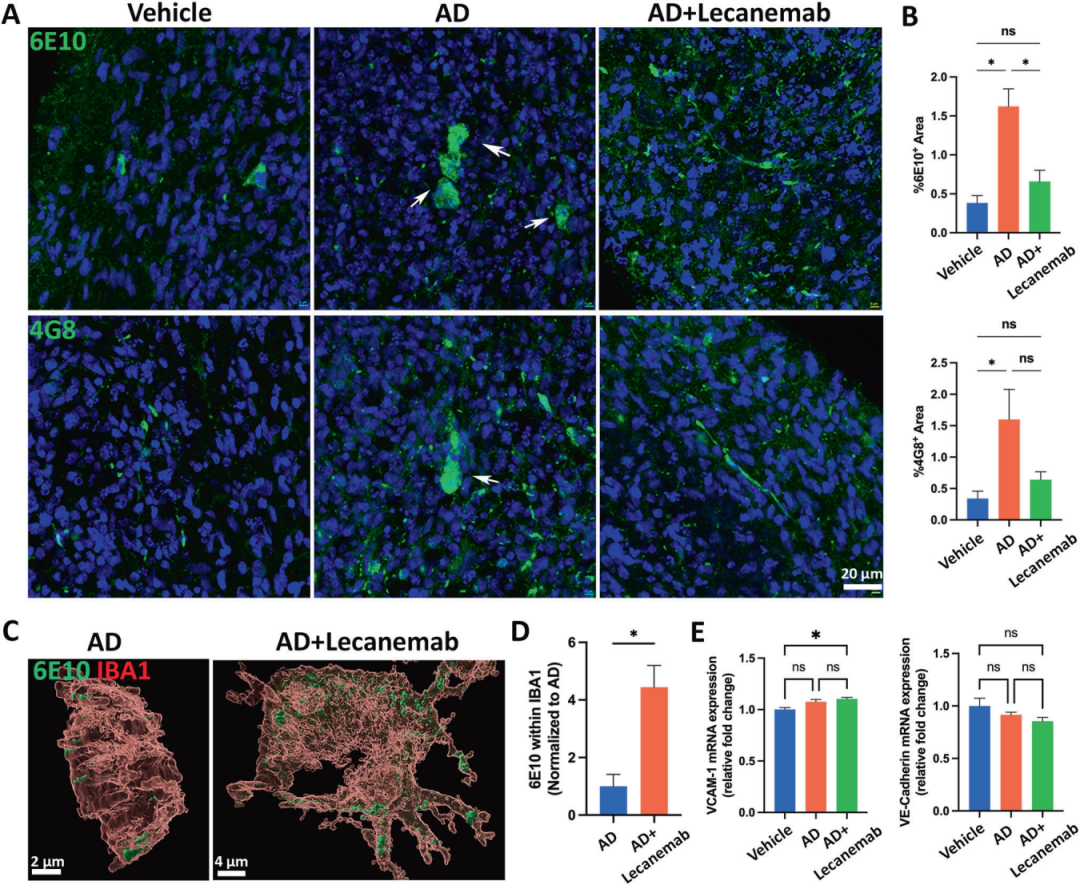
图7展示了抗Aβ抗体Lecanemab在AD神经免疫类器官中的应用。
该研究开发的血管化神经免疫类器官模型成功整合了多种受AD影响的关键细胞类型,包括神经元、小胶质细胞、星形胶质细胞和血管细胞,构建了一个病理生理相关的3D人类细胞环境。该模型可在4周内诱导出多种AD病理特征,包括Aβ斑块、tau缠结、神经炎症、突触/神经元丢失及神经网络活动受损,为研究AD病理相互作用提供了高效平台。此外,该模型还成功验证了抗Aβ抗体Lecanemab的疗效及其潜在副作用,为AD药物开发尤其是免疫疗法提供了重要工具。研究还发现,Aβ和tau等致病性种子可在类器官中传播并引发类似AD的病理变化,支持了其朊病毒样特性。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:延长 I 型干扰素信号!THP-1 报告细胞系助力疫苗辅佐剂筛选
下一篇:WNT和SHH梯度在类器官中的人脑区域分化及细胞系差异