常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-10-05 09:25:22 细胞资源库平台 访问量:182
肿瘤谱系可塑性(LP)是癌症进展的一个新兴标志,其特征是表达与早期发育细胞谱系相似的独特基因程序,是治疗抵抗和疾病复发的主要机制。前列腺癌(PCa)在初始诊断时大多为雄激素受体(AR)阳性腺癌,AR通路抑制剂(ARPIs)被广泛用于治疗。然而,大多数患者的肿瘤最终会对这些治疗产生抵抗力,转分化为更具侵袭性的神经内分泌前列腺癌(NEPC),其中治疗诱导的NEPC(t-NEPC)占去势抵抗性前列腺癌(CRPC)的20%-30%,原发性NEPC则较为罕见。目前,NEPC尚无有效治疗方法。
近日,发表在Acta Pharmaceutica Sinica b上题为Effective therapeutic targeting of tumor lineage plasticity in neuroendocrine prostate cancer by BRD4 inhibitors的研究通过药理学方法探究了表观遗传调节因子在前列腺癌细胞和类器官中的功能,发现BRD4是关键因子。
BRD4属于BET蛋白家族,含有两个bromodomain(BD1和BD2),对于识别乙酰化组蛋白和非组蛋白蛋白以及招募转录因子激活基因表达至关重要。研究揭示了BRD4直接激活了数百个与LP相关的基因,包括神经发生、轴突发生、干细胞和EMT等基因程序,以及关键驱动因子如BRN2、ASCL1等。此外,研究还发现BRD4的基因组占据位点在ARPI治疗下被重新编程,从而激活LP程序,并且这一过程受到先驱因子FOXA1的促进。重要的是,研究证实BRD4抑制剂AZD5153在治疗NEPC方面具有显著的潜力,能够有效阻断肿瘤生长。
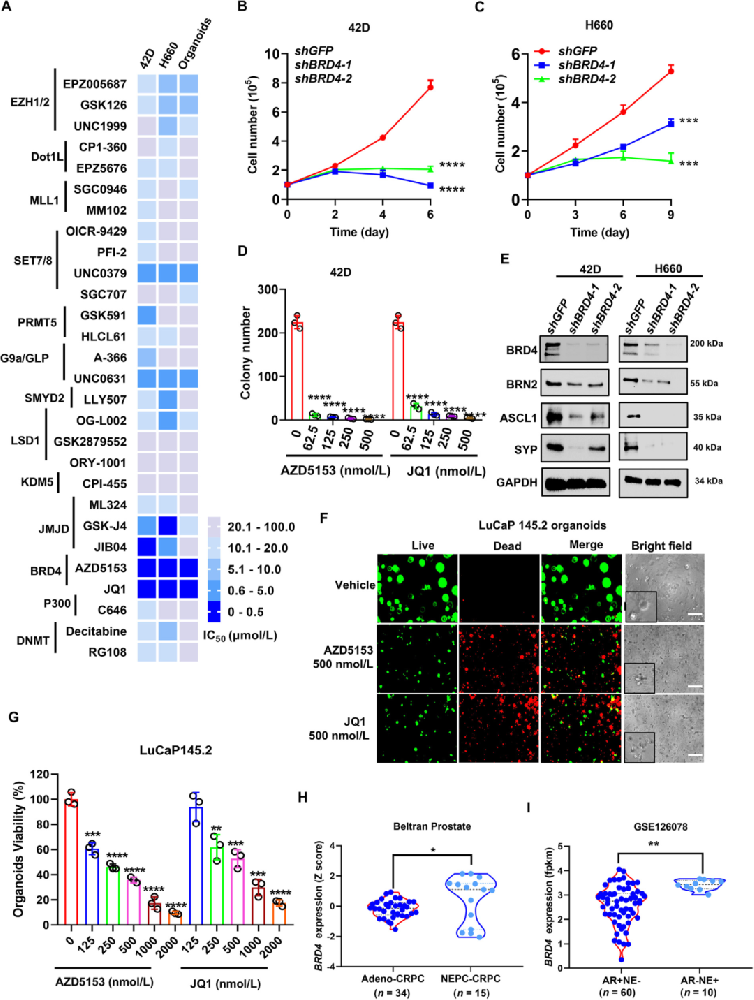
1) BRD4是NEPC细胞生长和存活的关键因子。研究者通过药理学方法探测前列腺癌细胞和类器官中表观遗传调节因子的功能,鉴定出bromodomain蛋白BRD4作为关键参与者。在t-NEPC 42D细胞、原发性NEPC H660细胞和PDX衍生类器官中,BRD4抑制剂AZD5153和JQ1显示出最强效的抑制作用,IC50低于500 nM。敲低BRD4强烈抑制了两种细胞的生长和存活,并显著抑制了NEPC驱动基因(POU3F2和ASCL1)和标志物(SYP)的表达。BRD4抑制剂AZD5153和JQ1以剂量依赖方式强效抑制了NEPC细胞的集落形成。两种NEPC PDX肿瘤衍生的类器官处理也表明,这两种BRD4抑制剂对类器官活力具有高度强效的抑制作用。与BRD4的关键作用一致,其表达在t-NEPC和原发性NEPC亚型中显著高于腺癌,且BRD4的高表达与前列腺癌患者的不良生存显著相关。
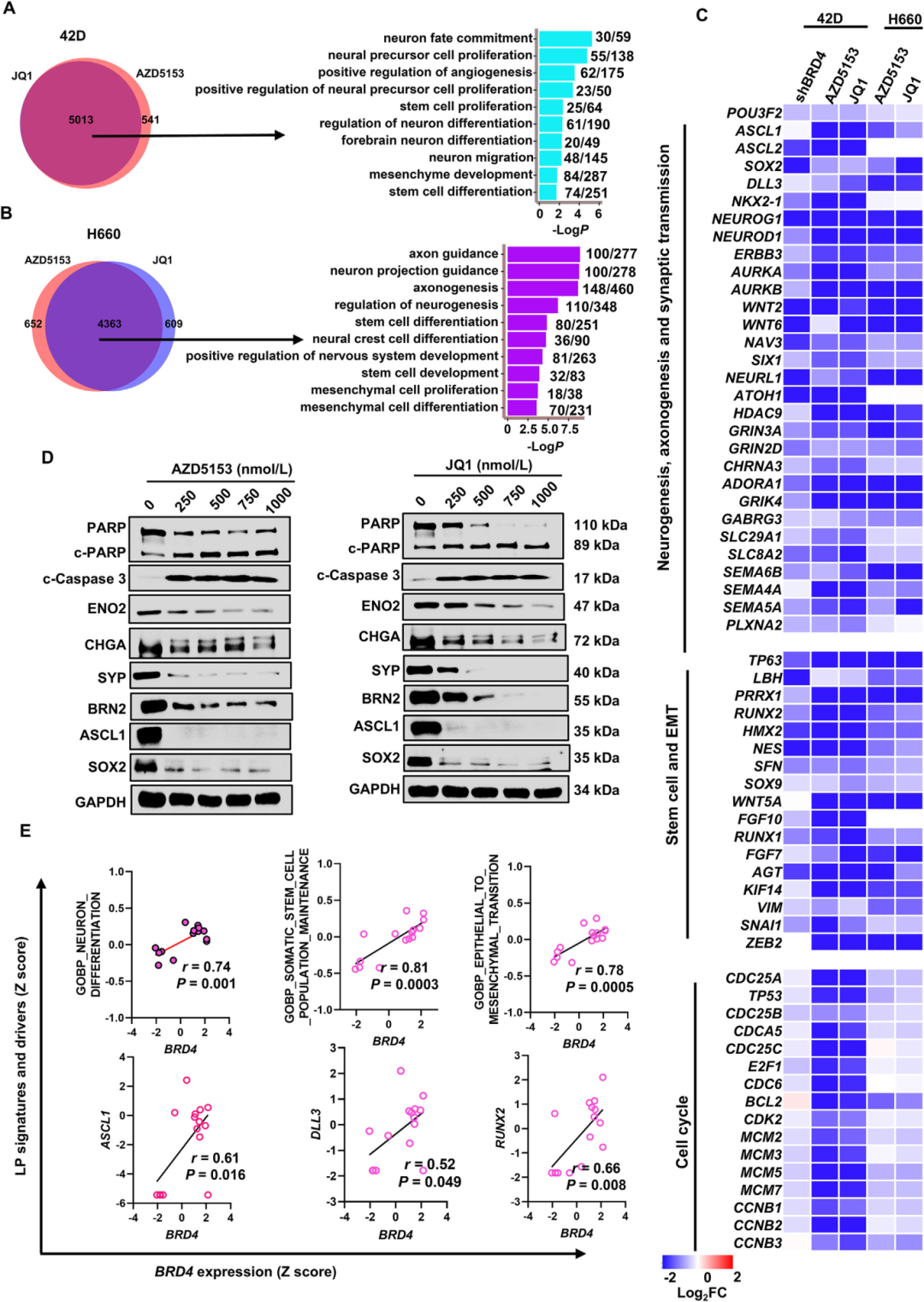
2) BRD4控制LP程序和NEPC关键驱动因子的诱导。为了理解BRD4在NEPC中的功能机制,研究者进行了RNA-seq分析,发现在敲低或抑制BRD4后,显著下调的基因(log2FC>1.5)富集在神经发生、干细胞和上皮间质转换(EMT)等LP程序中。AZD5153和JQ1下调的基因在t-NEPC 42D细胞和原发性NEPC H660细胞中高度重叠(近90%),表明两种化合物在两种NEPC细胞中作用高度相似。LP程序中的几个关键驱动基因如POU3F2、ASCL1/2、SOX2/9、SNAI1和RUNX1/2在BRD4敲低和药理抑制中共同减少。BRD4抑制剂强烈下调了LP驱动因子BRN2、ASCL1、SOX2、Snail、Slug和NEPC标志物SYP、ENO2和CHGA以及EMT标志物vimentin和claudin-1的蛋白表达。在临床肿瘤中,BRD4的表达与特定LP程序和驱动因子如ASCL1、DLL3和RUNX2的表达显著正相关。
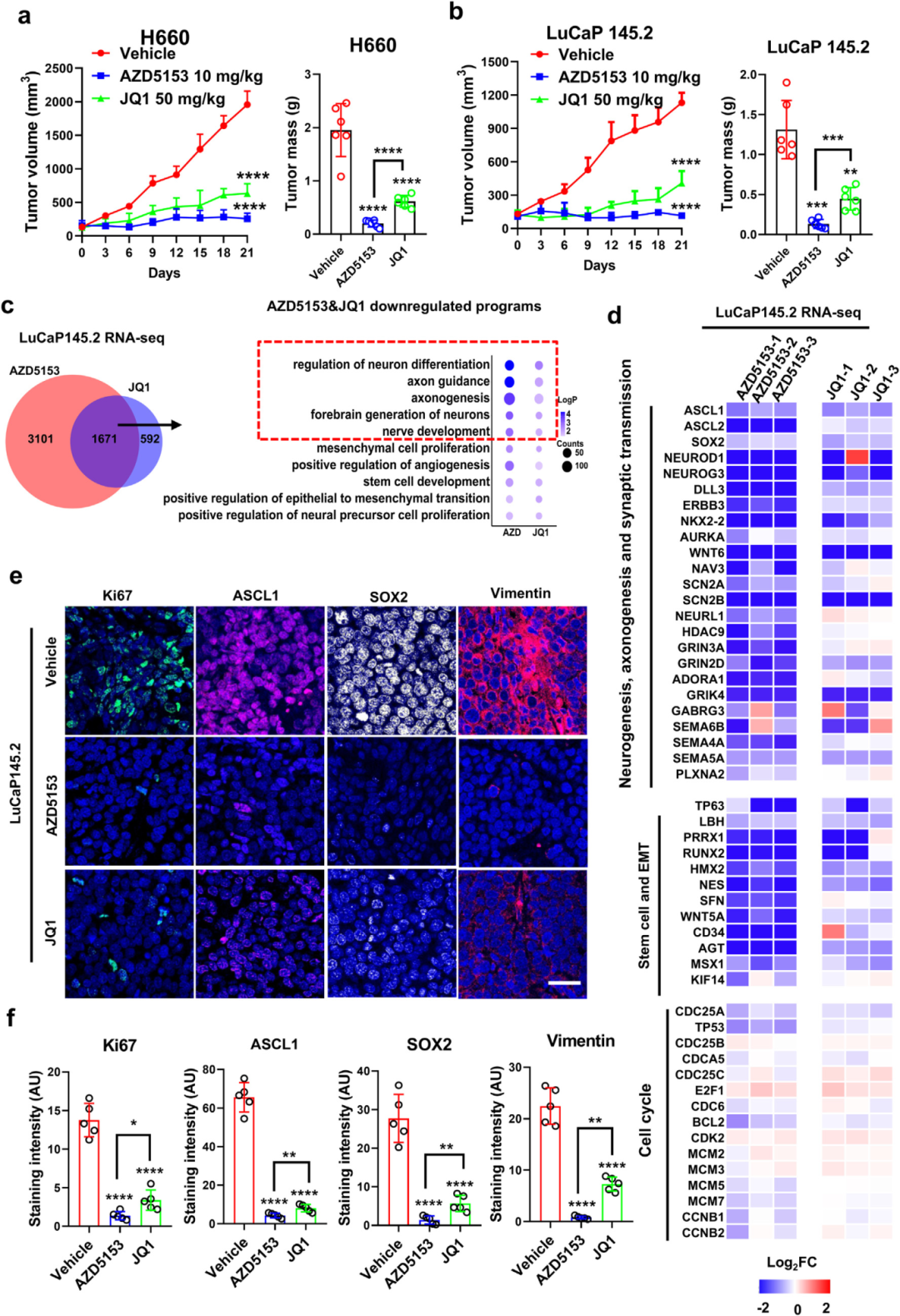
3) BRD4抑制剂AZD5153在体内抑制NEPC肿瘤生长和LP程序方面表现出高于JQ1的效力。研究者评估了BRD4抑制剂AZD5153和JQ1在几个恩杂鲁胺(ENZ)抵抗性NEPC模型中的治疗潜力。在两个原发性NEPC模型(H660异种移植和LuCaP145.2 PDX)中,相对较低剂量(10 mg/kg)的AZD5153腹腔给药足以实现对肿瘤生长的几乎完全阻断,而不对动物体重产生明显影响。然而,50 mg/kg的JQ1治疗虽然对肿瘤生长有强烈抑制,但未能完全阻断。在从CRPC模型LuCaP35CR发展而来的AR阳性、ENZ抵抗性PDX亚系中,AZD5153治疗在整个治疗过程中完全阻断了肿瘤生长。RNA-seq分析显示AZD5153和JQ1均下调了LP程序中基因的表达,但AZD5153在抑制LP程序(包括神经元分化调控、轴突发生和神经发育)方面表现出比JQ1更高的效力。
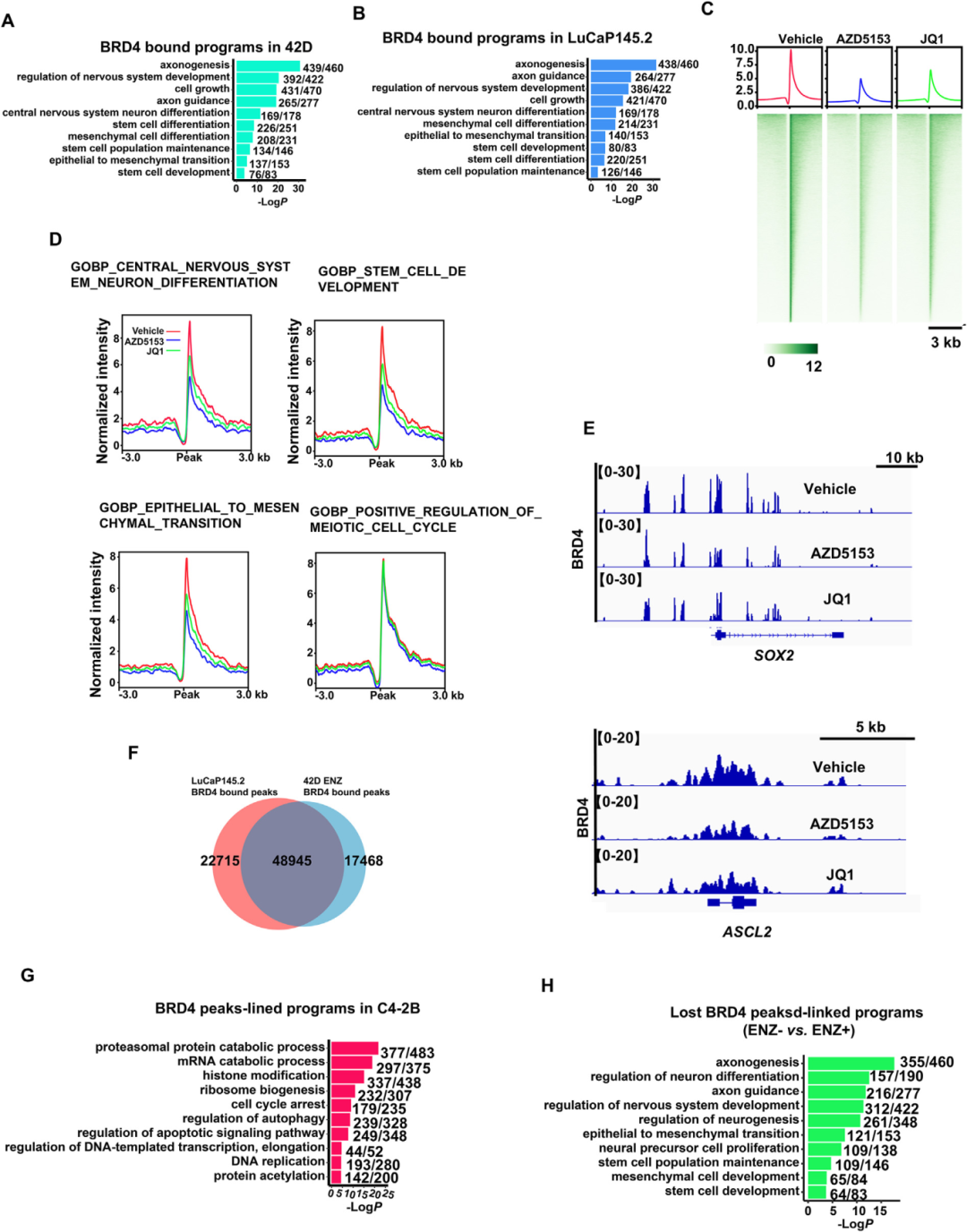
4) BRD4受ARPI药物重编程直接控制NEPC中的LP程序。研究者对BRD4在t-NEPC和原发性NEPC细胞及肿瘤中的结合位点(cistrome)进行ChIP-seq分析,发现在两种NEPC中,BRD4结合到LP程序中绝大多数基因(范围从85%到95%)。在t-NEPC 42D细胞中,BRD4结合到轴突发生程序中的439个基因(如POU3F2/BRN2和NKX2-1),神经系统发育调控中的329个基因(如SOX2、ASCL1和ASCL2),EMT中的137个基因和干细胞发育中的76个基因(如SOX9和VIM)。BRD4抑制剂,特别是AZD5153,强烈抑制了BRD4在LP程序上的结合。两个系统中约80%的BRD4峰重叠,并且它们与相同的LP程序相关,表明BRD4在t-NEPC和原发性NEPC中结合到相同的调控区域以控制LP程序。在CRPC细胞(C4-2B)中,BRD4 cistrome富集在细胞存活和细胞周期程序中,几乎没有结合到LP程序,表明BRD4在LP程序上的占据是NEPC进展中诱导的功能。
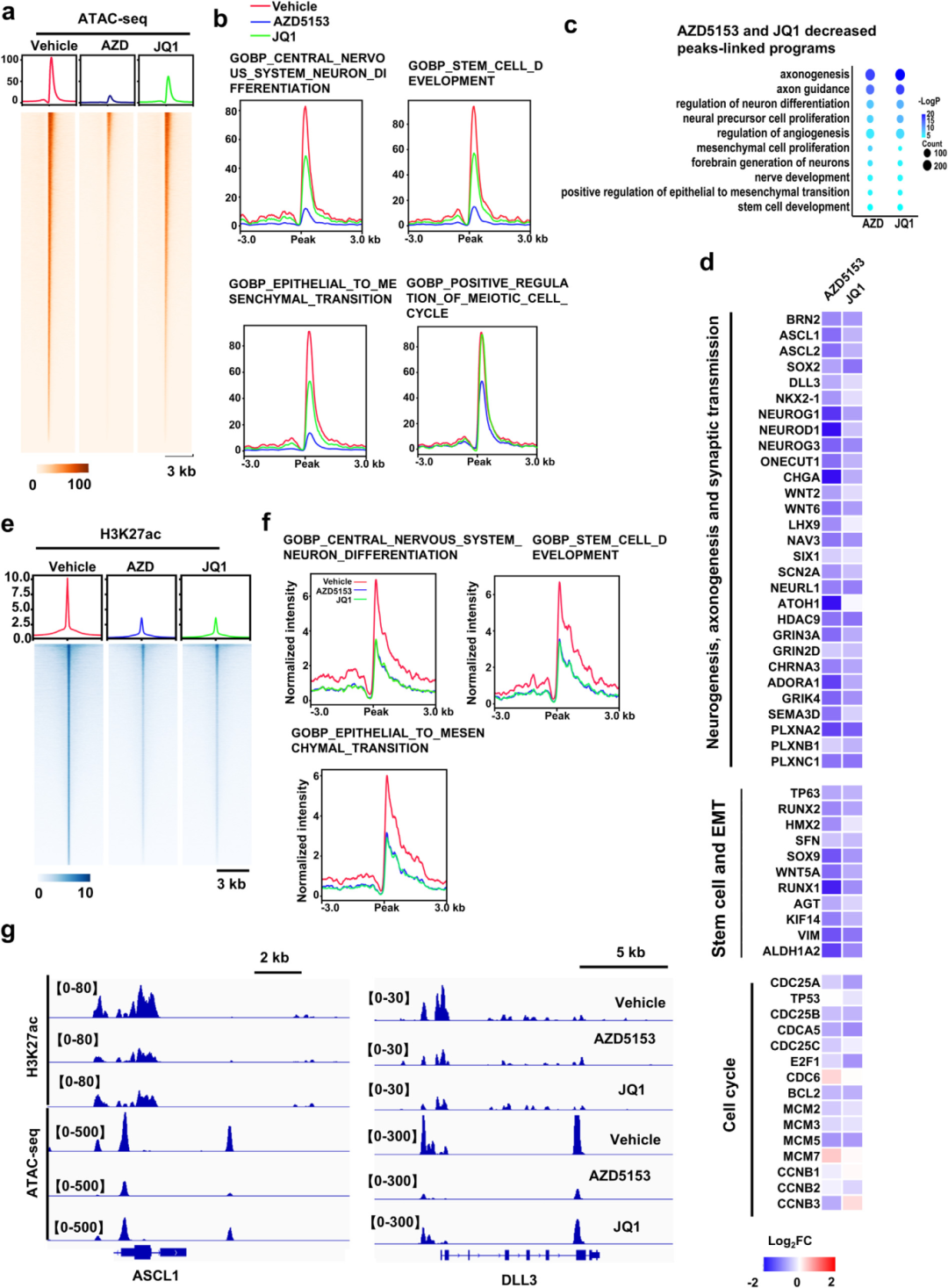
5) BRD4通过增加染色质可及性刺激LP程序。为了更好地理解BRD4在控制LP程序中的主导作用,研究者对BRD4抑制剂处理的肿瘤进行了ATAC-seq分析。两种抑制剂显著降低了局部染色质可及性。未经偏倚的分析表明,抑制剂优先降低了LP程序(如神经元分化、干细胞和EMT)的染色质可及性。AZD5153在降低LP程序(包括LP驱动因子ASCL1、RUNX2和SOX2)的局部染色质可及性方面表现出比JQ1更高的效力。BRD4在染色质上的一个功能是通过招募乙酰化酶如CBP/p300维持局部H3K27ac乙酰化。如预期的那样,两种BRD4抑制剂强烈降低了全基因组和LP程序中的H3K27ac标记。有趣的是,AZD5153和JQ1在降低H3K27ac方面显示出几乎相同的效力。这些结果表明,破坏BRD4结合和降低局部染色质可及性构成了AZD5153在体内抑制LP程序的主要作用机制。
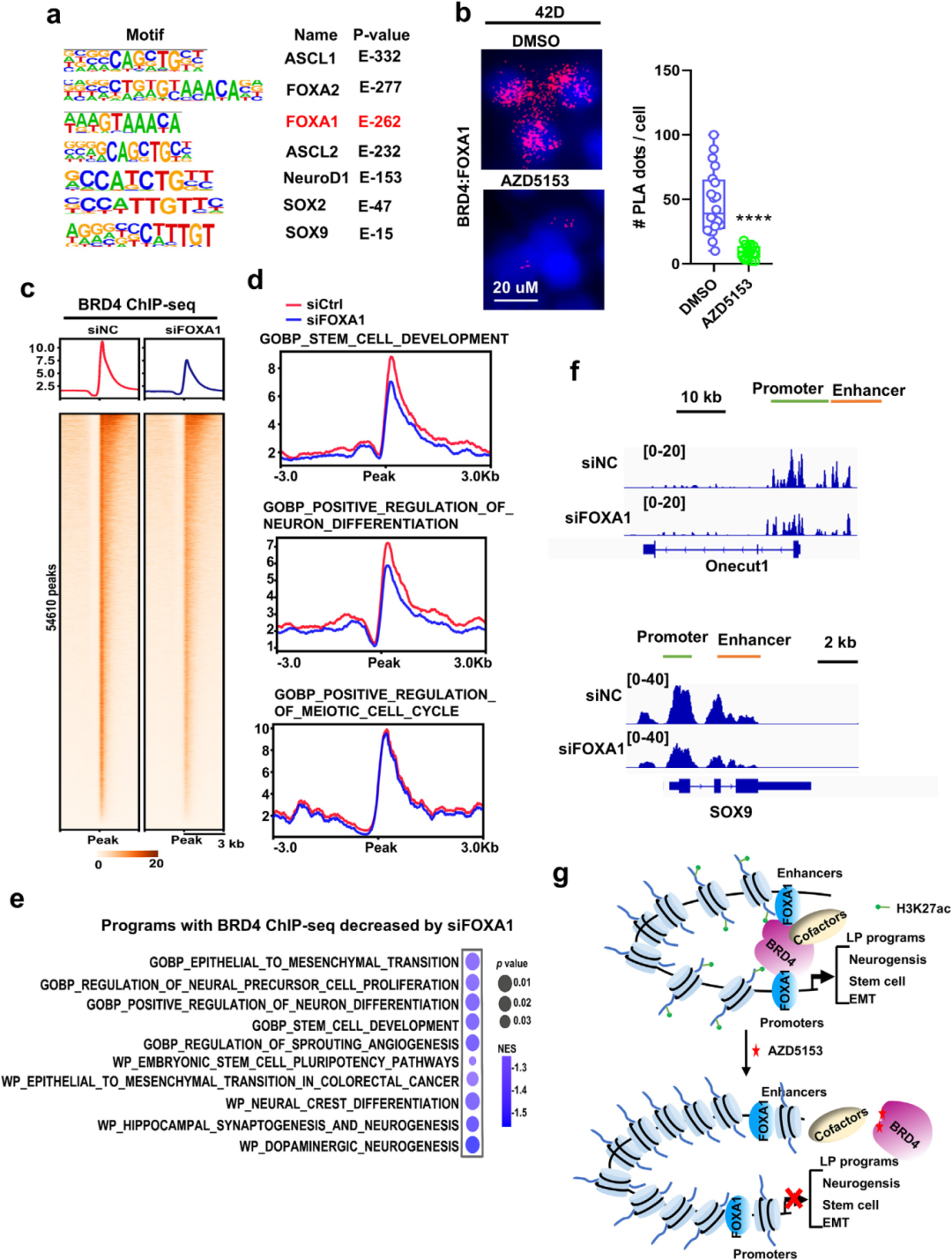
6) FOXA1促进BRD4招募到LP基因靶点。为了理解BRD4如何在NEPC中重编程到LP程序,研究者首先进行了HOMER基序分析,识别出FOXA1基序是最显著富集的基序之一。先前研究表明FOXA1在NEPC中也被重编程,并在NEPC进展中发挥重要作用。在共免疫沉淀和PLA分析中,观察到BRD4与FOXA1强烈相互作用,且这种相互作用被BRD4抑制剂显著抑制。在NEPC LuCaP145.2肿瘤中分析FOXA1 cistrome,发现BRD4峰与FOXA1显著重叠(23,120峰,约30%),这些重叠峰主要与LP程序相关。敲低FOXA1强烈抑制了BRD4结合,特别是在LP程序上,而在细胞周期等其他程序上几乎没有影响。FOXA1敲低显著抑制了LP程序基因的表达以及NEPC细胞的生长和存活。FOXA1和BRD4的双重敲低导致LP驱动因子和标志物(包括BRN2、ASCL1、SOX2和SYP)下调更强,表明BRD4和FOXA1在LP诱导中协同作用。
本研究揭示了BRD4在神经内分泌前列腺癌(NEPC)中的功能机制。研究发现,BRD4是NEPC肿瘤谱系可塑性的关键调控因子,通过直接激活神经发生、轴突发生、干细胞和EMT等谱系可塑性程序,促进疾病进展。与去势抵抗性前列腺癌(CRPC)腺癌中主要控制雄激素受体(AR)信号通路的作用不同,NEPC中的BRD4功能被ARPIs(如恩杂鲁胺)重编程,转而控制谱系可塑性程序,这一过程由先锋因子FOXA1促进。研究还证明,BRD4抑制剂,尤其是双价抑制剂AZD5153,在抑制NEPC肿瘤生长和谱系可塑性程序方面表现出强大效力,其作用机制是通过降低局部染色质可及性来抑制相关基因程序的表达。AZD5153因能同时破坏BRD4的BD1和BD2结合位点,在Rb表达或功能丧失的NEPC肿瘤中展现出更高的抑制效果。这些发现为开发更有效的BRD4靶向药物提供了指导,并为NEPC患者带来了新的治疗希望。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000