常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-09-23 17:33:51 细胞资源库平台 访问量:120
脑类器官作为干细胞衍生的3D微组织,已被广泛用于模拟人类胎脑发育程序,重现发育性、精神性和退行性脑疾病。脑类器官的广泛应用提高了我们对人脑发育过程的理解。然而,神经血管系统的缺失严重限制了脑类器官的应用,因为血管系统在氧气供应、神经发生调节和功能应用中发挥着重要作用。
血管起源于中胚层,通过血管生成和血管发生的连续过程发育,侵入神经上皮区域形成脑血管网络。自组织人血管类器官模型已被报道并应用于糖尿病血管病变研究。然而,由于脑血管和神经元来源于两个不同的胚层,生成血管化脑类器官一直是一个挑战。多项研究尝试在脑类器官中诱导血管结构,包括将脑类器官与内皮细胞或其祖细胞共培养。这些报告为该领域的进一步改进提供了各种思路。
近期,上海科技大学罗振革等在Bio-Protocol期刊上发表了题为Generation of Human Blood Vessel and Vascularized Cerebral Organoids的研究论文,研究团队开发了一种脑特异性血管类器官的诱导方法,在成熟阶段用含有神经营养因子的培养基培养,以获得具有脑血管特征的血管类器官。虽然通过组装神经和间充质聚集体生成血管化神经类器官的方法已有报道,但该研究显示血管类器官中细胞类型更加丰富,包括融合血管化类器官中大量的小胶质细胞,能够更好地重现体内脑特征。
1,血管类器官的成功构建与发育表征:研究建立了从人胚胎干细胞分化血管类器官的标准化流程。通过优化培养条件,包括使用特定的中胚层诱导培养基(含CHIR99021)、内皮诱导培养基(含VEGF、BMP4、bFGF)和内皮成熟培养基(含VEGF),成功构建了具有血管特征的类器官。血管类器官在培养过程中表现出明显的发育阶段性变化,从第4天开始形成圆形光滑的形态,到第12天后在Matrigel中显示出血管向外突出的特征性结构。定量分析显示类器官直径从第4天的约0.5mm逐渐增长到第25天的约2.2mm,表明其持续的生长发育能力。
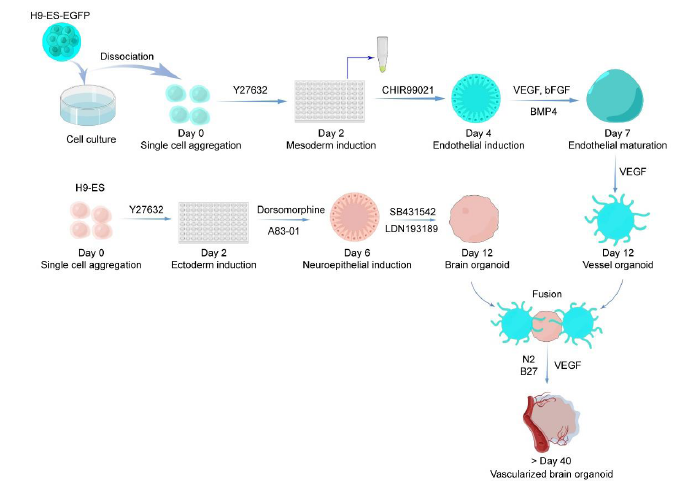
图1 实验流程示意图
2,血管类器官的细胞组成与标志物表达:免疫荧光染色结果显示,培养40天的血管类器官表达内皮细胞标志物CD31,形成了复杂的血管网络结构。通过Imaris三维重建技术清晰展示了类器官内部完整的血管结构。更重要的是,血管类器官中不仅含有内皮细胞,还诱导产生了大量的小胶质细胞,通过IBA1标志物染色可以观察到这些免疫细胞在第25天和第40天均有表达。这种多样化的细胞组成使得血管类器官能够更好地模拟体内脑血管的复杂微环境,为后续的血管化脑类器官构建奠定了基础。
3,脑类器官的独立培养体系建立:研究同时建立了脑类器官的培养体系,使用外胚层诱导培养基(含Dorsomorphine和A83-01)和神经上皮诱导培养基(含SB431542和LDN193189)进行分化。脑类器官在培养过程中表现出典型的神经发育特征,能够分化出多种神经细胞类型。通过对比培养,研究发现单独的脑类器官中小胶质细胞表达较少,这与体内发育过程中小胶质细胞主要来源于造血干细胞而非神经干细胞的事实相符。这一发现进一步证明了血管类器官在提供小胶质细胞方面的重要作用。
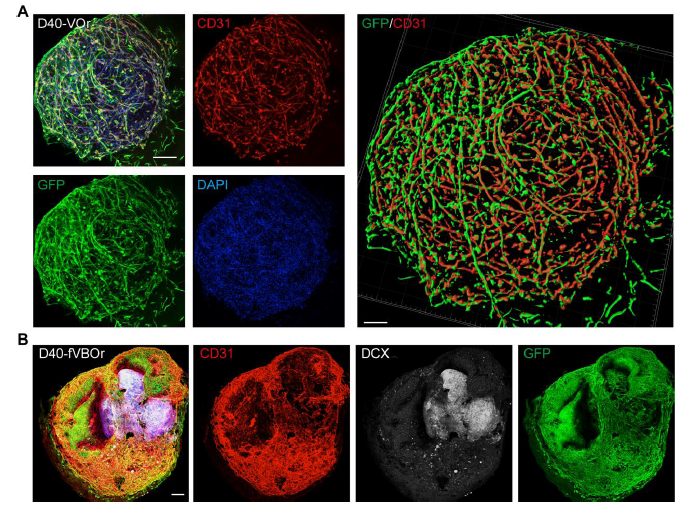
图 2 通过细胞标志物染色对血管类器官(VOrs)和融合血管化脑类器官(fVOrs)进行鉴定
4,融合血管化脑类器官的成功构建:通过将两个血管类器官和一个神经上皮组织在第12天进行融合,成功构建了血管化脑类器官(fVBOr)。融合过程中,神经组织位于两个血管类器官的中间,三个组织在同一水平面上并位于Matrigel液滴的中心。融合后的类器官在40天的培养中表现出良好的血管侵入和神经血管相互作用。免疫染色结果显示,表达DCX的神经元被表达CD31的血管结构包围,表明神经和血管结构之间建立了有效连接。这种融合策略为研究神经血管相互作用提供了理想的体外模型。
5,神经血管相互作用与小胶质细胞侵入的验证:在融合血管化脑类器官中,小胶质细胞成功从血管类器官侵入到脑组织中,这一过程模拟了体内发育过程中小胶质细胞的迁移和定植。通过IBA1染色可以观察到,相比于单独的脑类器官,融合后的血管化脑类器官中小胶质细胞数量显著增加且分布更加广泛。这些小胶质细胞的成功整合表明该模型能够重现体内复杂的神经血管微环境,包括免疫细胞与神经细胞的相互作用。此外,血管结构在类器官中形成了完整的网络,为营养物质和氧气的供应提供了通道,更好地支持了神经细胞的生存和发育。
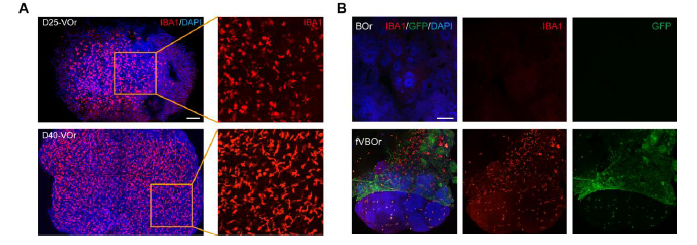
图 3 在血管类器官(VOrs)和融合血管化脑类器官(fVOrs)中诱导产生的小胶质细胞
该研究成功建立了人血管类器官和血管化脑类器官的培养体系,为神经血管研究提供了重要的体外模型工具。该模型不仅能够重现血管和神经组织的基本结构特征,更重要的是实现了小胶质细胞等免疫细胞的整合,使其更接近体内真实的脑微环境。这一突破为研究神经发育、神经血管疾病机制以及药物筛选提供了新的平台。相比于传统的共培养方法,该融合策略能够产生更稳定、更复杂的血管化结构,为脑疾病建模和治疗策略开发提供了有力工具。该研究为推动神经血管相互作用的机制研究和神经系统疾病的精准医学发展具有重要意义。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:眼部ad MSCs追踪新方案IVIS+Alu PCR联手,7 天摸清细胞去向为眼疗安全保驾护航
下一篇:人类胎儿胰腺干细胞的长期体外扩增及其向三种胰腺细胞谱系的分化