常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-09-19 09:04:40 细胞资源库平台 访问量:182
乙肝病毒(HBV)感染是全球主要公共卫生问题之一,有超过2.5亿人慢性感染HBV。而其中有超三分之一的人口集中在我国,人数接近1亿人。NTCP工具细胞,特别是外源表达NTCP的肝癌细胞系如HepG2-NTCP和Huh7-NTCP,因其易操作、短周期、重现性佳的特点,在乙肝病毒(HBV)研究中扮演着至关重要的角色。这些细胞模型能够有效模拟HBV的感染过程,为研究HBV的生命周期、宿主限制因子、病毒复制以及药物筛选提供了一个强大而便捷的体外平台。它们不仅有助于揭示HBV感染的分子机制,如DDX3作为宿主限制因子阻碍cccDNA转录,GPC5作为附着因子在感染入胞过程中的作用,还能通过直接与NTCP相互作用或下调NTCP表达来筛选和验证抗病毒药物的活性,例如环孢菌素A及其衍生物、雷帕霉素及其衍生物等。此外,这些工具细胞还促进了对HBV宿主特异性分子的发现,为发展支持HBV感染的小动物模型提供了可能,这对于乙肝相关研究和药物开发具有重大意义。
英文标题:Interaction between W41 of the hepatitis B virus preS1 surface peptide and Y146/F274 of the cellular receptor molecule (Na^{+}/) taurocholate co-transporting polypeptide is essential for virus entry
中文标题:乙型肝炎病毒preS1表面肽的W41与细胞受体钠/牛磺胆酸共转运多肽的Y146/F274之间的相互作用对病毒进入至关重要
发表期刊:《Molecular Pharmacology 》
影响因子:3.0
作者单位:
1. Institute of Pharmacology and Toxicology, Faculty of Veterinary Medicine, Biomedical Research Center Seltersberg, Justus Liebig University of Giessen, Giessen, Germany
2. Institute of Medical Virology, National Reference Center for Hepatitis B Viruses and Hepatitis D Viruses, German Center for Infection Research (DZIF, Partner Site Giessen-Marburg-Langen), Faculty of Medicine, Justus Liebig University Giessen, Giessen, Germany
3. Institute of Veterinary Physiology and Biochemistry, Faculty of Veterinary Medicine, Justus Liebig University of Giessen, Giessen, Germany
作者信息:
Sebastian Kunz¹^, Lena Soppa²^, Regina Leidolf¹, Anita Neubauer¹, Thomas Lütteke³, Dieter Glebe², Joachim Geyer¹*
乙型肝炎病毒(HBV)依赖大表面蛋白的豆蔻酰化preS1结构域(myr-preS1)与肝细胞表面受体钠/牛磺胆酸共转运多肽(NTCP)结合实现入侵,NTCP同时承担肝脏胆汁酸转运的生理功能。现有HBV/HDV进入抑制剂(如bulevirtide)多非选择性抑制NTCP,导致血浆胆汁酸升高,长期安全性不明;虽冷冻电镜已解析myr-preS1-NTCP复合物结构,但需明确不干扰胆汁酸转运的病毒特异性结合位点。本研究基于复合物结构(PDB 8RQF),聚焦myr-preS1的色氨酸41(W41)与NTCP的酪氨酸146(Y146)、苯丙氨酸274(F274)的相互作用——该位点远离NTCP的胆汁酸结合通道,通过分子动力学模拟、突变体功能验证及体外感染实验,明确其对HBV进入的必要性,为开发选择性抑制剂提供靶点。
基于myr-preS1类似物bulevirtide与NTCP的冷冻电镜结构(PDB 8RQF),用YASARA软件进行分子动力学(MD)模拟:将复合物嵌入人工磷脂膜,在生理条件(37℃、pH7.4、0.15M NaCl)下运行20组独立模拟(每组100ps),分析结合能及π-π/疏水相互作用;通过定点突变构建NTCP Y146A/F274A双突变体,转染T-Rex Flp-In HEK293细胞建立稳定株,用免疫荧光(抗FLAG抗体)和Western blot(膜蛋白提取后PNGase F去糖基化)验证NTCP定位与表达;功能实验中,用荧光标记胆汁酸3α-NBD-TCA和放射性[³H]TCA检测胆汁酸转运能力,用Alexa 568标记myr-preS1(myr-preS1-AX568)和放射性[³H]preS1检测preS1结合能力;构建preS1 W41G突变体,通过竞争性结合实验计算IC50;体外感染实验中,将NTCP野生型/双突变体转染HepG2细胞,感染HBV基因型D3毒株,检测上清HBeAg水平评估感染效率,所有统计用GraphPad Prism进行t检验或ANOVA(p<0.05为显著)。
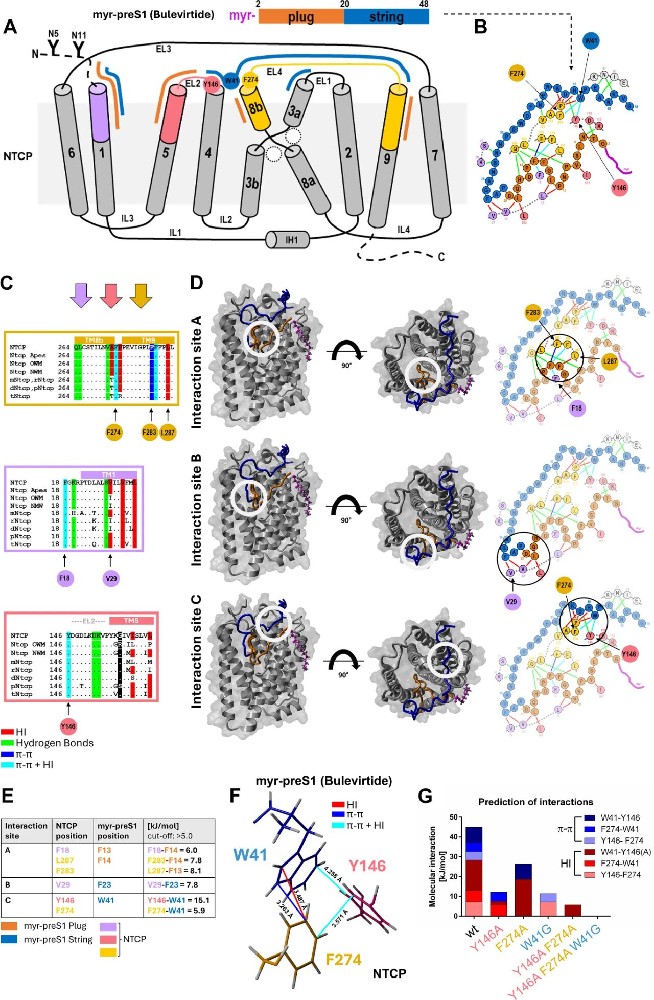
图1:基于bulevirtide-NTCP冷冻电镜结构的myr-preS1与NTCP分子相互作用位点
A图 展示NTCP的9个跨膜结构域(TM)及与bulevirtide(myr-preS1类似物)的结合区域,bulevirtide分为plug结构(2-20aa,橙色)和string结构(21-48aa,蓝色),二者分别与NTCP的TM1、5、8b、9及胞外环(EL)2、4相互作用;
B图 呈现氨基酸水平的分子互作,绿色线为氢键(HB)、红色线为疏水相互作用(HI)、深蓝色线为π-π相互作用;
C图 多物种序列比对显示Y146、F274等互作位点在人、猿、猴、小鼠等NTCP中高度保守;
D图 定位3个高结合能互作位点(A-C),其中位点C由NTCP的Y146(EL2)、F274(TM8b)与bulevirtide的W41(string结构)形成;
E图 计算位点A-C的结合能,位点C结合能最高(45 kJ/mol);
F图 显示位点C的“芳香族氨基酸三角”结构(Y146-F274-W41);G图突变模拟显示,Y146A、F274A、W41G单突变分别使结合能降低32.7、22.7、37.1 kJ/mol,双突变或三突变结合能下降更显著。
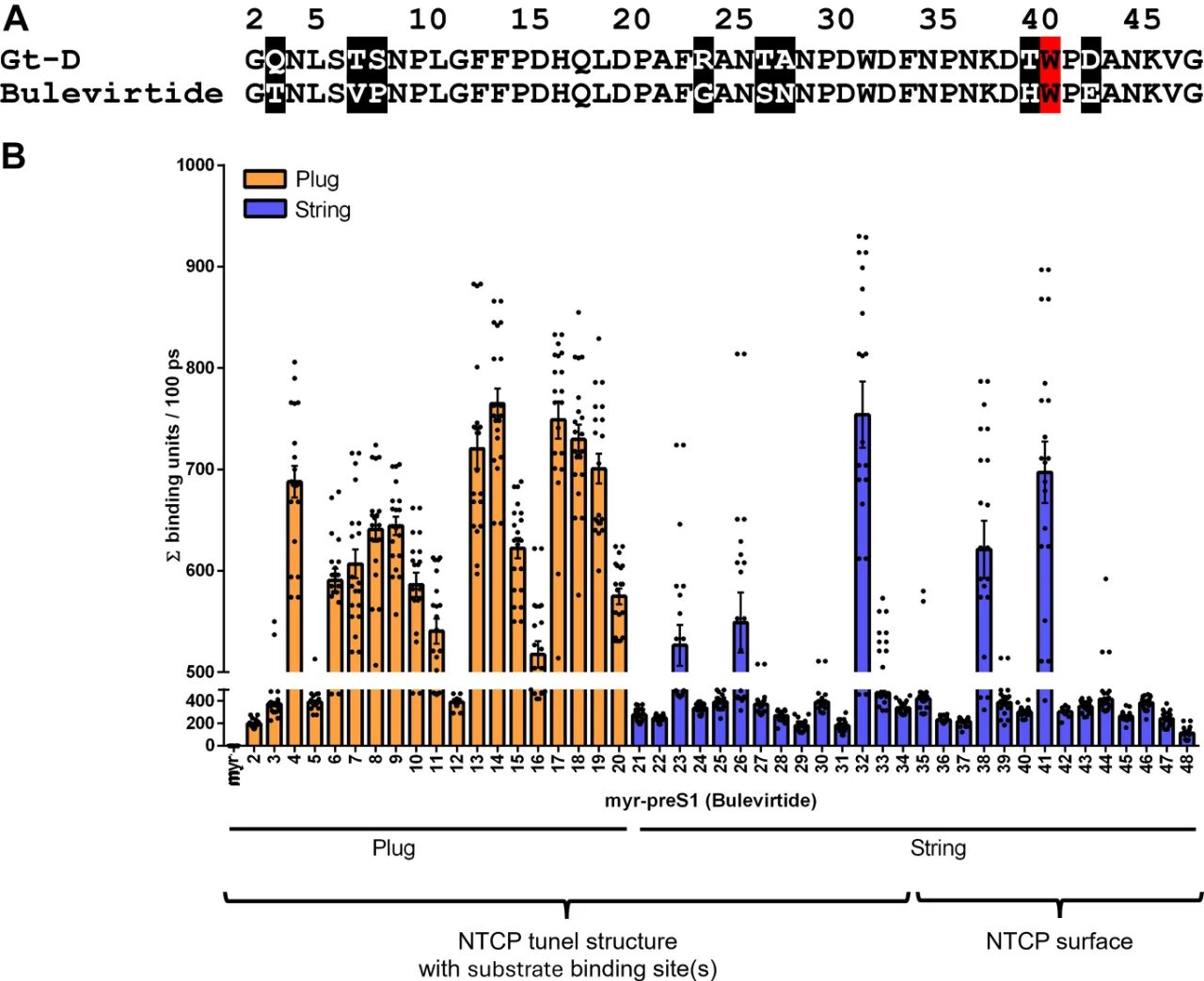
图2:myr-preS1与NTCP分子相互作用的时间分辨MD模拟
A图 比对bulevirtide与HBV基因型D的myr-preS1序列,二者plug结构(2-20aa)和string结构(21-48aa)核心互作位点高度保守;
B图 统计20组MD模拟(每组100ps)中bulevirtide各氨基酸与NTCP的互作次数,显示plug结构的N4、F13、F14及string结构的W32、W41为主要互作位点,且仅W41不与NTCP的胆汁酸结合通道重叠。
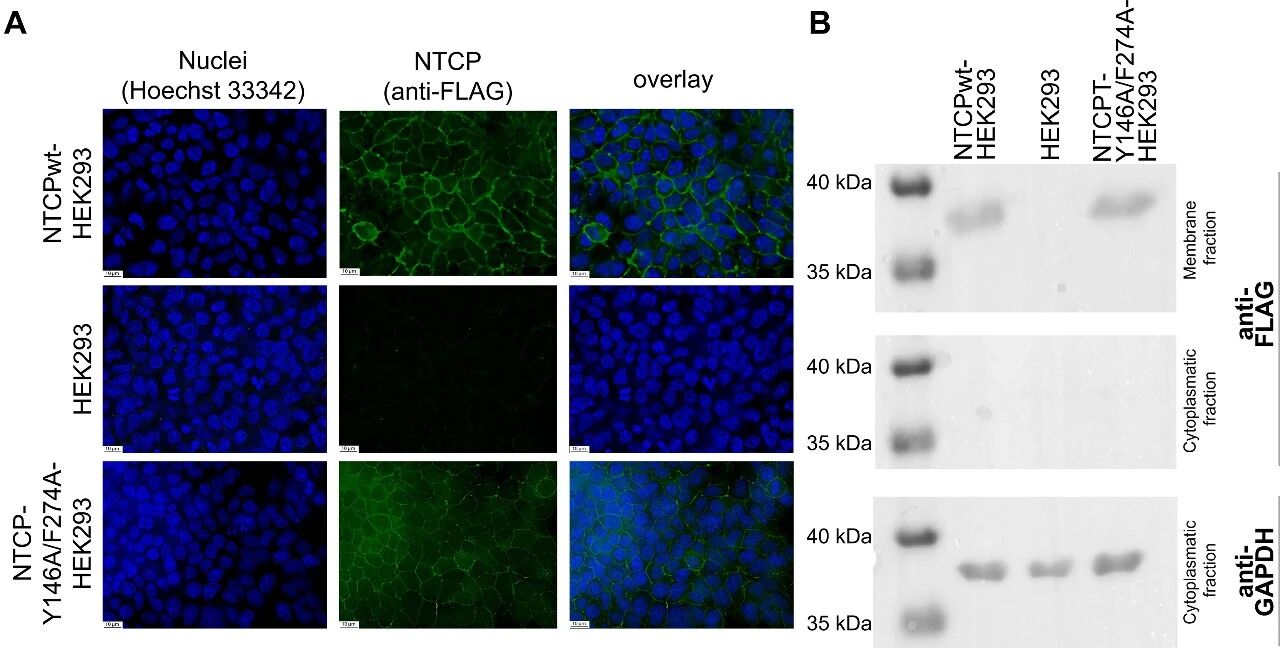
图3:NTCP-Y146A/F274A双突变体的细胞膜定位与表达
A图 免疫荧光结果显示,NTCP野生型(NTCPwt)与双突变体均通过抗FLAG抗体(绿色)定位于HEK293细胞膜,细胞核经Hoechst 33342染色(蓝色),63倍放大的Z-stack成像证实二者定位一致;
B图 Western blot分析显示,经膜蛋白提取和PNGase F去糖基化后,NTCPwt与双突变体在膜组分中均检测到40kDa左右的特异性条带,胞质组分中无条带,GAPDH作为内参证实上样量一致,未转染NTCP的HEK293细胞无特异性条带。
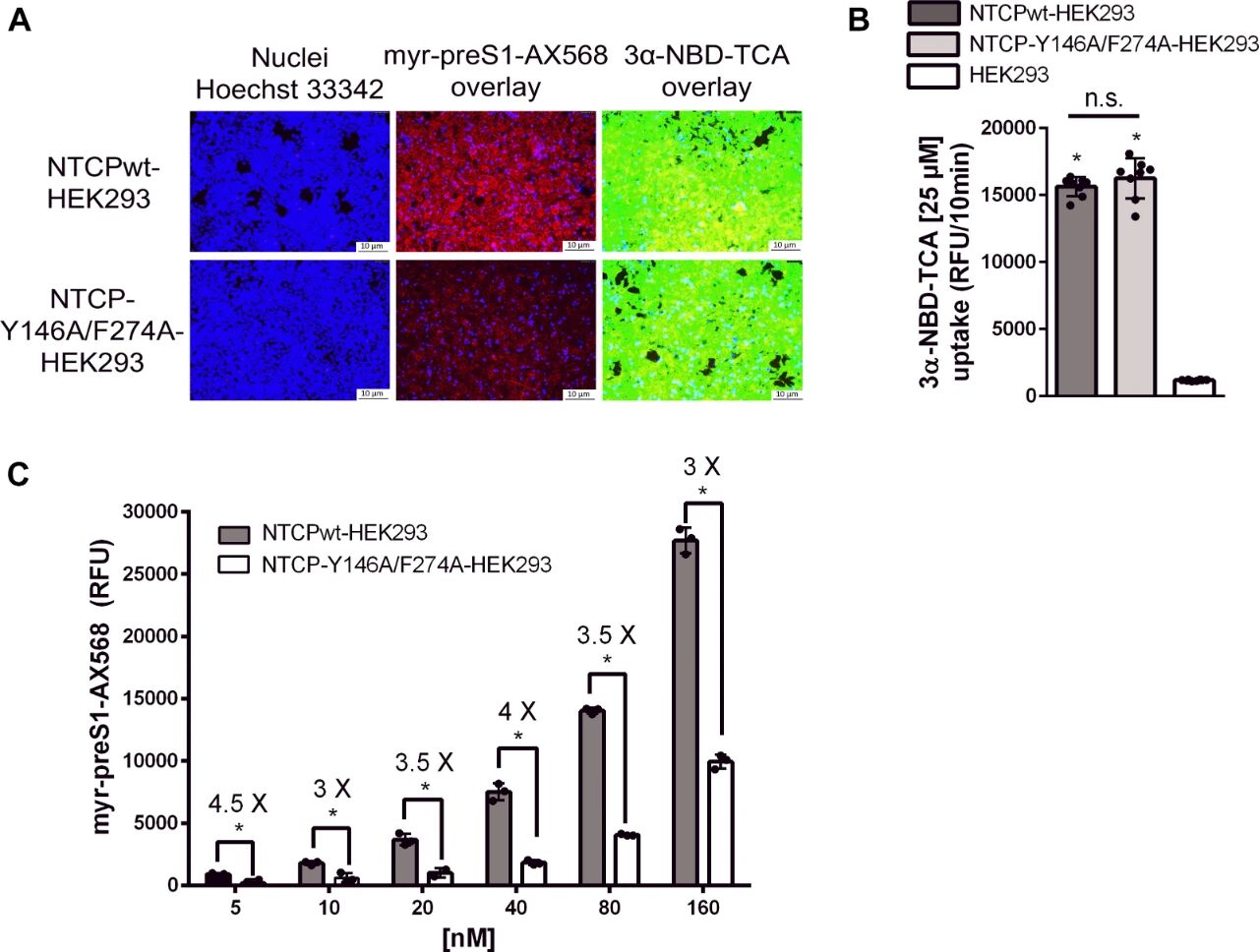
图4:NTCP-Y146A/F274A双突变体的胆汁酸转运功能与myr-preS1结合能力
A图 荧光成像显示,NTCPwt与双突变体HEK293细胞对荧光胆汁酸3α-NBD-TCA(绿色)的摄取量相当,而对Alexa 568标记的myr-preS1(myr-preS1-AX568,红色)的结合量差异显著;
B图 定量检测25μM 3α-NBD-TCA的转运率,双突变体与NTCPwt无统计学差异(p>0.05),未转染NTCP的HEK293细胞转运率显著更低(p<0.01);
C图 浓度依赖性结合实验显示,5-160nM myr-preS1-AX568与双突变体的结合量均显著低于NTCPwt(p<0.01),160nM时双突变体的结合量仅为NTCPwt的25%。
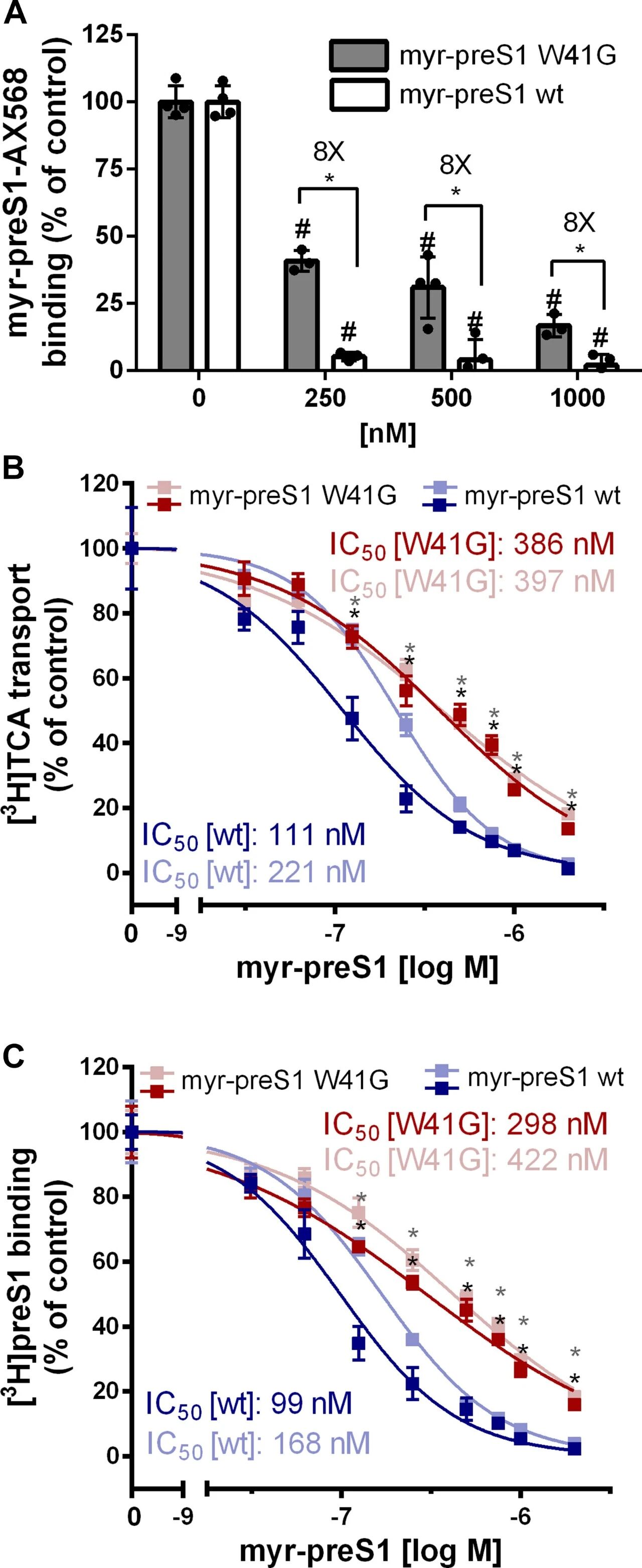
图5:野生型与W41G突变体myr-preS1对NTCP转运功能及结合能力的抑制作用
A图 竞争性结合实验显示,250nM野生型myr-preS1可完全阻断myr-preS1-AX568与NTCPwt的结合,而W41G突变体即使1000nM也无法完全阻断,且各浓度下W41G的阻断效率均显著低于野生型(p<0.01);B图 检测对[³H]TCA(放射性标记牛磺胆酸)转运的抑制作用,野生型myr-preS1的IC50为111-221nM,W41G突变体的IC50为386-397nM,二者差异显著(p<0.01);C图 检测对[³H]preS1(放射性标记myr-preS1)结合的抑制作用,野生型myr-preS1的IC50为99-168nM,W41G突变体的IC50为298-422nM,证实W41G结合亲和力显著下降(p<0.01)。
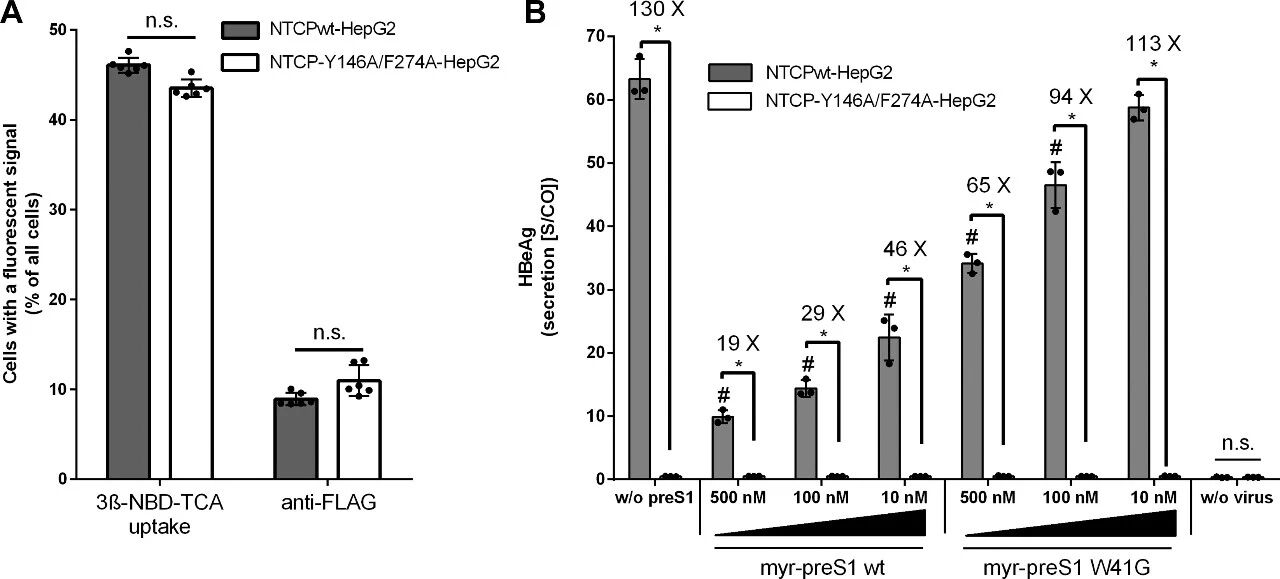
图6:NTCP-Y146A/F274A双突变体与preS1-W41G突变体对体外HBV感染的影响
A图 评估HepG2细胞转染NTCPwt或双突变体后的功能表达,荧光胆汁酸3β-NBD-TCA摄取实验显示约45%细胞具有胆汁酸转运活性,抗FLAG免疫荧光显示约10%细胞表达NTCP,二者无组间差异(p>0.05);B图 体外HBV感染实验显示,转染NTCPwt的HepG2细胞上清HBeAg阳性,且野生型myr-preS1呈浓度依赖性抑制感染(10nM即显著降低HBeAg,p<0.05);转染双突变体的HepG2细胞上清HBeAg阴性,完全抵抗HBV感染;preS1-W41G突变体仅在500nM时轻度抑制感染(HBeAg降低50%),且抑制效率显著低于同浓度野生型(p<0.05)。
本研究证实,myr-preS1的W41与NTCP的Y146/F274通过π-π堆叠及疏水作用形成高结合能相互作用位点,该位点对HBV入侵肝细胞至关重要——NTCP Y146A/F274A双突变体虽保留胆汁酸转运功能但完全阻断HBV感染,preS1 W41G突变体结合NTCP能力及抑制感染效率显著下降。由于该位点与NTCP的胆汁酸结合/转运通道空间分离,为基于结构开发病毒选择性HBV/HDV进入抑制剂提供了理想靶点,可避免现有抑制剂干扰胆汁酸代谢的副作用,为慢性HBV/HDV感染的安全治疗开辟新方向。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:蛋黄脂质+巨噬细胞:这款 “生物递送系统” 让乳腺癌化疗药精准 “炸瘤”,转移抑制率达 90%
下一篇:功能性青蒿素衍生物工程纳米杂化物促进铁死亡应激驱动的癌症治疗