常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-09-17 09:15:38 细胞资源库平台 访问量:260
成纤维细胞活化蛋白 α(FAP)常被视为肿瘤相关成纤维细胞(CAF)的标志物,但其在结直肠癌细胞(CRC)中的内在作用尚未明确。来自哈尔滨医科大学的的在《Cell Death & Disease》(2021, 12:543)发表研究,证实 FAP 在 CRC 细胞中高表达,通过与烯醇化酶 1(ENO1)结合激活 NF-κB 通路,促进癌细胞迁移、侵袭和肝转移。此外,可溶性 FAP 同样具有促转移作用,且 FAP 与 ENO1 高表达均预示 CRC 患者预后不良。该研究揭示了 FAP 在 CRC 中的新机制,为转移性 CRC 的治疗提供了潜在靶点。
本研究旨在探究 CRC 细胞中 FAP 的表达及功能机制。通过分析 TCGA 和 GEO 数据库、临床样本及细胞模型,发现 FAP 在 CRC 细胞中高表达且与不良预后相关;利用敲除 / 过表达实验证实 FAP 促进 CRC 细胞迁移和侵袭(不影响增殖);通过基因芯片和 GSEA 分析发现 FAP 激活 NF-κB 通路;免疫共沉淀和质谱鉴定到 FAP 与 ENO1 相互作用,且该相互作用是 NF-κB 激活和促转移的关键;体内实验验证 FAP 促进肝转移,临床数据显示 FAP 和 ENO1 高表达与 CRC 进展及不良生存相关。
结直肠癌(CRC)转移是患者死亡的主要原因,其中肝转移预后极差。肿瘤微环境(TME)中的 CAF 通过分泌因子促进转移,FAP 作为 CAF 的标志性蛋白,在多种癌症中被报道参与进展,但 CRC 细胞自身表达的 FAP 功能尚不明确。
既往研究认为 FAP 主要由 CAF 表达,但其在癌细胞中的表达及作用存在争议。本研究聚焦 CRC 细胞内在 FAP 的功能,探究其是否通过细胞自主机制或与其他蛋白相互作用影响转移,填补了 FAP 在 CRC 细胞中作用机制的空白。
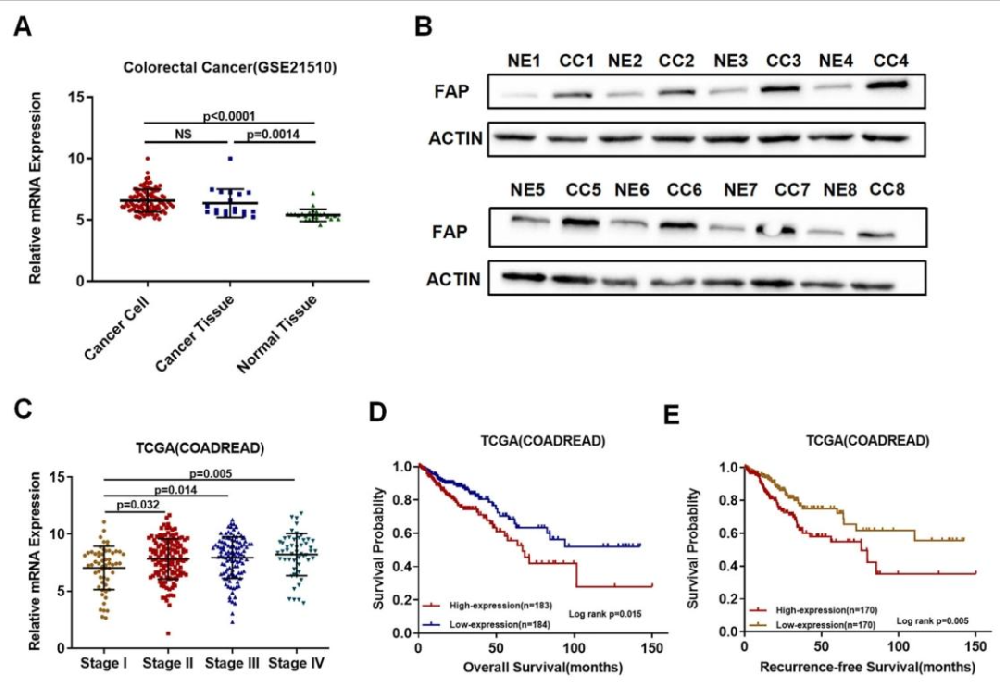
图 1:FAP 在 CRC 细胞中高表达且与不良临床结局相关
该图通过数据库分析和临床样本验证显示:TCGA 和 GEO 数据表明 FAP 在 CRC 组织及激光捕获的癌细胞中高表达(图 1A);MACS 分离的 CRC 上皮细胞中 FAP 蛋白水平显著高于正常上皮细胞(图 1B);FAP 表达随肿瘤分期升高而增加(图 1C),且高表达预示总生存期和无复发生存期缩短(图 1D、E)。证实 FAP 在 CRC 细胞中上调,是不良预后标志物。
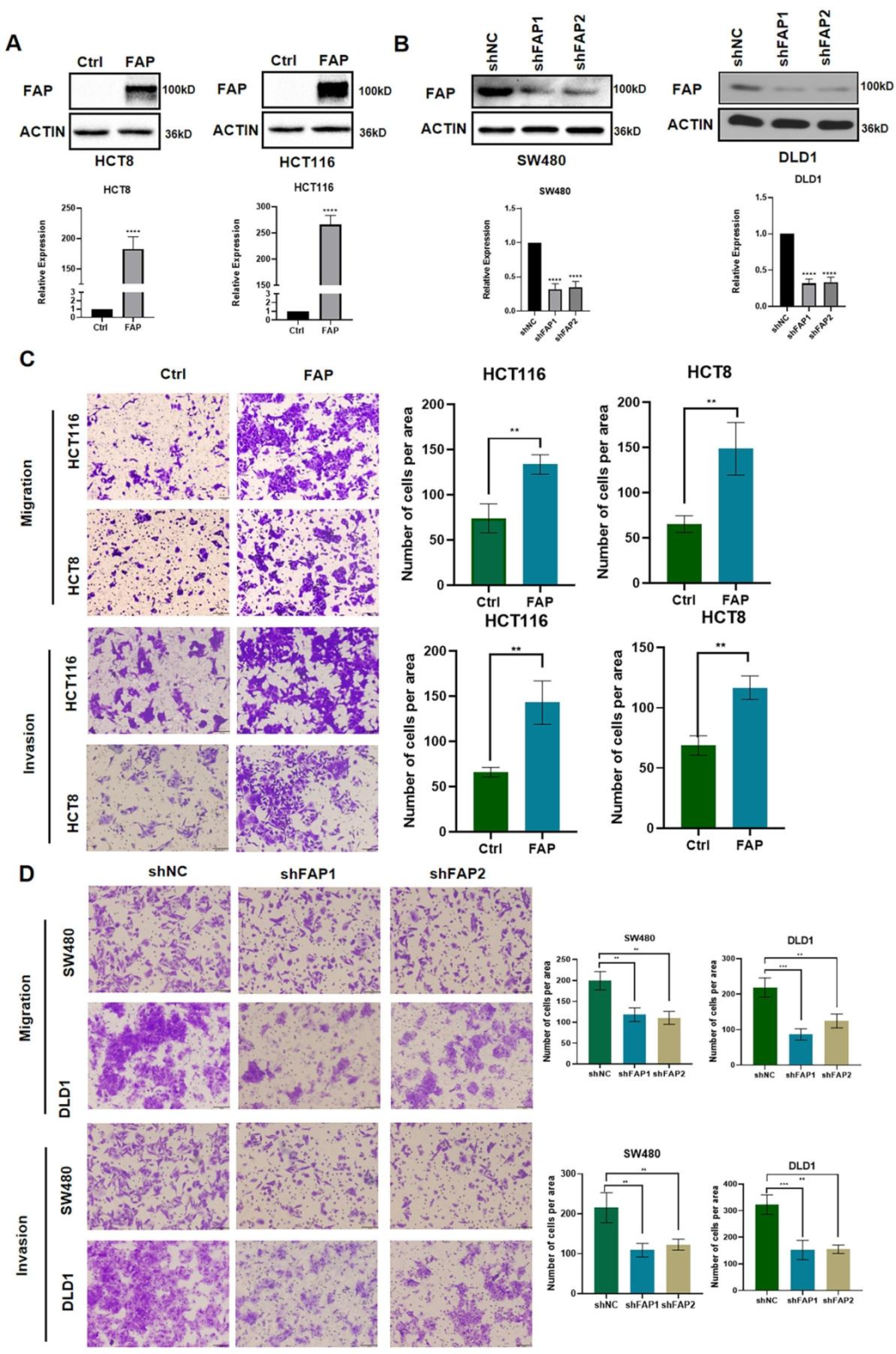
图 2:FAP 促进 CRC 细胞体外迁移和侵袭
该图通过功能实验显示:在 HCT8、HCT116 中过表达 FAP,显著增强其迁移和侵袭能力(图 2A、C);在 SW480、DLD1 中敲除 FAP,迁移和侵袭能力显著降低(图 2B、D);集落形成和 CCK-8 实验显示 FAP 对细胞增殖无显著影响。表明 FAP 特异性促进 CRC 细胞的转移相关表型。
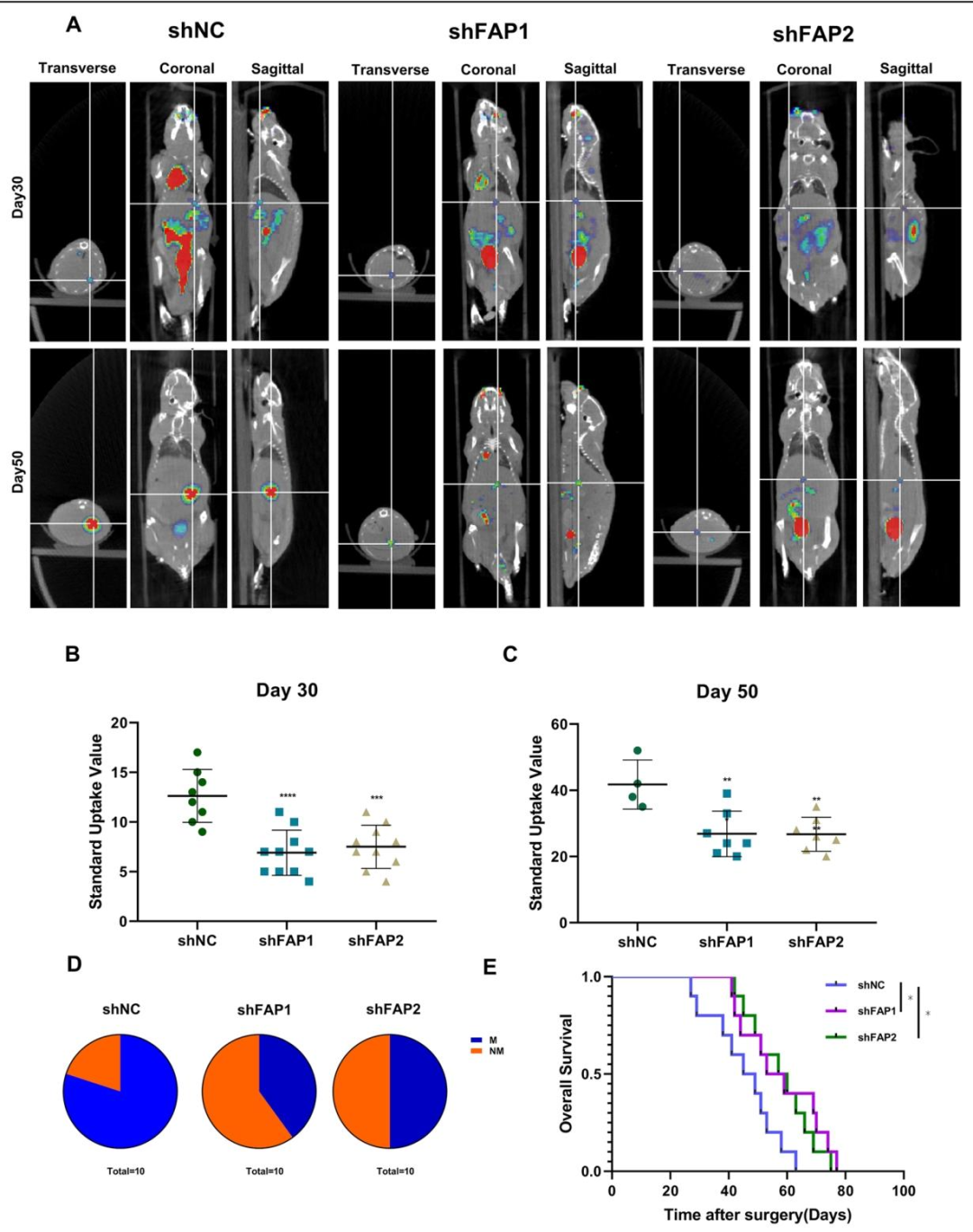
图 3:FAP 促进 CRC 体内肝转移
该图通过裸鼠脾内注射模型显示:敲除 FAP 的 SW480 细胞在小鼠肝脏形成的转移灶经 PET/CT 检测显著减少(图 3A),转移灶标准摄取值(SUV)降低(图 3B、C),小鼠生存期延长(图 3D)。GEO 数据库分析显示转移性 CRC 组织中 FAP 表达高于原发灶,证实 FAP 在体内促进 CRC 转移。
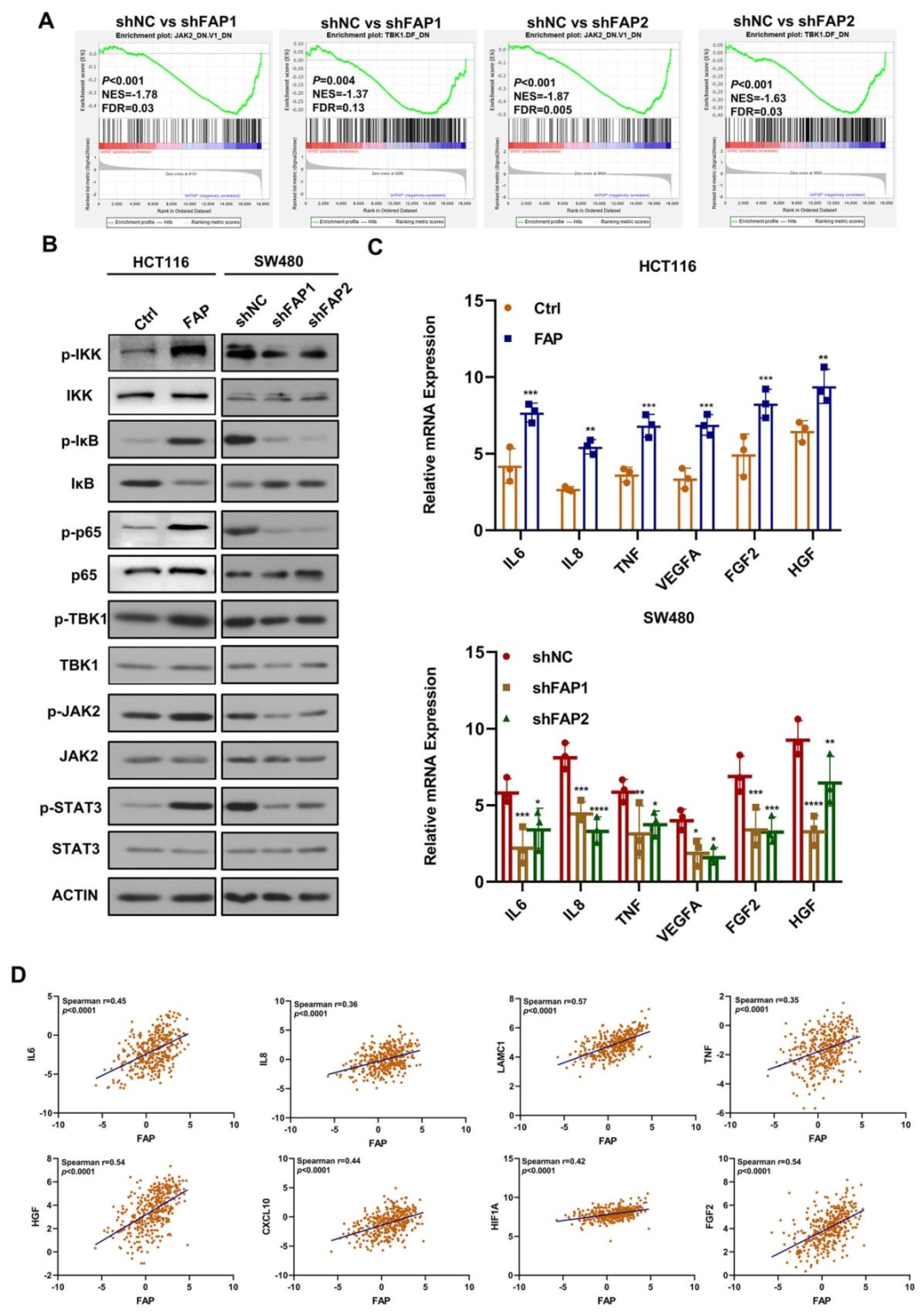
图 4:FAP 通过激活 NF-κB 通路发挥作用
该图通过基因芯片和通路分析显示:FAP 敲除后,基因集富集分析(GSEA)提示 NF-κB 和 JAK2/STAT3 通路受抑制(图 4A);Western blot 证实 FAP 过表达激活 NF-κB 通路(p-IKK、p-IκB、p-p65 上调)及下游靶基因(如 VEGFA)(图 4B、C);TCGA 数据显示 FAP 表达与 NF-κB 通路基因正相关(图 4D)。表明 FAP 的促转移作用依赖 NF-κB 通路。
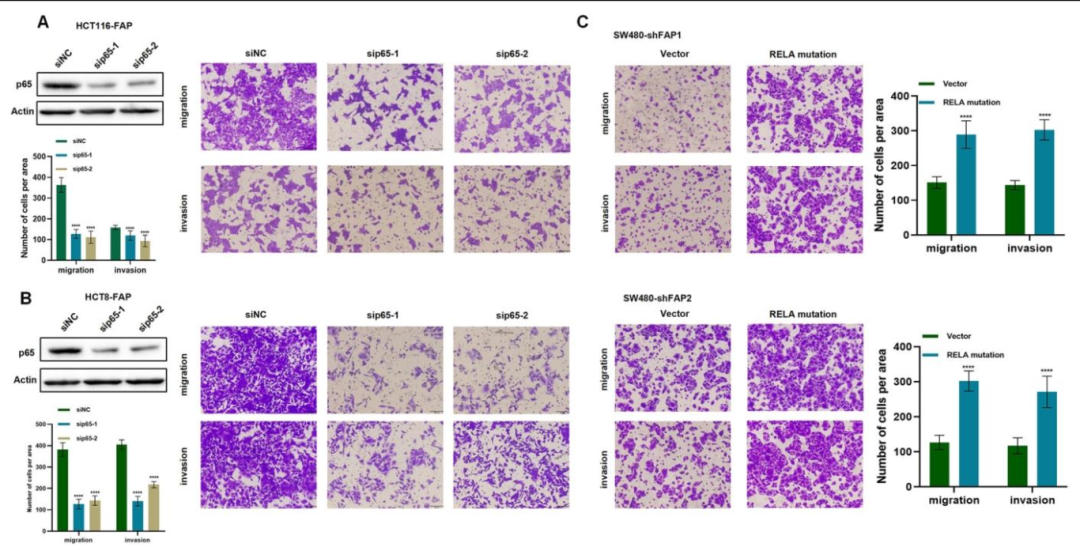
图 5:NF-κB 通路是 FAP 促转移的关键
该图通过 rescue 实验显示:敲除 NF-κB 核心分子 p65 可逆转 FAP 过表达诱导的迁移和侵袭增强(图 5A、B);NF-κB 抑制剂 JSH-23 同样抑制 FAP 的促转移作用;过表达持续激活型 p65(S536D 突变体)可恢复 FAP 敲除细胞的转移能力(图 5C)。证实 FAP 通过 NF-κB 通路促进转移。
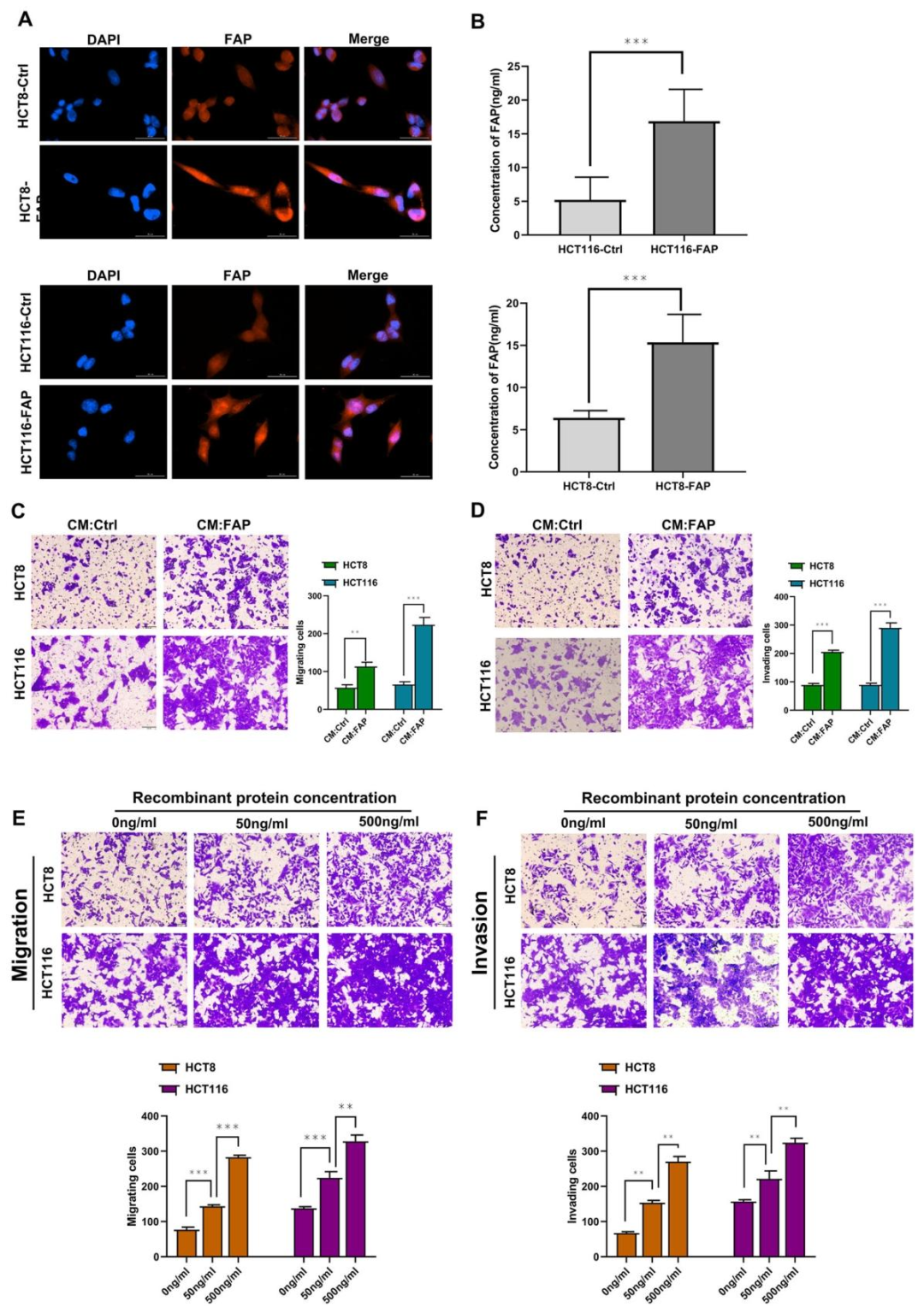
图 6:可溶性 FAP 具有促转移活性
该图显示:免疫荧光证实 FAP 在 CRC 细胞胞质分布(图 6A),ELISA 检测到 FAP 可分泌到培养基中(图 6B);FAP 过表达的条件培养基(CM)及重组 FAP 蛋白可剂量依赖性促进 CRC 细胞迁移和侵袭(图 6C-F),并激活 NF-κB 通路。表明可溶性 FAP 通过旁分泌方式促进转移。
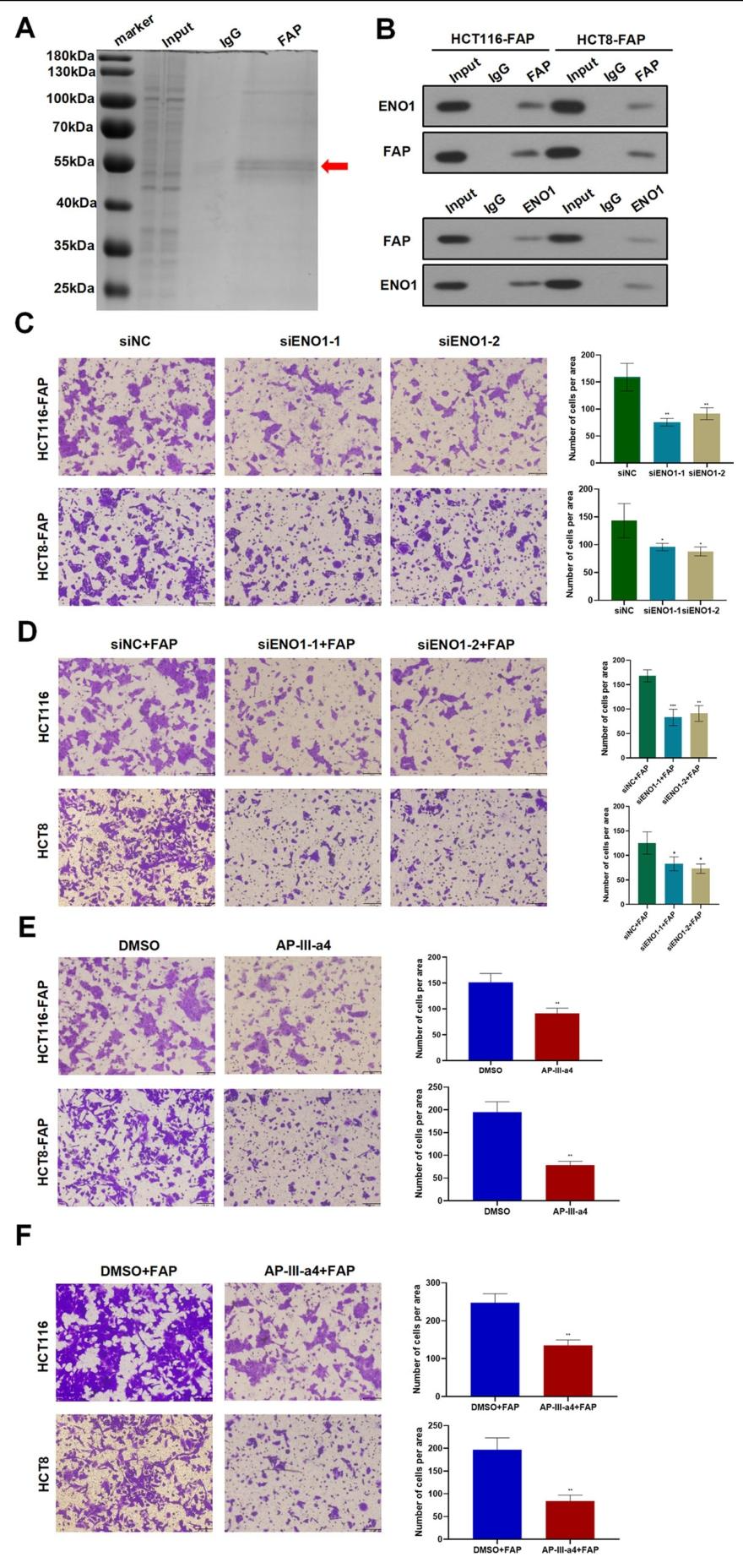
图 7:FAP 与 ENO1 结合激活 NF-κB 通路
该图通过互作分析显示:免疫共沉淀结合质谱鉴定到 FAP 与 ENO1 相互作用(图 7A、B);敲除 ENO1 或用 ENO1 抑制剂 AP-III-a4 可逆转 FAP 的促转移作用(图 7C-E),并抑制 NF-κB 激活;重组 FAP 无法在 ENO1 敲除细胞中促进转移(图 7F)。证实 FAP 通过与 ENO1 结合激活 NF-κB 通路。
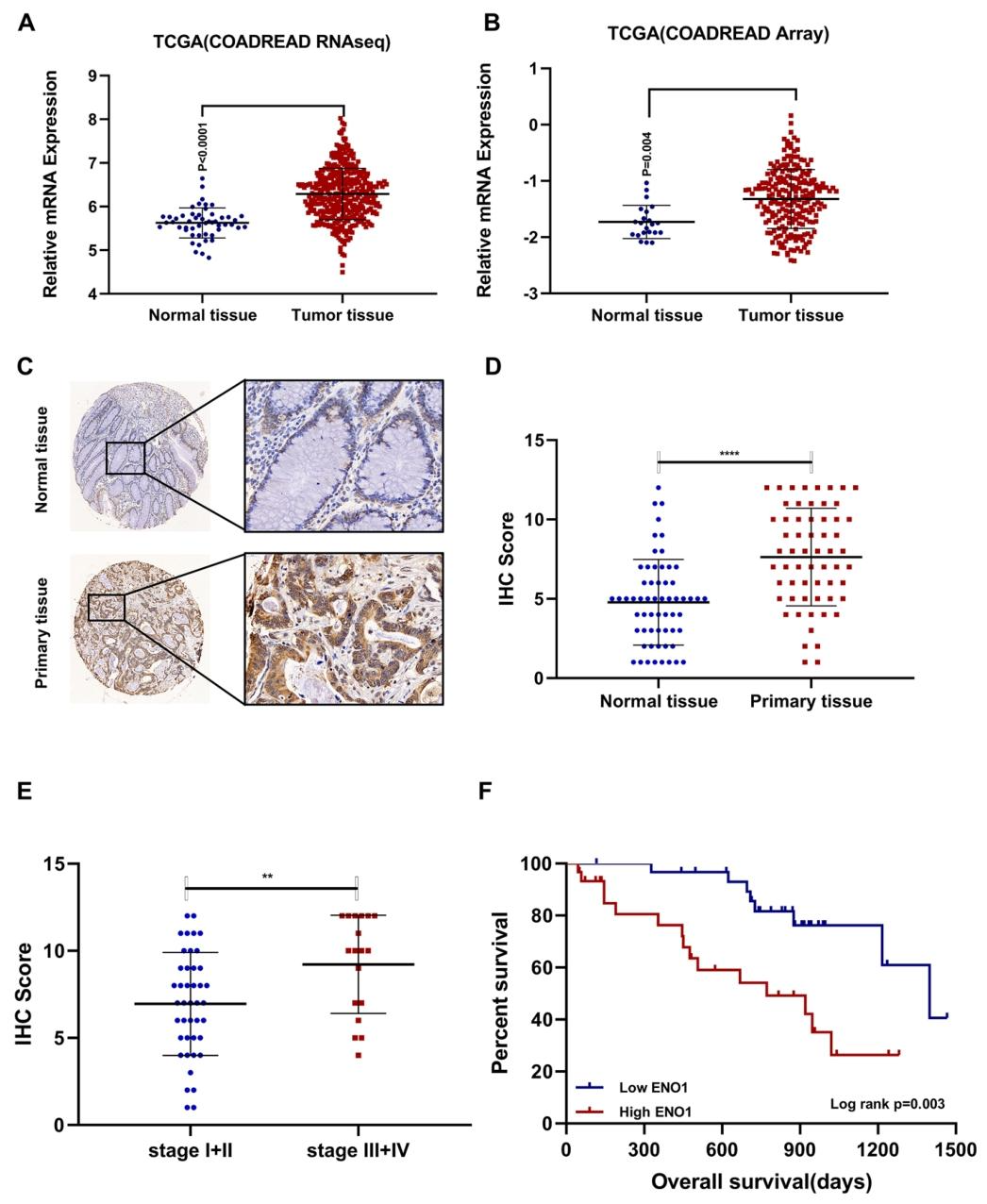
图 8:ENO1 在 CRC 中高表达且与不良预后相关
该图通过临床样本分析显示:TCGA 数据表明 ENO1 在 CRC 组织中高表达(图 8A、B),免疫组化证实其蛋白水平升高(图 8C),且与肿瘤分期正相关(图 8D);高 ENO1 表达预示 CRC 患者生存期缩短(图 8E)。表明 ENO1 是 CRC 不良预后标志物,与 FAP 协同促进疾病进展。
本研究证实结直肠癌细胞中高表达的 FAP 通过双重机制促进转移:一方面,细胞内在 FAP 与 ENO1 结合激活 NF-κB 通路,增强癌细胞迁移和侵袭;另一方面,分泌型可溶性 FAP 通过旁分泌方式发挥促转移作用。临床数据显示 FAP 和 ENO1 高表达均与 CRC 进展及不良预后相关。该研究揭示了 FAP 在 CRC 中的非经典作用机制,为靶向 FAP-ENO1-NF-κB 轴治疗转移性 CRC 提供了实验依据。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:新型人脑类器官培养方案实现近100%神经上皮形成效率
下一篇:鼻息肉新机制!M2 巨噬细胞分泌的 APOE 激活 LRP1-ERK 通路,促进组织重塑