常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-09-15 09:01:17 细胞资源库平台 访问量:286
在生物医学研究和药物开发领域,生物发光成像技术因其高信噪比而被广泛应用于细胞测定和动物成像研究。然而,传统的荧光素酶种类有限,限制了同时成像多个分子和细胞事件的能力。为了突破这一限制,科学家们开发了一种新型的ATP非依赖性荧光素酶——NanoLuc(NL),它源自深海虾Oplophorus gracilirostris,并经过工程改造以增强蛋白质稳定性。NanoLuc作为一种小型(19 kDa)、高亮度的荧光素酶,其亮度是传统萤火虫或海肾荧光素酶的100倍,并且使用furimazine作为底物产生明亮的辉光型发光。NanoLuc的意义在于其为双报告基因生物发光分子成像提供了新的可能。它不仅可以在活体小鼠的表层和深层组织中成像,而且其生物发光随时间的变化可以用来定量肿瘤生长,甚至在少量血清中也能检测到分泌的NL。此外,NanoLuc与萤火虫荧光素酶的结合使用,为在完整细胞和活体小鼠中定量TGF-β信号传导的两个关键步骤提供了一种新型双荧光素酶成像策略,从而在正常生理、疾病和药物开发中扩展了信号转导的成像能力。NanoLuc的作用不仅体现在其高灵敏度和高稳定性上,它还具有更小的尺寸,这使得在标记细胞和蛋白质时对样本的侵入性更小,有助于保持细胞或组织的天然状态。NanoLuc的快速反应、低背景发光和多样灵活等特点,使其在生物学和医学研究中具有广泛的应用前景。因此,NanoLuc作为一种新的报告基因,不仅增强了我们对生物过程的理解和疾病机理的研究,而且在开发潜在治疗方法和疗法方面发挥了重要作用。
英文标题:Supramolecular assembly of multifunctional protein gels via an N-glycosylation consensus sequence fusion domain
中文标题:通过 N - 糖基化共有序列融合结构域实现多功能蛋白凝胶的超分子组装
发表期刊:《Molecular Systems Design & Engineering》
影响因子:3.2
作者单位:
J. Crayton Pruitt Family Department of Biomedical Engineering, University of Florida, Biomedical Sciences J293, PO BOX 116131, 1275 Center Drive, Gainesville, FL, USA
作者信息:
Eric D. Hill, Stephen Michel, Natasha R. Sequeira, Benjamin G. Keselowsky*, Gregory A. Hudalla
蛋白 - 多肽融合是构建功能性超分子材料的重要策略,但面临关键挑战:需融合标签在细胞表达时保持可溶性以利于纯化,同时具备用户可控的刺激响应性(如温度)以实现组装。现有标签(如弹性蛋白样多肽、卷曲螺旋)在多功能性或组装可控性上存在局限,且缺乏对组装机制的明确解析。
本研究创新开发N - 糖基化标签 NGT(重复序列 (GGGSGGGSGGNWTT)₁₀),其融合于折叠蛋白(超折叠绿色荧光蛋白 sfGFP、纳米荧光素酶 nL)后,可在低温下组装成超分子凝胶,高温下保持可溶性(利于大肠杆菌表达纯化);凝胶具备剪切变稀和自修复特性,且天冬酰胺介导的氢键是组装关键;NGT-sfGFP 与 NGT-nL 共组装可实现生物发光共振能量转移(BRET),为多功能生物材料开发提供新工具。
重组蛋白表达与纯化
将编码 NGT、NGT-sfGFP、NGT-nL、QGT-sfGFP(NGT 中天冬酰胺突变为谷氨酰胺)及 ApNGT(糖基转移酶)的基因插入 pET-21d (+) 载体,转化至 Origami™B (DE3) 大肠杆菌;NGTnL 采用自诱导培养基培养 24 小时,NGTsfGFP、QGTsfGFP 及 ApNGT 经 IPTG(0.5 mM)诱导 18 小时(18℃);细菌经 B-PER 试剂裂解,离心获取可溶性组分,通过固定化金属亲和层析(IMAC,钴琼脂糖珠)纯化 6×His 标签蛋白,SDS-PAGE 和 MALDI-TOF MS 验证纯度与分子量。
蛋白凝胶制备与基础表征
纯化蛋白经 Amicon 离心滤器浓缩至 30 μM,透析(4℃,PBS)后冻存于 - 80℃;解冻后(4℃)14100×g 离心 7 分钟形成凝胶;通过浊度仪(600 nm 吸光度)检测温度 / 化学处理(硫氰酸钠、糖基化)对凝胶透明度的影响;糖基化处理采用 ApNGT 催化 NGTsfGFP 的天冬酰胺结合葡萄糖(25 mM UDP - 葡萄糖,30℃孵育 4 小时),MALDI-TOF 验证修饰效率;瓶倒置实验初步判断凝胶形成(不流动为阳性)。
流变学测试
采用 Anton Paar MCR302 流变仪(8 mm 平行板,间距 1.3 mm)分析凝胶力学性能:频率扫描(0.1–10 rad/s,0.3% 应变,4℃/37℃/55℃)检测储能模量(G')和损耗模量(G'');步剪切流测试(37℃,交替 0.5 Hz/100 Hz 剪切速率)评估剪切变稀恢复;步应变恢复测试(37℃,0.3% 应变 5 分钟→1000% 应变破坏→0.3% 应变 10 分钟)验证自修复能力。
共组装与 BRET 实验
等摩尔(30 μM)NGTsfGFP 与 NGTnL 混合后透析(4℃,PBS)、冻融离心形成共组装凝胶;BRET 检测采用 SpectraMax® M3 酶标仪,加入 nL 底物呋喃咪唑后,扫描 400–700 nm 发射光谱;单独 NGTsfGFP 凝胶通过 485 nm 激发检测荧光发射,验证能量转移效率。
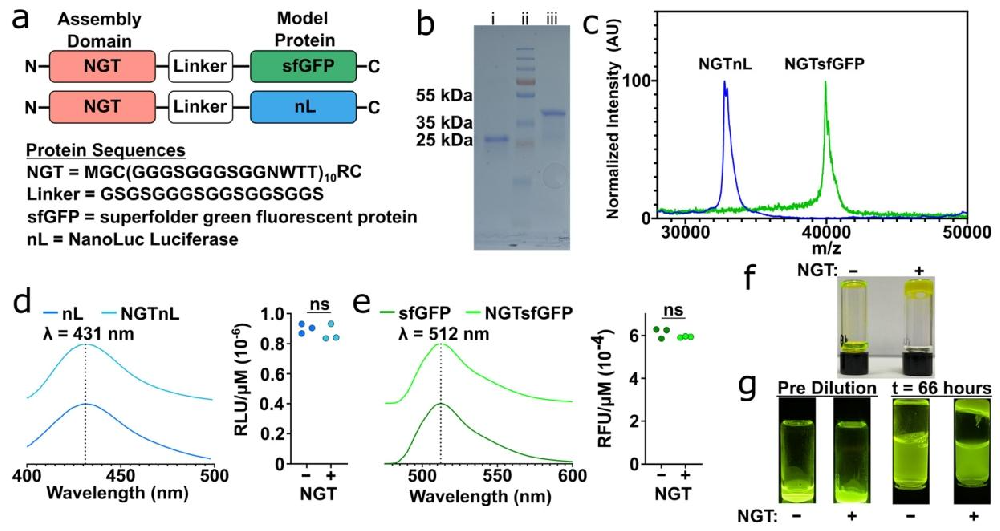
图1:NGT 融合蛋白的设计、纯化与凝胶形成
A 图 为融合蛋白结构(N 端 NGT- linker - 蛋白,sfGFP/nL);
B 图 SDS-PAGE 显示 NGTnL(55 kDa)、NGTsfGFP(35 kDa)纯化后纯度良好;
C 图 MALDI-TOF MS 验证分子量与理论值一致;
D-E 图 显示 NGTnL(呋喃咪唑存在下 431 nm 发射)、NGTsfGFP(465 nm 激发下 512 nm 发射)的发光 / 荧光特性与未修饰蛋白无差异;
F 图 瓶倒置实验显示 500 μM NGTsfGFP 冻融后不流动,未修饰 sfGFP 流动;
G 图 稀释实验显示 37℃下 NGTsfGFP 仍保持凝胶状态,未修饰 sfGFP 完全分散。
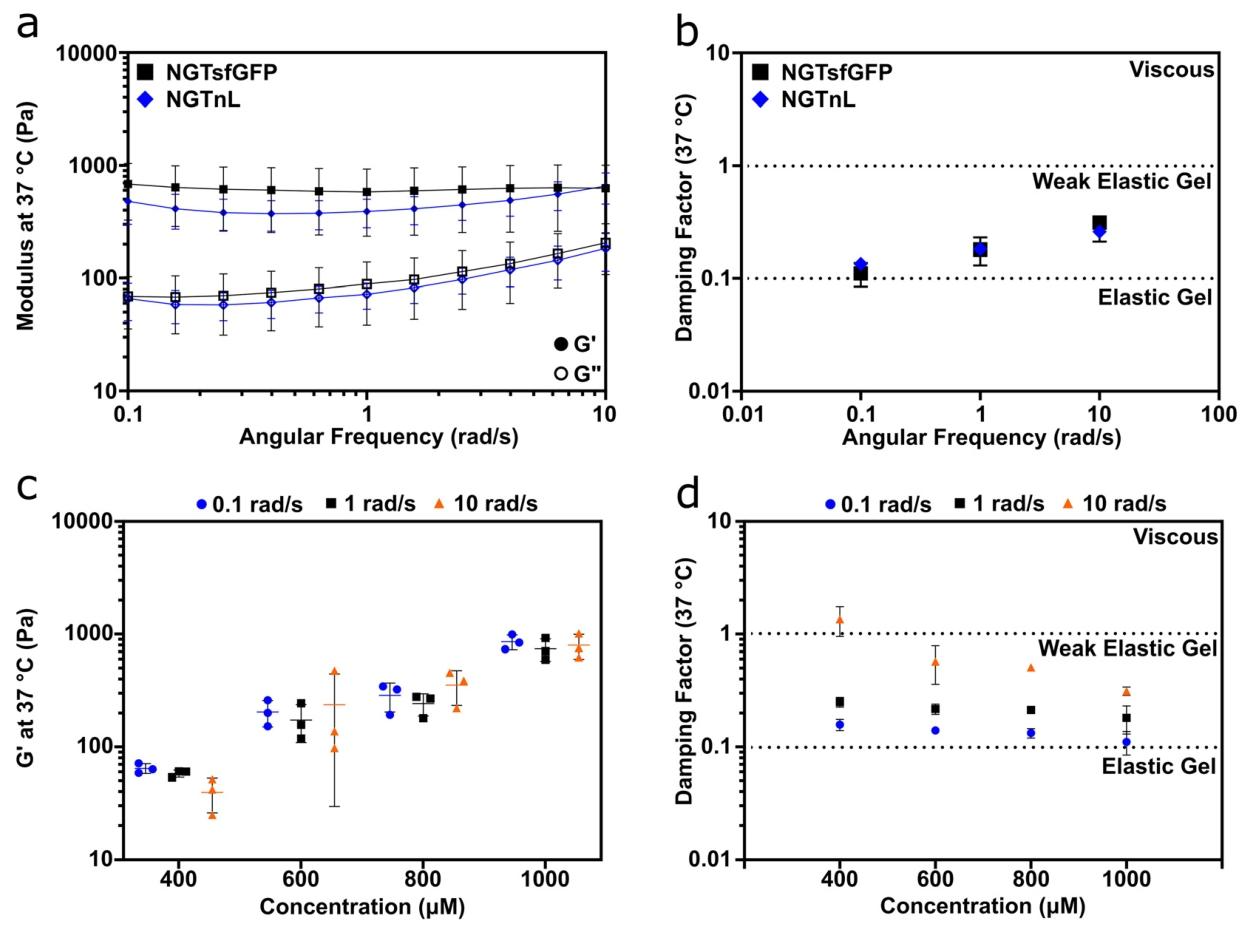
图2:NGT 融合蛋白凝胶的流变学特性
A 图 频率扫描显示 1 mM NGTsfGFP、3 mM NGTnL 的 G' 均大于 G''(4℃/37℃/55℃),为粘弹性凝胶;
B 图 阻尼因子(G''/G')为 0.1–1,属弱弹性凝胶;
C 图 NGTsfGFP 凝胶刚度随浓度升高(400–1000 μM)增加;
D 图 低浓度(400 μM)NGTsfGFP 在高频率(10 rad/s)下进入粘性区,提示凝胶点约 0.1 mM;高频率下 G'' 接近 G',表明凝胶通过弱分子间作用组装,而非物理缠结或共价交联。
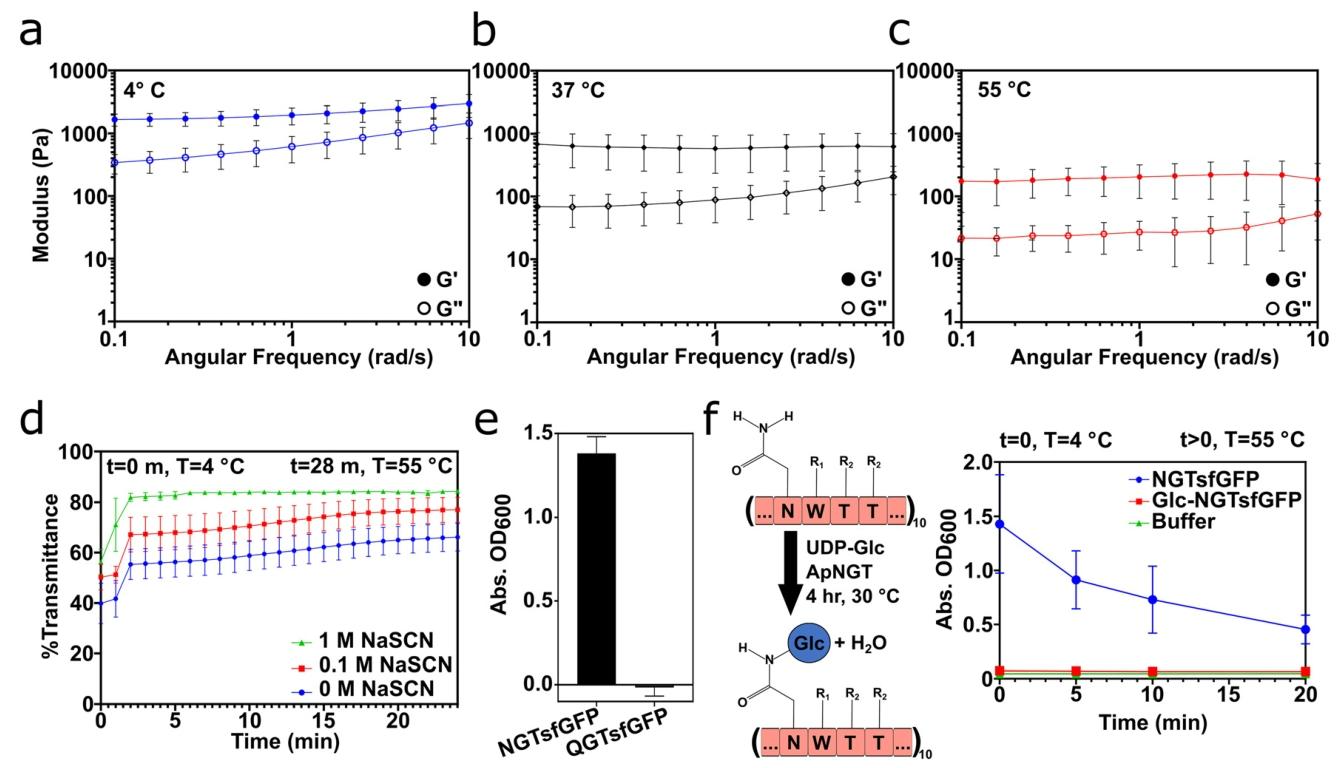
图3:温度依赖性与天冬酰胺在凝胶组装中的作用
A-C 图 温度扫描显示 1000 μM NGTsfGFP 凝胶在 4℃/37℃/55℃均为 G'>G'',但 G' 和 G'' 随温度升高降低(凝胶软化);
D 图 硫氰酸钠(0.1–1 M)处理使 NGTsfGFP 溶液透明度升高(破坏氢键),且温度升高透明度进一步增加;
E 图 500 μM QGTsfGFP(天冬酰胺→谷氨酰胺)在 4℃下浊度远低于 NGTsfGFP,无凝胶形成;
F 图 糖基化修饰的 Glc-NGTsfGFP 在 4℃/55℃均透明,无法形成凝胶。
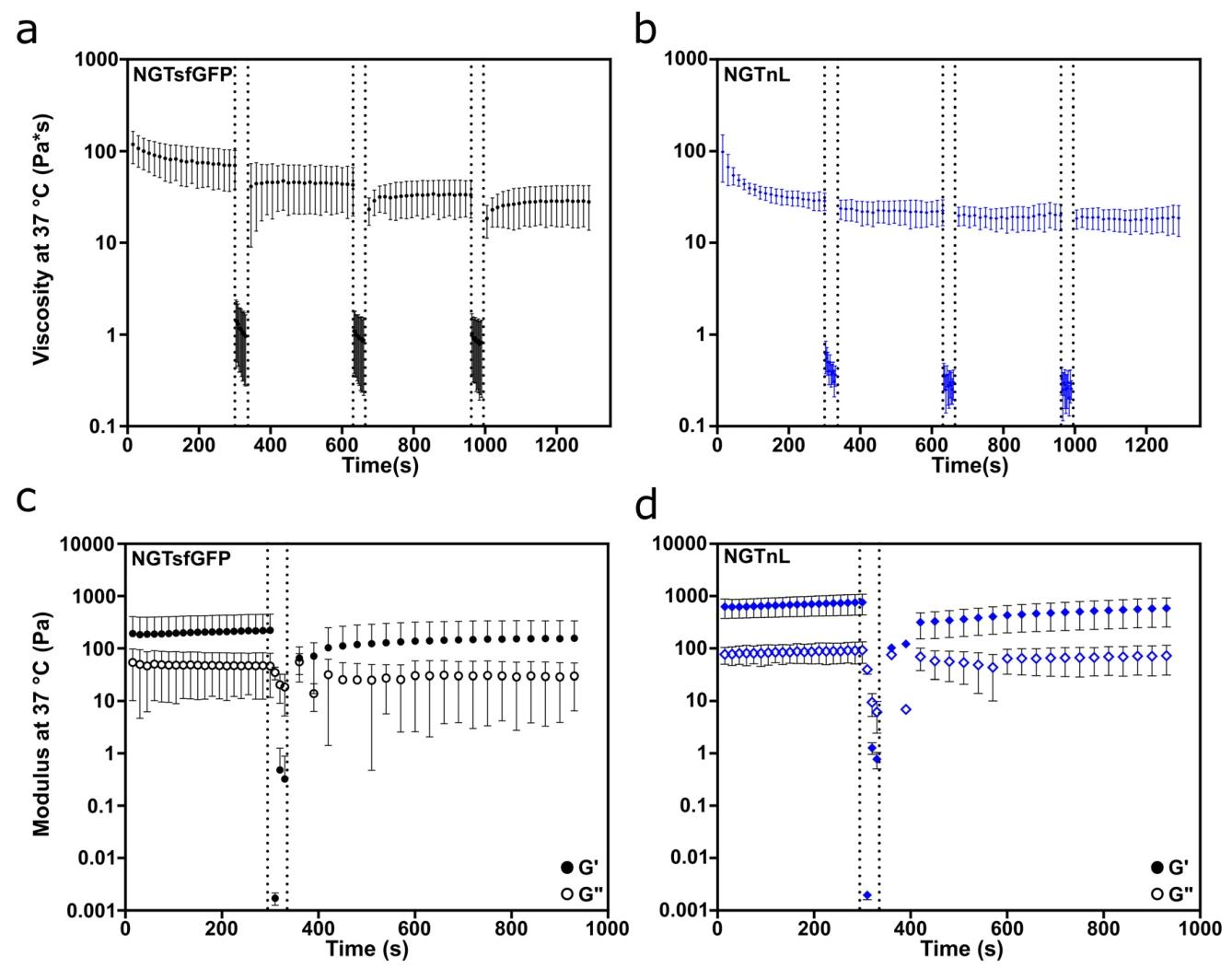
图4:NGT 凝胶的剪切变稀与自修复能力
A-B 图 步剪切流测试显示,NGTsfGFP、NGTnL 在 100 Hz 高剪切下粘度骤降,恢复低剪切(0.5 Hz)后粘度部分回升,且后续循环无剪切变稀;
C-D 图 步应变恢复测试显示,凝胶经 1000% 应变破坏后,30 秒内 G'/G'' 比值恢复 > 1,10 分钟内 NGTsfGFP 恢复 81% 刚度,NGTnL 恢复 94% 刚度;25 号针头挤出后立即恢复固态(瓶倒置无流动)。
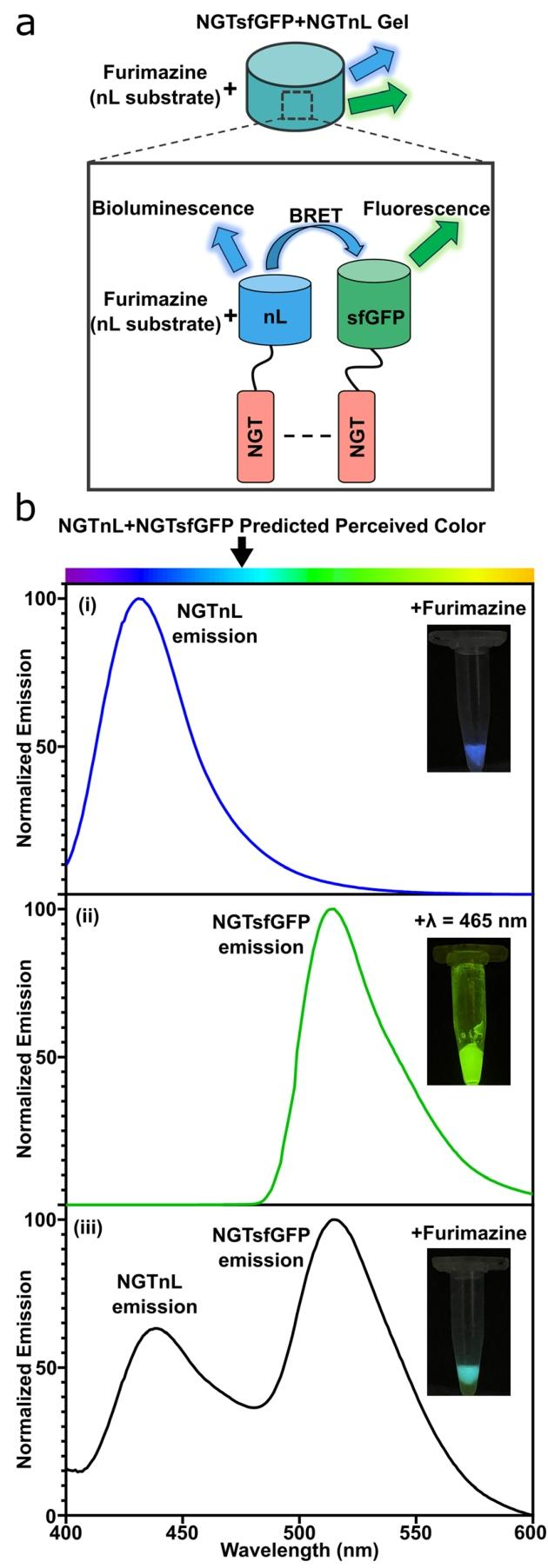
图5:NGT-sfGFP 与 NGT-nL 共组装凝胶的 BRET 效应
A 图 示意图显示呋喃咪唑触发 NGTnL 发光,若与 NGTsfGFP 距离 < 100 Å 则引发 BRET;
B 图 光谱显示:单独 NGTnL 凝胶在 440 nm 有发射峰,单独 NGTsfGFP 在 515 nm 有荧光峰;共组装凝胶在呋喃咪唑存在下同时出现 440 nm(nL)和 515 nm(sfGFP)发射峰,且 515 nm 峰强度更高,提示高效能量转移; inset 数字图像显示共组装凝胶呈混合发光色,与光谱结果一致。
NGT 标签的核心优势:
NGT 融合蛋白可在大肠杆菌中可溶性表达,低温(4℃)经冻融 / 离心组装成弱粘弹性凝胶,高温(37℃/55℃)软化但保持凝胶特性,且融合的 sfGFP/nL 完全保留发光 / 荧光功能,解决 “表达可溶性 - 刺激响应性 - 功能保留” 的协同难题。
组装机制明确:
NGT 的天冬酰胺通过氢键介导分子间相互作用,突变为谷氨酰胺、糖基化修饰或加入氢键破坏剂(硫氰酸钠)均抑制凝胶形成,且天冬酰胺侧链的构象而非仅酰胺基团是组装关键。
材料功能多样:
凝胶具备剪切变稀(可注射)和自修复特性,适合微创递送;不同 NGT 融合蛋白可共组装,且实现 BRET 效应,为构建多组分、协同功能的生物材料(如靶向递送、生物成像)提供通用平台。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:PYY在炎症性肠病中对SATB2缺乏引起的肠道黏膜缺损的保护作用
下一篇:CAFs 研究完整方案出炉,助力乳腺癌微环境机制解析