常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-09-10 09:09:10 细胞资源库平台 访问量:236
缺氧缺血性脑病(HIE)是新生儿最严重的出生并发症之一,由胎儿大脑在产前、产时或产后期间缺氧或血流不足引起。HIE影响全球每年0.7-1.2百万婴儿,占婴儿死亡率的23%。约40-60%的患儿在出生后两年内死亡或患有严重残疾,包括脑瘫、癫痫、严重学习和智力障碍等发育性认知和运动障碍,以及后期精神疾病。
研究显示,HIE存在显著的性别差异,文献报告表明女性婴儿相比男性婴儿在HIE中具有更好的生存率和神经发育结局。男性婴儿发生产前缺氧、感染和出血的可能性是女性的2倍,遭受脑外伤的可能性是女性的1.8倍。男性相比女性表现出语言和言语障碍、自闭症、阅读障碍、注意缺陷多动障碍、学习障碍和脑瘫等神经发育障碍的风险增加。虽然男性婴儿对缺血性损伤更敏感,表现出比女性更大的长期缺陷,但导致这些性别差异的潜在病理机制仍不清楚。
线粒体功能障碍在脑部疾病中的作用日益受到关注,并代表HI事件期间的主要靶点。线粒体作为细胞的能量工厂,在正常细胞功能中不可或缺,同时负责血红蛋白和磷脂的合成、凋亡激活、细胞死亡和钙稳态。在大脑发育过程中,线粒体发挥关键作用,包括神经管形成、中枢神经系统祖细胞的规范化、增殖和存活、神经发生、神经迁移以及神经突生长和突触发生等不同阶段。
近期,发布在Cell & bioscience期刊,题为Hypoxia-ischemia and sexual dimorphism: modeling mitochondrial dysfunction using brain organoids的综述讨论了(1)中枢神经系统中不同的线粒体功能(2)HI损伤背景下线粒体失调(3)HIE中的性别依赖性线粒体通路(4)使用人脑类器官建模线粒体功能障碍。深入了解线粒体功能的这些新方面将为大脑发育和神经疾病如HI损伤提供有价值的了解,并为发现和创造新的治疗方法铺平道路。
1) 线粒体能量代谢的性别差异:在HI脑损伤期间,氧限制导致线粒体呼吸抑制和ATP耗竭。Weis等人研究了HI损伤对雄性和雌性大鼠海马和大脑皮层呼吸复合物的影响,发现HI事件后18小时所有组别的复合物I-III、II和IV活性均明显受抑制。然而,受HI损伤的雌性复合物II活性高于雄性,这种较高的复合物II活性可能归因于雌激素的保护作用,在面临威胁性应激时维持氧化磷酸化。性别差异显著影响线粒体功能、ATP产生和对代谢底物如酮体的反应。在短期禁食期间,女性血浆脂肪酸和酮体水平的上升以及血浆葡萄糖浓度的降低往往比男性更明显,这些数据表明女性在血糖水平降低期间具有有利的代谢特征。Demarest等人发现,呼吸链活性的抑制与雌性而非雄性大鼠线粒体质量的减少相关,且两性线粒体膜均去极化。他们证实HI事件后雄性脑线粒体电子传递链损伤比雌性更严重,但发现雌性动物复合物I依赖性质子泄漏(状态4呼吸)增加。雌性状态4呼吸的增加可能是对雌性ROS产生减少或解偶联蛋白增加的补偿性反应。总体而言,这些数据表明HI事件后雄性脑线粒体电子传递链损伤比雌性更严重,导致能量衰竭、ROS产生增加、神经炎症、线粒体介导的细胞死亡、钙失调和长期认知神经缺陷。
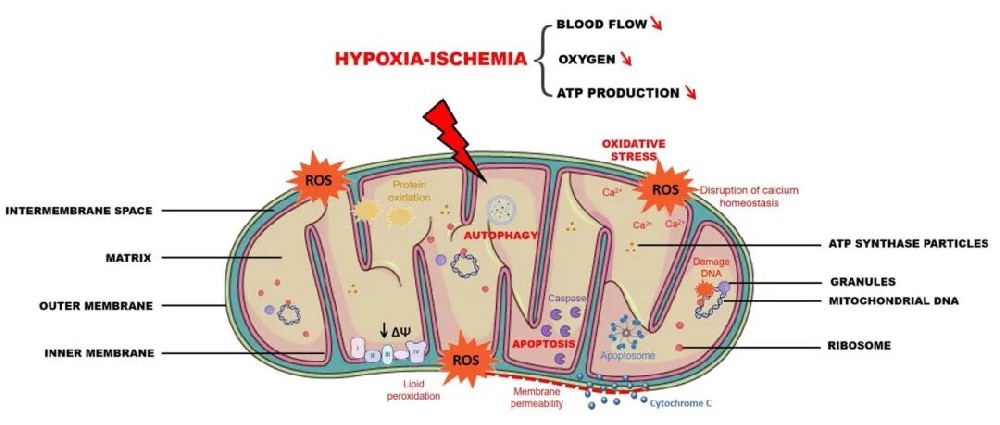
图1 HI事件期间的线粒体失调
2) 氧化应激的性别差异机制:ROS/RNS(活性氮物质)的产生和解毒在正常细胞功能和中枢神经系统损伤恢复中至关重要,新兴证据表明存在性别差异。研究显示,无论是在人类早产双胞胎还是成人创伤性脑损伤中,男性的ROS损伤(通过F2-异前列腺素水平测量)都较高。动物研究表明,雌性线粒体抗氧化酶的水平和活性高于雄性,存在性别依赖性氧化损伤。这些差异可能归因于雌性激素的神经保护作用,表明雌性由于具有更强的抗氧化防御而对ROS/RNS损伤更有抗性。线粒体是细胞ROS/RNS产生的主要来源。在病理条件下,ROS/RNS水平升高可能损害蛋白质、脂质和核酸,需要修复以满足细胞能量需求并确保细胞存活。有趣的是,大脑缺血损伤后雄性动物神经元NOS(nNOS)的诱导较高。药理学抑制或基因敲除nNOS对雄性小鼠提供神经保护,但增加雌性小鼠的梗死面积,这表明损伤后NO产生在雌性中发挥有益作用。Borrás等人显示,雌性线粒体在突触和非突触脑线粒体中产生的H2O2约为雄性的一半,雌性脑线粒体的线粒体DNA氧化损伤也比雄性少四倍。
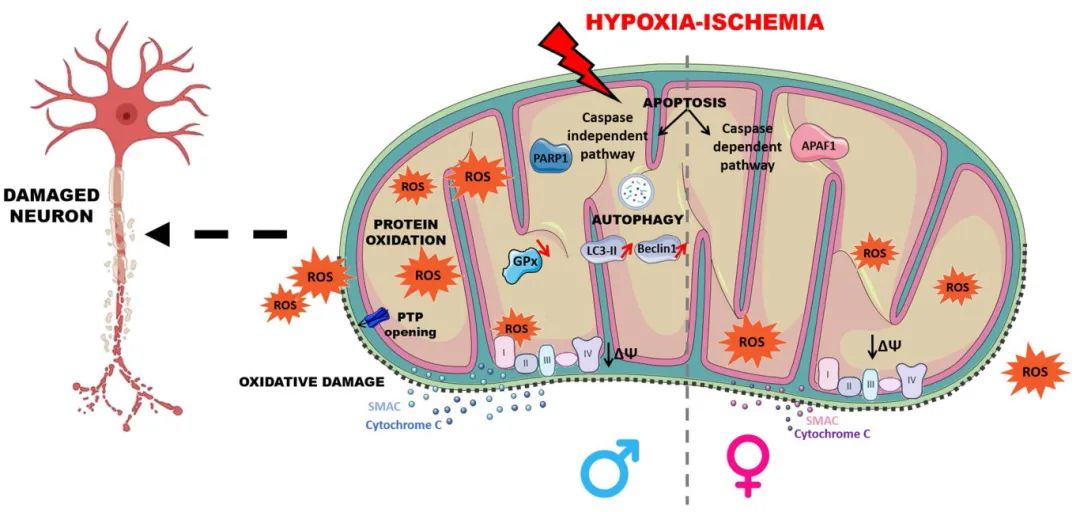
图2 HI损伤背景下线粒体信号通路的性别差异
3) 线粒体介导的凋亡通路差异:凋亡是对细胞发育和稳态至关重要的程序性细胞死亡形式。在性别二态性神经创伤和神经保护中,最广泛研究的领域之一是性别间细胞死亡途径的差异。凋亡级联存在性别差异,可能优先激活两种途径。第一种途径是caspase依赖性途径,在nNOS激活增加后发挥作用,涉及APAF-1和凋亡小体的形成,后者与caspase(3、6、7和9)结合,导致染色质凝聚和DNA片段化。这种caspase依赖性途径往往在雌性中占主导地位。另一种途径是caspase独立性途径,涉及NAD减少和ADP-核糖及PARP-1激活,同时释放AIF和核酸内切酶G,最终导致细胞死亡。第二种途径似乎在雄性中占主导地位。在HI脑损伤期间,AIF介导的caspase3独立性细胞死亡途径在雄性中更突出,而在雌性中caspase3依赖性细胞死亡更明显。Li等人表明,与雌性小鼠相比,AIF上调显著加重新生雄性小鼠的HI脑损伤。这种性别差异与凋亡细胞死亡的激活和神经元细胞死亡增加相关。雄性大鼠往往激活更多的caspase,这可能与更大的凋亡事件相关,因此雄性在早期脑损伤中存在脆弱性特征。
4) 自噬过程的性别特异性调节:自噬是细胞降解和回收过程,可在不同挑战下激活,如促进存活的病原体清除、受损蛋白质和细胞器的降解或程序性细胞死亡。在体外和体内模型中均观察到自噬的性别差异。Weis等人证明,大鼠新生HI损伤后自噬途径在脑区和性别方面表现出特定模式。一项关于自噬性别差异的重要研究揭示了营养剥夺后神经元培养中的基本差异。该研究发现XY细胞活力降低,同时LC3-II蛋白水平增加,与XX细胞相比。此外,XX神经元在营养剥夺后表现出磷脂酶A2介导的脂滴形成增加,这在XY神经元中未观察到。
5) 营养和氧剥夺是HI损伤和饥饿的常见机制:已研究适应饥荒的性别差异,可为HI事件中的雄性脆弱性提供见解。在饥饿期间,雄性神经元更容易经历自噬和死亡,而雌性神经元动员脂肪酸、积累甘油三酯、形成脂滴并存活更长时间。这些发现支持HI损伤中雄性脆弱性的概念,与雌性相比,雄性具有增加的自噬处理和减少的神经元存活。进一步研究HI事件中自噬治疗的作用和机制可能导致针对自噬的有效预防和治疗策略的发展。
6) 脑类器官在HIE研究中的应用前景:脑类器官在重现体内模型许多方面显示出巨大潜力,包括使用正确的外在信号在分化过程中建模性别相关差异。然而,类器官重现体内模型中观察到的性别依赖性线粒体反应的能力仍是一个新兴的研究领域。脑类器官中的线粒体功能可以模拟体内某些线粒体生物学方面,但性别特异性差异的研究可能取决于所用细胞的性别、包括激素影响的培养条件以及反映性别依赖性相互作用的适当细胞类型的使用等因素。为了在人脑类器官中建模HI损伤,可以将细胞暴露于低氧和葡萄糖条件下不同的孵育时间。一些研究通过使用1%氧气48小时、3%和5%氧气24小时或1%和8%氧气数天来诱导人脑类器官的缺氧损伤。人神经类器官的氧葡萄糖剥夺(OGD)导致严重的永久性损伤,即使有复氧步骤。通过调节脑类器官暴露的氧气百分比,以及在细胞培养基中使用葡萄糖剥夺,氧气百分比可与HI损伤的严重程度相关,导致与氧气和葡萄糖剥夺方案参数相关的不同结果。
本研究为理解HIE中的性别差异提供了全新的线粒体视角,揭示了男性新生儿在HIE中易感性增加的分子机制。研究发现线粒体功能障碍、氧化应激、凋亡和自噬等关键病理过程均存在显著的性别差异,这为开发性别特异性的治疗策略提供了重要理论基础。研究强调了脑类器官作为HIE研究新工具的巨大潜力,特别是在研究性别差异和线粒体功能障碍方面。类器官技术可以克服传统动物模型的局限性,提供更接近人类大脑发育的研究平台,有助于开发个性化医疗方案。此外,研究结果对临床实践具有重要指导意义,提示需要在HIE的诊断、治疗和预后评估中考虑性别因素。针对线粒体的治疗策略,如线粒体靶向抗氧化剂,可能需要根据新生儿性别进行个体化调整,以实现最佳治疗效果。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:合成Frizzled激动剂和LRP拮抗剂在类器官培养中对Wnt/β-catenin信号通路的调控
下一篇:乳腺癌细胞 ICAM-1:不影响肿瘤生长与 CTL 杀伤,却靠中性粒细胞抑制肺转移