常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-09-08 09:02:28 细胞资源库平台 访问量:298
在生物医学研究和药物开发领域,生物发光成像技术因其高信噪比而被广泛应用于细胞测定和动物成像研究。然而,传统的荧光素酶种类有限,限制了同时成像多个分子和细胞事件的能力。为了突破这一限制,科学家们开发了一种新型的ATP非依赖性荧光素酶——NanoLuc(NL),它源自深海虾Oplophorus gracilirostris,并经过工程改造以增强蛋白质稳定性。NanoLuc作为一种小型(19 kDa)、高亮度的荧光素酶,其亮度是传统萤火虫或海肾荧光素酶的100倍,并且使用furimazine作为底物产生明亮的辉光型发光。NanoLuc的意义在于其为双报告基因生物发光分子成像提供了新的可能。它不仅可以在活体小鼠的表层和深层组织中成像,而且其生物发光随时间的变化可以用来定量肿瘤生长,甚至在少量血清中也能检测到分泌的NL。此外,NanoLuc与萤火虫荧光素酶的结合使用,为在完整细胞和活体小鼠中定量TGF-β信号传导的两个关键步骤提供了一种新型双荧光素酶成像策略,从而在正常生理、疾病和药物开发中扩展了信号转导的成像能力。NanoLuc的作用不仅体现在其高灵敏度和高稳定性上,它还具有更小的尺寸,这使得在标记细胞和蛋白质时对样本的侵入性更小,有助于保持细胞或组织的天然状态。NanoLuc的快速反应、低背景发光和多样灵活等特点,使其在生物学和医学研究中具有广泛的应用前景。因此,NanoLuc作为一种新的报告基因,不仅增强了我们对生物过程的理解和疾病机理的研究,而且在开发潜在治疗方法和疗法方面发挥了重要作用。
英文标题:Deep generative models generate mRNA sequences with enhanced translation capacity and stability
中文标题:深度生成模型生成具有增强翻译能力和稳定性的 mRNA 序列
发表期刊:《Frontiers in Cellular and Infection Microbiology》
影响因子:预印本
作者单位:
1. Raina Biosciences Inc, Cambridge, MA, USA
2. Harvard T.H. Chan School of Public Health, Harvard University, Cambridge, MA, USA
3. Department of Biological Engineering, Massachusetts Institute of Technology, Cambridge, MA, USA
作者信息:
He Zhang¹, Hailong Liu¹, Yushan Xu², Yiming Liu¹, Jia Wang¹, Yan Qin¹, Haiyan Wang¹, Lili Ma¹, Zhiyuan Xun¹, Timothy K. Lu³,⁴,⁵,, Jicong Cao¹,
mRNA 疗法(如 COVID-19 疫苗)虽取得成功,但拓展至癌症、罕见病等领域时面临表达量低、稳定性差的关键挑战,哺乳动物细胞中 mRNA 表达量差异达 10⁶倍、半衰期差异达 40 倍,而传统优化方法存在明显局限:密码子优化仅关注局部序列、LSTM 深度学习模型缺乏注意力机制且难以适配 N¹- 甲基假尿苷(m¹Ψ)修饰 mRNA、UTR 设计依赖天然序列或局部结构优化且探索序列空间有限,为此研究团队开发深度生成模型 GEMORNA(Generative models for RNA),类比人类语言处理将 CDS 设计视为 “语言翻译”(从蛋白质序列生成 mRNA)、UTR 设计视为 “自由诗歌创作”(无蛋白质序列约束),可从头生成编码区(CDS)和非翻译区(UTR),同时适配 m¹Ψ 修饰,还能扩展至环状 RNA(circRNA)设计,旨在解决传统方法的不足并提升 mRNA 翻译效率与稳定性。
基于 Transformer 架构分别构建 GEMORNA-CDS(生成 CDS)和 GEMORNA-UTR(生成 UTR),以多家族 RNA 无标记数据结合实验验证的标记数据微调模型;通过限制性酶切、Gibson 组装构建 IVT 模板,体外转录合成线性 mRNA,采用内含子介导的环化策略合成 circRNA 并整合挖掘的 IRES,用 NanoAssemblr Ignite 将 RNA 封装进 LNP 后通过动态光散射和 RiboGreen assay 表征;在 HEK293T、HepG2、Jurkat、NALM-6 细胞中,以 Luciferase assay 检测表达量、流式细胞术检测 CAR-T 细胞中 CD19-CAR 阳性率、ELISA 检测 hEPO 浓度验证功能;在 BALB/c 小鼠中通过肌肉注射 LNP-mRNA 检测抗 COVID-19 刺突蛋白 IgG 滴度、尾静脉注射 LNP-circRNA 检测血清 hEPO 浓度评估体内效果,同时设置商业对照(IDT/GenScript 优化 CDS、BNT162b2 UTR)和文献对照(LinearDesign、biLSTM-CRF、Chen et al. 的 circRNA)进行对比。
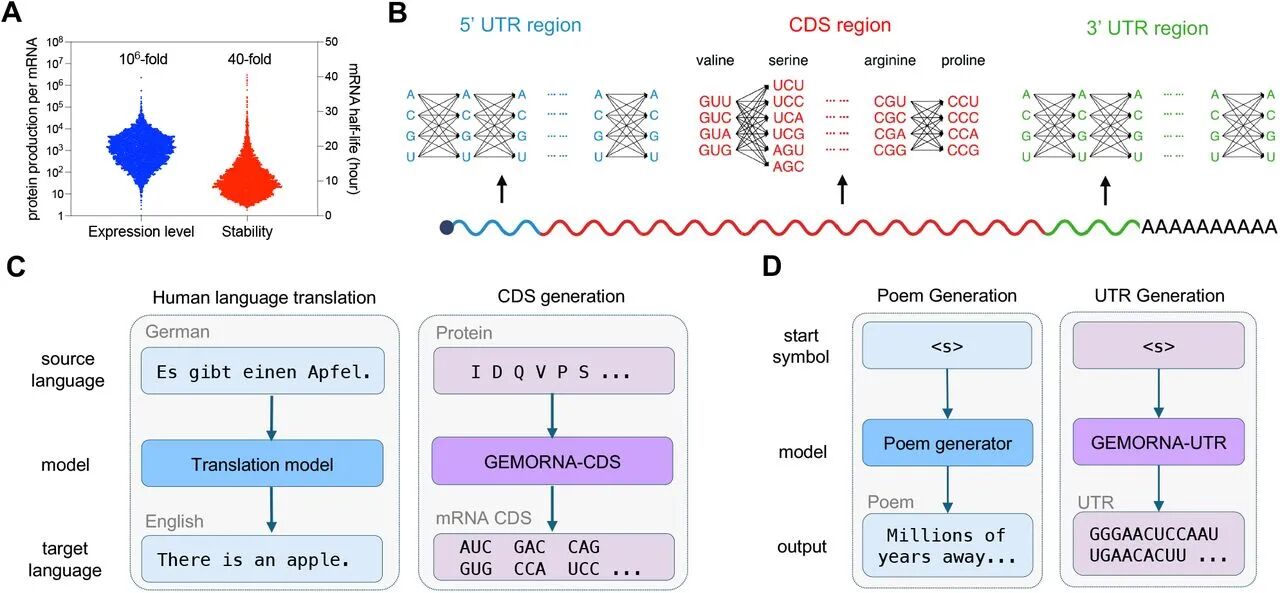
图1:GEMORNA 设计思路概述
A图 显示 4272 个人源内源性 mRNA 的表达量与半衰期差异,凸显优化必要性;B图 示意 mRNA 的 5’UTR、CDS、3’UTR 组成及庞大的序列空间;
C图 类比 CDS 设计为 “德语→英语翻译”(从蛋白质序列生成 mRNA);
D图 类比 UTR 设计为 “诗歌创作”(无蛋白质约束,自由生成)。
结果明确 GEMORNA 将 RNA 序列视为 “遗传语言” 的设计逻辑。
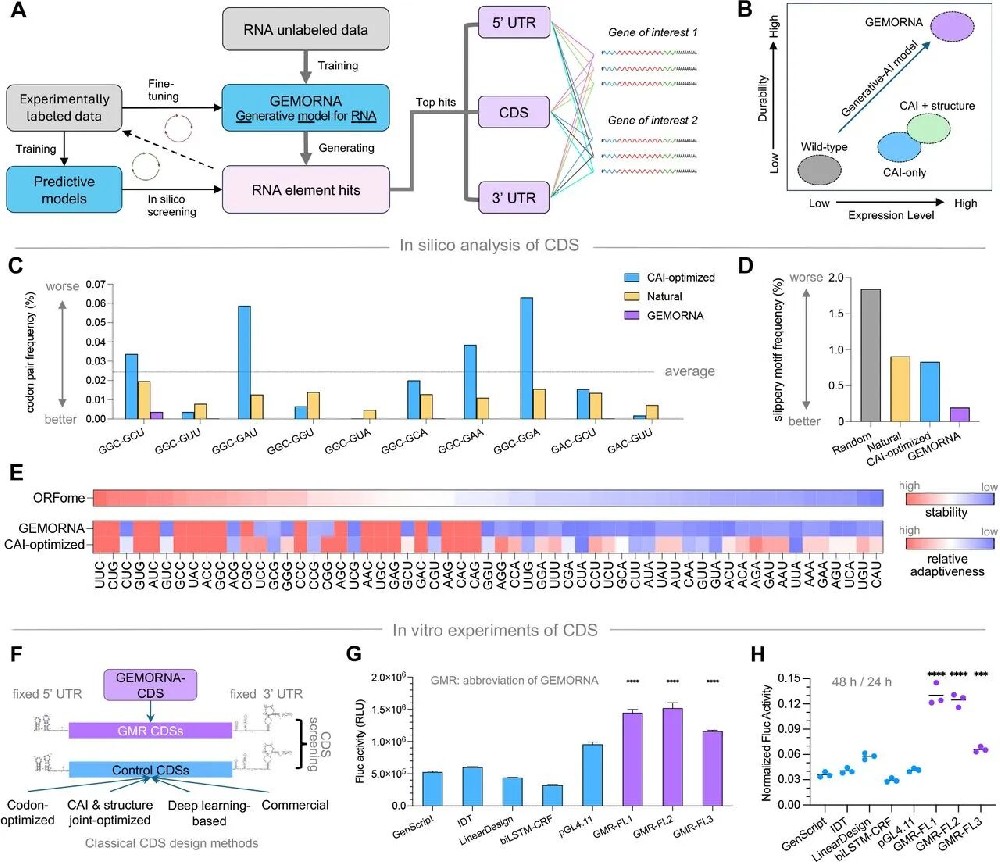
图2:GEMORNA-CDS 的表征与体外验证
A-B图 展示 GEMORNA 工作流程(训练→生成→筛选)及优于传统方法的表达量和稳定性;
C图 显示 GEMORNA-CDS 的不良密码子对频率显著低于 CAI 优化序列;
D图 滑动机理(+1 核糖体移码位点)频率低于对照;
E图 GEMORNA-CDS 更偏好稳定密码子,与密码子稳定系数(CSC)相关性更高F-H图 体外实验显示,GEMORNA-CDS 的 Firefly 荧光素酶活性在 24h 是 biLSTM-CRF 的 4.7 倍,48h/24h 活性比更高,证明稳定性增强。
结果证实 GEMORNA-CDS 通过优化密码子使用和序列稳定性提升翻译效率。
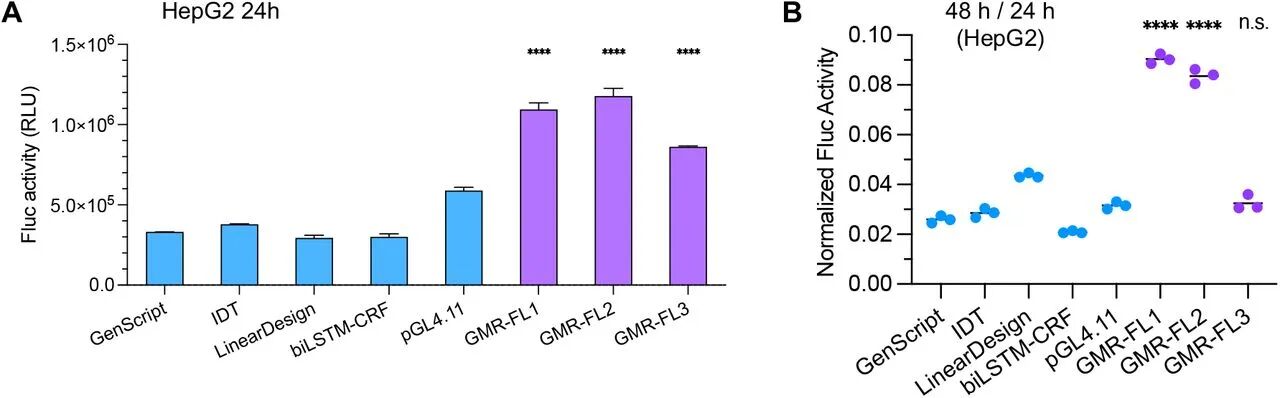
图3:GEMORNA-UTR 的表征与体外验证
A图 显示 GEMORNA-5’UTR 与天然 UTR 的最大相似度(MIS)多 < 0.2,证明序列新颖性;
B图 GEMORNA-5’UTR 的核糖体负载(MRL)和标准化最小自由能(MFE)分布右移,表明翻译起始效率更高;
C图 二维分析显示 GEMORNA-5’UTR 同时具备高 MRL 和高 MFE;
D图 体外实验中,GEMORNA-5’UTR 的 Gaussia 荧光素酶活性与 BNT162b2 的 UTR 相当或更高;
E-F图 GEMORNA-3’UTR 的 GC 含量和预测稳定性更高,48h 时 HEK293T/Jurkat 细胞中 Gluc 活性是 BNT162b2 UTR 的 1.5-2 倍。
结果表明 GEMORNA-UTR 通过优化结构和序列特征增强 mRNA 翻译起始和稳定性。
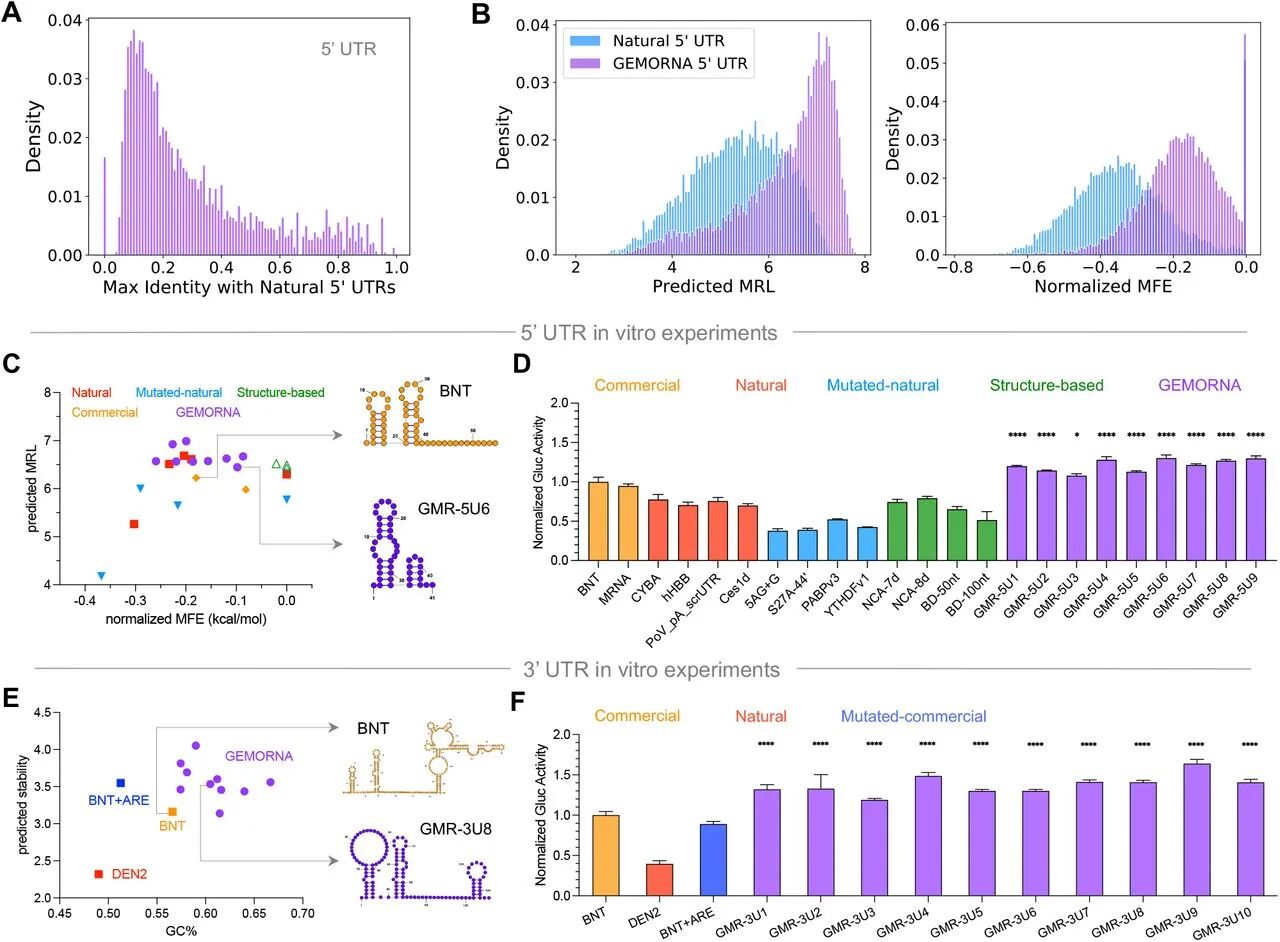
图4:GEMORNA 全长 mRNA 的表达与免疫原性
A-B图 全长 mRNA(GEMORNA-CDS+UTR)表达 Firefly 荧光素酶,在 HEK293T 细胞中 48h 活性是 Benchmark-FL2(pGL4.11 CDS+BNT UTR)的 8.2 倍,HepG2 细胞中效果一致;
C图 NanoLuc 实验显示,7 个 GEMORNA 设计中有 5 个表达量高于对照,72h 时 HEK293T/HepG2 细胞中最大提升达 7.9 倍 / 9.1 倍;
D图 COVID-19 mRNA 疫苗(GMR-CV1)在小鼠中诱导的抗刺突 IgG 滴度是 BNT162b2 的 4 倍。
结果证实 GEMORNA 整合的全长 mRNA 可同时提升表达量和免疫原性。
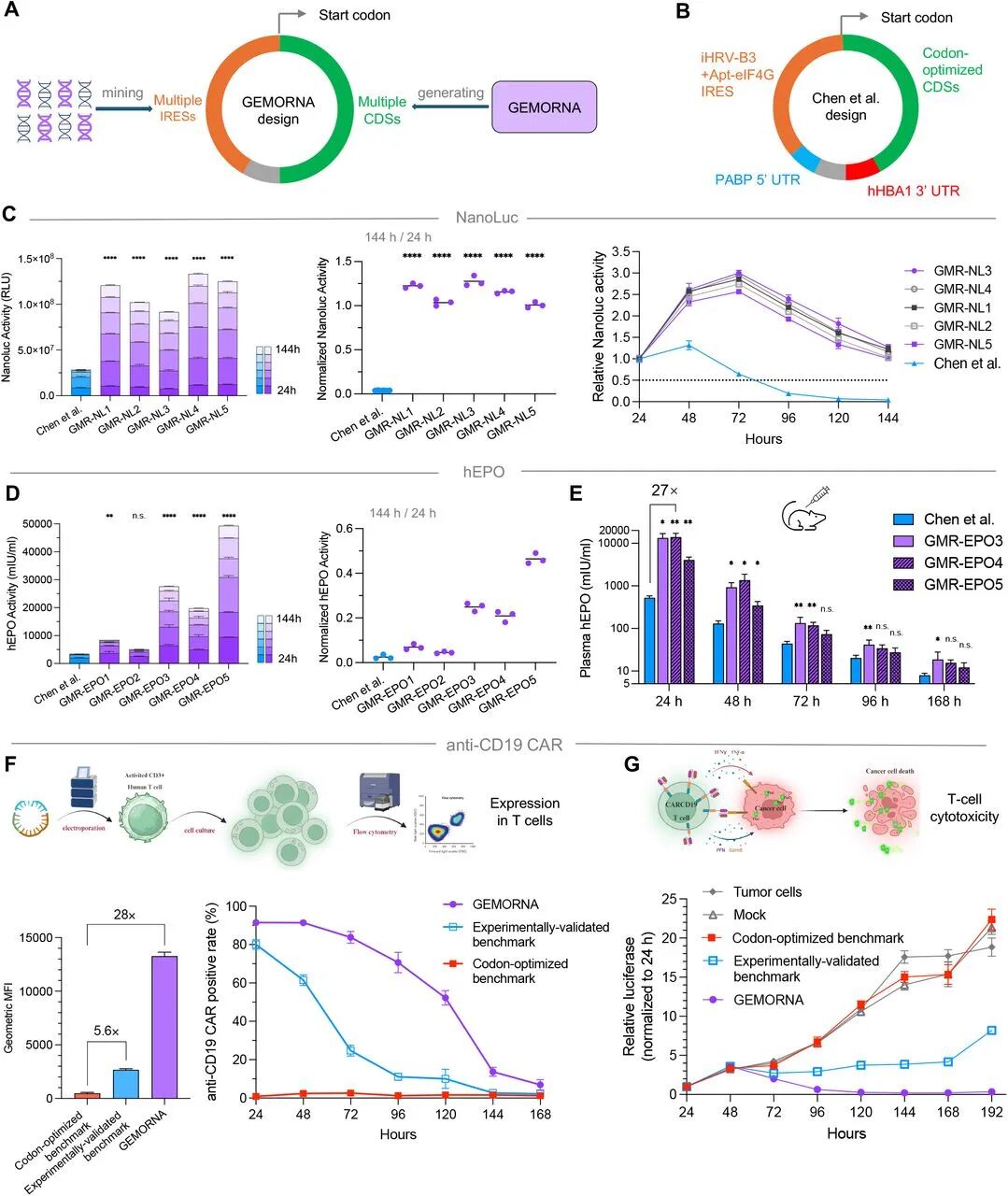
图5:GEMORNA 生成 circRNA 的功能验证
A-B图 GEMORNA-circRNA 整合 AI 生成的 CDS 和挖掘的 IRES,对比 Chen et al. 的优化 circRNA;
C图 NanoLuc-circRNA 在 HEK293T 细胞中 144h 累积表达量是对照的 4.7 倍,且 72h 活性是 24h 的 3 倍(对照 48h 后持续下降);
D图 hEPO-circRNA 在 HEK293T 细胞中 144h 累积表达量是对照的 13.8 倍,144h/24h 活性比达 46.5%(对照仅 2.5%);
E图小鼠体内 hEPO 表达量最高是对照的 27 倍,且 168h 仍维持高表达;
F-G图 CD19-CAR-circRNA 转染 T 细胞后,24h 阳性率是密码子优化对照的 28 倍,120h 仍有 50% 阳性细胞,对 NALM-6 肿瘤细胞的杀伤活性显著高于专利对照。
结果表明 GEMORNA-circRNA 兼具高表达、长稳定性和强治疗 efficacy。
GEMORNA 作为基于 Transformer 的深度生成模型,突破传统 mRNA 优化方法的局限,通过类比人类语言处理策略,生成的 CDS 可优化密码子使用和序列稳定性、UTR 可提升翻译起始效率,整合后的全长 mRNA 在体外表达量最高提升 8.2 倍、COVID-19 疫苗体内抗体滴度提升 4 倍;同时可扩展至 circRNA 设计,生成的 hEPO-circRNA 体内表达量提升 27 倍、CD19-CAR-circRNA 可增强 T 细胞抗肿瘤活性,且适配 m¹Ψ 修饰,为 mRNA/circRNA 疗法在疫苗、蛋白替代治疗、CAR-T 治疗等领域的应用提供高效工具。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:光激活的rGO-PVA纳米纤维增强心肌细胞和神经元功能