常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-09-07 09:13:15 细胞资源库平台 访问量:79
英文标题:Cancer vaccine from intracellularly gelated tumor cells functionalized with CD47 blockage and damage-associated molecular pattern exposure
中文标题:细胞内凝胶化肿瘤细胞联合CD47阻断与DAMP暴露构建癌症疫苗,有效预防和治疗肿瘤
发表期刊:《Cell Reports Medicine》
影响因子:11.7
作者单位:澳门大学中华医药研究院、深圳大学医学院
作者信息:
Cheng Gao, Ruifeng Luo, Cheryl H.T. Kwong, Jinwei Liu, Mian Tang, Beibei Xie, Tianshun Duan, Ruibing Wang
肿瘤细胞疫苗的挑战
传统灭活方法制备的全肿瘤细胞疫苗免疫原性不足,难以激发有效的抗肿瘤免疫应答。
免疫逃逸机制
肿瘤细胞通过高表达CD47(“别吃我”信号)和低表达DAMP(“吃我”信号)逃避免疫清除。
研究创新点
利用细胞内凝胶化技术保持肿瘤细胞形态和抗原完整性。
通过DOX预处理诱导DAMP暴露,增强“吃我”信号。
使用抗CD47抗体阻断“别吃我”信号。
构建CD47-DOX-GMC疫苗,显著提升免疫原性。
细胞内凝胶化技术
使用低分子量PEG-DA和光引发剂I2959,通过冻融循环和UV照射在肿瘤细胞内形成水凝胶,维持细胞结构和抗原完整性。
表面功能化
DOX预处理诱导CRT等DAMP分子暴露。
抗CD47抗体阻断CD47-SIRPα相互作用。
体外实验
流式细胞术和共聚焦显微镜验证巨噬细胞和树突状细胞对疫苗的吞噬作用。
Western blot和LC-MS/MS分析抗原保留和免疫激活相关蛋白表达。
体内实验
预防性疫苗实验:接种疫苗后挑战肿瘤细胞。
治疗性疫苗实验:在已建立肿瘤模型中评估疫苗疗效。
联合免疫检查点抑制剂(aPD-L1)增强疗效。
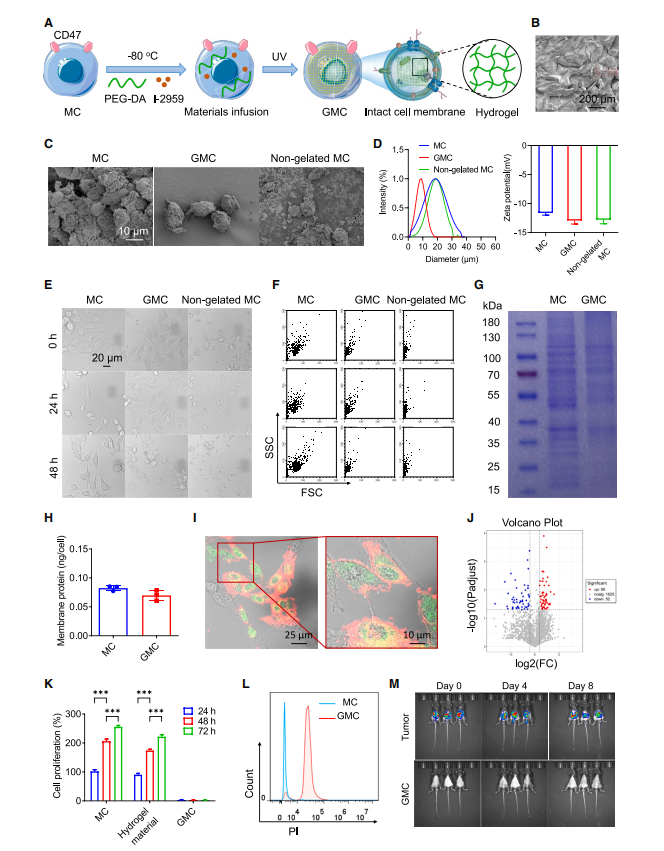
图1:胶原蛋白凝胶(GMC)维持了细胞形态和完整抗原蛋白,但未表现出细胞活性
(A) GMC结构示意图。
(B) PEG水凝胶的扫描电镜图像。
(C) MC、GMC及未凝胶化MC的扫描电镜图像。
(D) MC、GMC及未凝胶化MC的平均直径与zeta电位
(E和F) MC、GMC及未凝胶化MC在PBS中放置不同时间(0、24、48小时)后的共聚焦显微图像(E)及FSC-SSC散点图(F)。
(G) MC和GMC膜蛋白的考马斯亮蓝染色结果。
(H) MC和GMC膜蛋白的BCA蛋白定量分析。
(I) 用红色荧光膜染料DiI和绿色荧光水凝胶材料FITC-PEG-DA标记的GMC共聚焦荧光成像。(J)MC和GMC全蛋白的LC-MS/MS分析。
(J) 游离MC、经水凝胶处理的MC及GMC的细胞生长评估。
(K) PI染色MC和GMC的流式细胞术分析。
(M) C57BL/c小鼠腹腔注射MC和GMC的IVIS成像(n = 3)。实验重复三次(n = 3),数据以均值±标准差表示。
统计分析中(D)和(H)采用单因素方差分析,其余分析采用双因素方差分析。***p % 0.001。
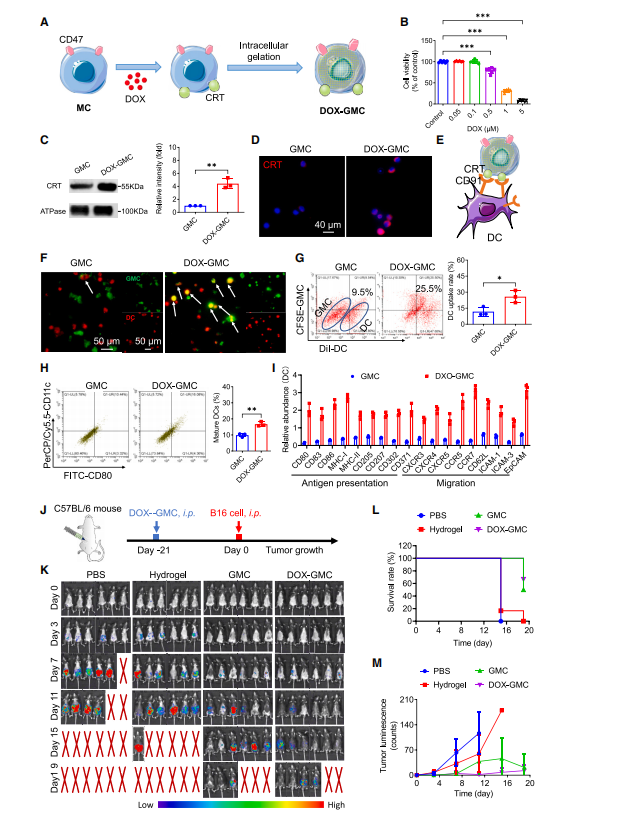
图2:肿瘤细胞间导肽(ICD)可增强树突状细胞(DC)摄取和抗原呈递,而DOX-GMC疫苗能抑制肿瘤生长。
(A) DOX-GMC疫苗结构示意图。
(B) 经不同浓度DOX(0.05、0.1、0.5、1和5 mM)处理24小时的B16-F10细胞活力检测。
(C) GMC与DOX-GMC的CRT蛋白表达量Western blot分析。
(D) GMC和DOX-GMC红色荧光探针标记的CRT蛋白荧光成像。
(E) CD91-CRT相互作用增强DC与DOX-GMC识别的示意图。
(F) 共聚焦荧光成像显示DC对GMC和DOX-GMC的吞噬行为(红色:DiI染色DC;绿色:CFSE标记GMC和DOX-GMC)。
(G) 流式细胞术定量分析吞噬率。
(H) GMC和DOX-GMC处理6小时后DC中CD80+ CD11c+细胞比例。
(I) 通过LCMS/MS测定GMC和DOX-GMC孵育的DC中抗原呈递相关蛋白与迁移相关蛋白的相对丰度。
(J) 6周龄C57BL/6雄性小鼠腹腔接种PBS、10 mg/kg水凝胶、GMC和DOX-GMC(每只10^6个,n=6),随后用B16-F10-Luc细胞攻毒。
(J) 使用IVIS在不同时间点(第0、3、7、11、15、19天)监测肿瘤生物发光。
(L和M) 黑色素瘤荷瘤小鼠体内生物发光强度变化的存活率曲线(N)及半定量分析(M)。除体内抗肿瘤研究外,其余实验均重复三次(n = 3),数据以均值±标准差表示。其中(B)组采用t检验进行统计分析,(J)组使用双因素方差分析法,其余实验均采用单因素方差分析法。
统计学显著性标记为:*p<0.05,**p<0.01,***p<0.001。
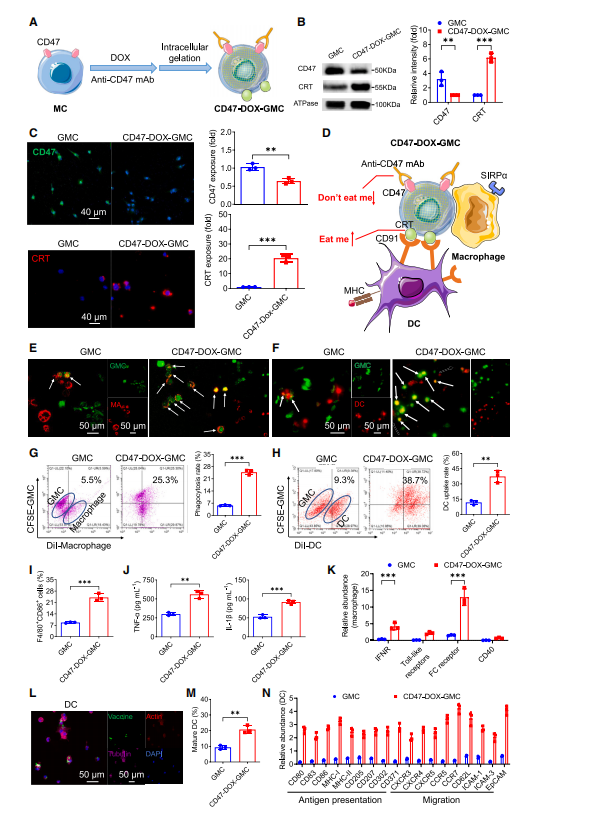
图3:DAMP暴露与CD47阻断通过诱导“吃我信号”并抑制“别吃我信号”,增强了CD47-DOX-GMC的免疫原性
(A) CD47-DOX-GMC构建示意图。
(B) GMC与CD47-DOX-GMC的CRT和CD47表达的Western blot分析。
(C) GMC与CD47-DOX-GMC中绿色荧光探针标记的CD47蛋白及红色荧光探针标记的CRT蛋白的共聚焦荧光成像。
(D) 通过诱导CD91-CRT相互作用并阻断SIRPa-CD47相互作用,增强巨噬细胞和树突状细胞对CD47-DOX-GMC的识别机制示意图。
(E) 巨噬细胞与GMC、CD47-DOX-GMC孵育6小时后的吞噬行为共聚焦荧光成像。红色:DiI染色的巨噬细胞;绿色:CFSE染色的GMC与CD47-DOX-GMC。
(F) 树突状细胞与GMC、CD47-DOX-GMC孵育6小时后的吞噬行为共聚焦荧光成像。红色:DiI染色的树突状细胞。绿色:CFSE染色的GMC和CD47-DOX-GMC。
(G和H) 通过流式细胞术对巨噬细胞(G)和树突状细胞(H)的吞噬率进行定量分析。
(I) 经GMC和CD47-DOX-GMC处理6小时后,巨噬细胞中F4/80+ CD86+细胞的比例。
(K) 经GMC和CD47-DOX-GMC处理6小时后,巨噬细胞释放的TNF-a和IL-1b水平。
(L) 分别显示经GMC和CD47-DOX-GMC处理的巨噬细胞中上调免疫反应相关蛋白的数量及相对丰度。
(M) 共聚焦荧光成像显示DC在1小时孵育后CD47-DOX-GMC的内化及胞内定位情况。
(N) 经GMC和CD47-DOX-GMC处理6小时后,DC中CD80+ CD11c+细胞的比例。
(N) 分别显示经GMC和CD47-DOX-GMC处理的DC中上调免疫反应相关蛋白的数量及相对丰度。实验重复三次(n = 3),数据以均值±标准差表示。其中(B)、(K)和(N)的统计分析采用双因素方差分析,其余分析采用单因素方差分析。**p % 0.01和***p % 0.001。
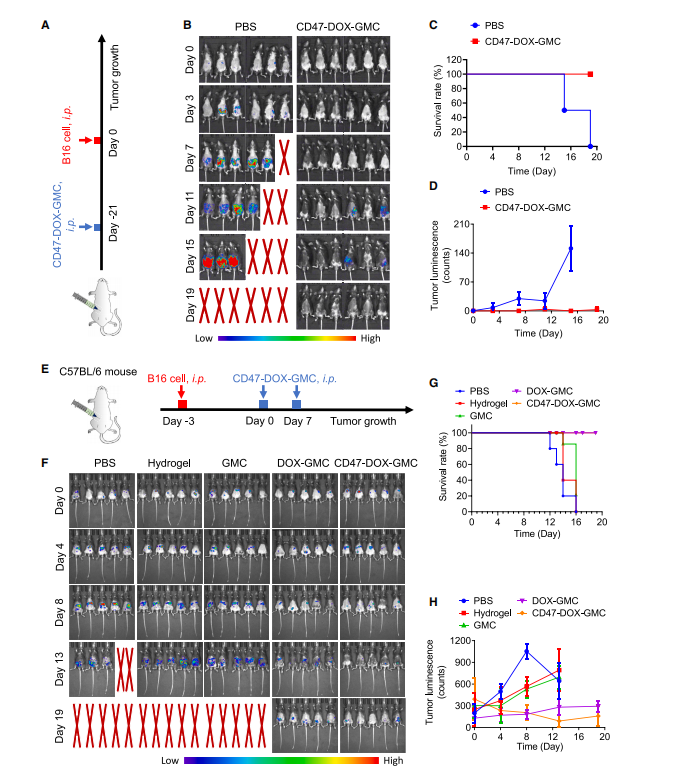
图4:CD47-DOX-GMC有效预防肿瘤并治疗既有肿瘤
(A) 将6周龄的C57BL/6雄性小鼠腹腔注射PBS和CD47-DOX-GMC(每只10^6个,n=6),随后用B16-F10-Luc细胞进行攻毒。
(B) 通过IVIS系统在不同时间点(第0、3、7、11、15和19天)监测肿瘤生物发光信号。
(C和D) 记录黑色素瘤荷瘤小鼠的生存率曲线(C)及生物发光强度变化的半定量分析(D)。
(E) 将6周龄C57BL/6雄性小鼠腹腔注射B16-F10-Luc细胞3天后,分别接种PBS、10 mg/kg水凝胶、GMC、DOX-GMC及CD47-DOX-GMC(每只小鼠接种10^6个细胞,共5组),在第0天和第7天各接种一次(共两次)。
(F) 使用IVIS系统监测肿瘤生物发光信号在不同时间点(第0、4、8、13、19天)的变化。
(G和H) 分别展示黑色素瘤荷瘤小鼠的生存率曲线(G)与生物发光强度半定量分析(H)。
图(D)和(H)数据以均值±标准差表示。
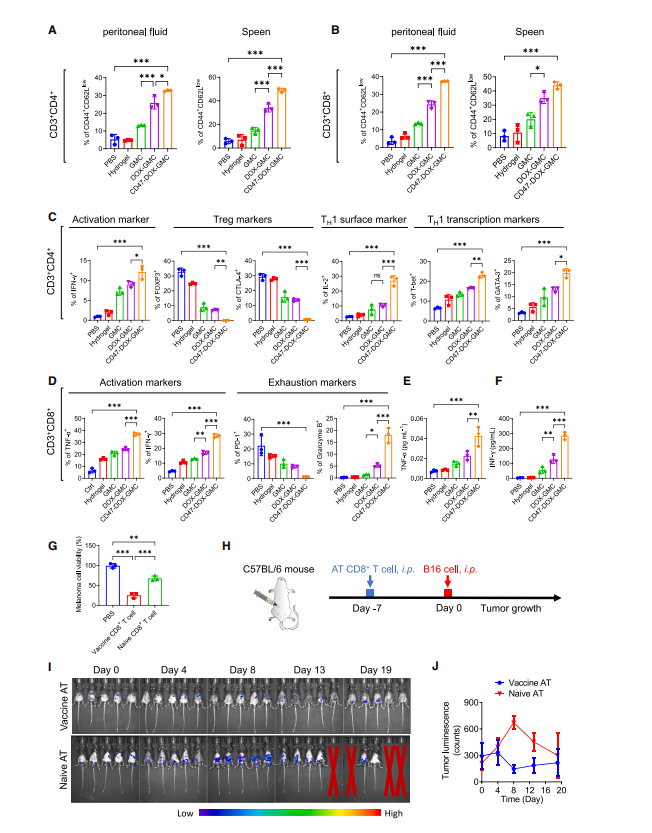
图5:CD47-DOX-GMC显著激活肿瘤相关淋巴细胞及细胞因子以实现抗肿瘤治疗效果(A和B)
6周龄C57BL/6雄性小鼠经腹腔注射B16-F10-Luc细胞3天后,分别接种PBS、10 mg/kg水凝胶、GMC、DOXGMC及CD47-DOX-GMC(每只10^6个细胞,n=3),在第0天和第7天共接种两剂。第12天采集腹腔液和脾脏样本,通过流式细胞术分析T细胞类型及其活化状态。
(A) 治疗组小鼠腹水与脾脏中具有效应记忆(CD44+CD62L低)表型的CD4+和CD8+ T细胞百分比。
(C) 治疗组小鼠腹水中表达活化标志物IFN-γ、调节性T细胞标志物FoxP3和CTLA4、以及TH1表面标志物和转录标志物的CD4+细胞百分比。
(D) 治疗组小鼠腹水中表达活化标志物TNF-α和IFN-γ、耗竭标志物PD-1及颗粒酶B的CD8+细胞百分比。
(E和F)治疗组小鼠腹水中TNF-α(E)和IFN-γ(F)的细胞因子分析。
(G) 含有未免疫或已免疫小鼠腹膜CD8+ T细胞的共培养体系中肿瘤细胞死亡情况。
(H) 6周龄C57BL/6雄性小鼠腹膜接种2×3×10⁵磁富集CD8+细胞后,1天后用B16-F10- Luc细胞进行攻毒实验(n = 5)。
(H) 使用IVIS在不同时间点(第0、4、8、13、19天)监测肿瘤生物发光信号。
(J) 肿瘤荷瘤小鼠生物发光强度变化的半定量分析。除体内抗肿瘤成像外的实验重复三次(n = 3),数据以均值±标准差表示。所有统计分析均采用单因素方差分析。*p % 0.05,**p % 0.01,***p % 0.001。
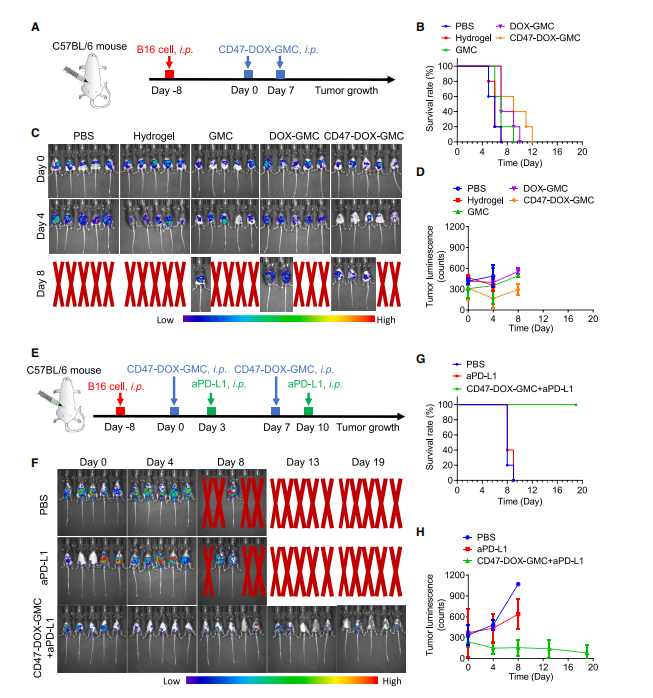
图6:免疫检查点抑制剂增强CD47-DOX-GMC诱导的T细胞肿瘤杀伤效应
(A) 为建立黑色素瘤荷瘤小鼠模型,将B16-F10-Luc细胞腹腔接种至6周龄C57BL/6雄性小鼠体内培养8天后,分别于第0天和第7天以每只10^6个剂量的GMC、DOXGMC及CD47-DOX-GMC进行两次腹腔给药(n = 5)。
(B) 通过IVIS系统在不同时间点(第0、4、8天)监测肿瘤生物发光。
(C和D) 记录黑色素瘤荷瘤小鼠的生存率曲线(C)及生物发光强度变化的半定量分析(D)。
(E) 黑色素瘤荷瘤小鼠在CD47-DOX-GMC治疗3天后,于第3天和第10天分别以4 mg/kg剂量腹腔注射aPD-L1(n=5)。
(F) 通过IVIS系统在不同时间点(第0、4、8、13、19天)监测肿瘤生物发光。
(G和H) 记录黑色素瘤荷瘤小鼠的生存率曲线(G)及生物发光强度变化的半定量分析(H)。
图(D)和(H)数据以均值±标准差表示。
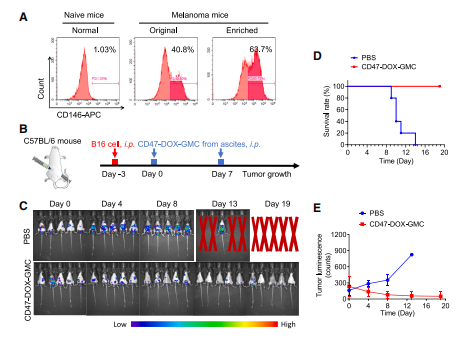
图7:腹水来源的个性化CD47-DOX-GMC疫苗展现显著抗肿瘤效果
(A) 从荷瘤小鼠腹水中分离B16-F10细胞,并通过过滤捕获法进行富集。
(B) 对6周龄C57BL/6雄性小鼠腹腔注射B16-F10-Luc细胞3天后,以每只10^6个细胞的剂量接种腹水源CD47-DOX-GMC疫苗(n = 5),分别在第0天和第7天各接种一次。
(C) 使用IVIS系统监测不同时间点(第0、4、8、13、19天)的肿瘤生物发光信号。
(D和E) 记录黑色素瘤荷瘤小鼠的生存率曲线(D)及生物发光强度变化的半定量分析(E)。
其中(E)数据以均值±标准差表示。
细胞内凝胶化肿瘤细胞(GMC)保持完整形态和抗原,无增殖能力。:CD47-DOX-GMC显著提升巨噬细胞和DC的吞噬率和活化水平。使用腹水或皮下肿瘤细胞成功构建个性化疫苗,展示临床转化潜力。
细胞内凝胶化技术可有效维持肿瘤抗原完整性。
CD47阻断与DAMP暴露协同增强疫苗免疫原性。
CD47-DOX-GMC疫苗在预防和治疗模型中均表现出色。
该平台技术适用于多种肿瘤类型,具备临床转化前景。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:HIV Tat蛋白竟是HBV的帮凶?共感染模型揭示肝病进展新机制CDK9 抑制剂或成突破口