常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-08-17 12:58:59 细胞资源库平台 访问量:165
静脉畸形(Venous Malformations,VMs)是最常见的血管畸形,发病率为1-2/10,000,患病率为1%。VMs表现为静脉扩张和不规则的平滑肌细胞覆盖,导致显著的不适、解剖结构扭曲和器官功能障碍。目前的治疗方法包括硬化疗法和手术切除,均具有侵入性且很少能根治,病变复发率高。迄今为止,美国食品药品监督管理局(FDA)尚未批准任何治疗VMs的药物,尽管系统性口服西罗莫司/雷帕霉素在临床试验中显示出希望。
VMs的主要病因是静脉内皮细胞(VECs)中的体细胞TIE2 L914F(2740 C>T)突变,这是与VMs相关的最常见改变。TIE2(TEK)是受体酪氨酸激酶亚家族的成员,主要在内皮细胞中表达,在血管生成、血管重塑、成熟和完整性中发挥重要作用。尽管VM来源的内皮细胞(VM-ECs)携带这种体细胞突变,被认为是创建患者特异性疾病模型的金标准,但由于病变样本有限和费力的细胞纯化过程,突变细胞相对于正常细胞的稀有性使得收获足够的细胞用于下游应用变得困难。
传统的利用转基因动物繁殖的方法不适合研究VMs,因为致病性体细胞突变通常是非遗传性的,这使得产生足够的疾病模型库存变得不切实际。另一种替代方法是使用过表达多个拷贝TIE2-L914F突变的人脐静脉内皮细胞(HUVECs)来模拟VMs,但这种方法存在局限性:VM患者的VM-ECs通常只携带一个突变基因TIE2-L914F的拷贝,疾病严重程度可能与基因剂量相关;HUVECs缺乏VM患者的特定遗传背景;HUVECs的增殖能力有限,阻碍了大规模药物筛选的潜力。
近期,北京大学王凯、王茜、孔炜和谢正伟等在Cell Stem Cell期刊上发表了题为Generation of iPSC-derived human venous endothelial cells for the modeling of vascular malformations and drug discovery的研究论文,该研究建立了基于iPSC的静脉畸形疾病模型,为血管畸形的病理机制研究和药物开发提供了重要的技术平台。通过精确控制细胞周期动力学和信号通路,成功实现了动静脉内皮细胞的谱系特异性分化,这为血管发育生物学研究提供了有价值的工具。
1,视黄酸促进早期G1期阻滞以增强静脉内皮细胞分化 。研究建立了一种从人诱导多能干细胞(iPSCs)分化为静脉内皮细胞(iVECs)和动脉内皮细胞(iAECs)的稳定协议。通过操控关键信号通路,特别是视黄酸(RA)信号通路,成功实现了动静脉谱系的特异性分化。研究发现RA能够通过调节细胞周期动力学,特别是促进早期G1期阻滞来增强iVEC分化效率。使用FUCCI细胞周期报告系统,研究者观察到在动脉-静脉规格化过程中,iAECs倾向于保持在晚期G1期(CDT1+/GMNN-),而iVECs分化偏向早期G1期(CDT1-/GMNN-)。与iVEC组相比,不含RA的iVECs倾向于保持在晚期G1期而非早期G1期,从而限制了它们响应静脉特异性刺激和采用静脉细胞身份的潜力。
2,单细胞转录组学重建动静脉分化轨迹 。通过对分化过程中三个时间点(第3、4、6天)的单细胞RNA测序,研究构建了详细的动静脉分化转录图谱。在iAEC分化过程中,鉴定出7个分子上不同的细胞群:外侧板中胚层细胞、早期中胚层细胞、动脉内皮细胞、壁细胞、内皮祖细胞、增殖性壁细胞和增殖性内皮细胞。早期中胚层细胞(TBXT+)通过外侧板中胚层阶段(HAND1+)发育为内皮祖细胞(ETV2+),在第4天达到内皮祖细胞峰值。类似地,在iVEC分化中也鉴定出7个细胞群,包括静脉内皮细胞(PECAM1+/NR2F2+/EPHB4+)。RNA速度分析进一步确认了这些细胞状态转换,揭示了动静脉分化的复杂性。
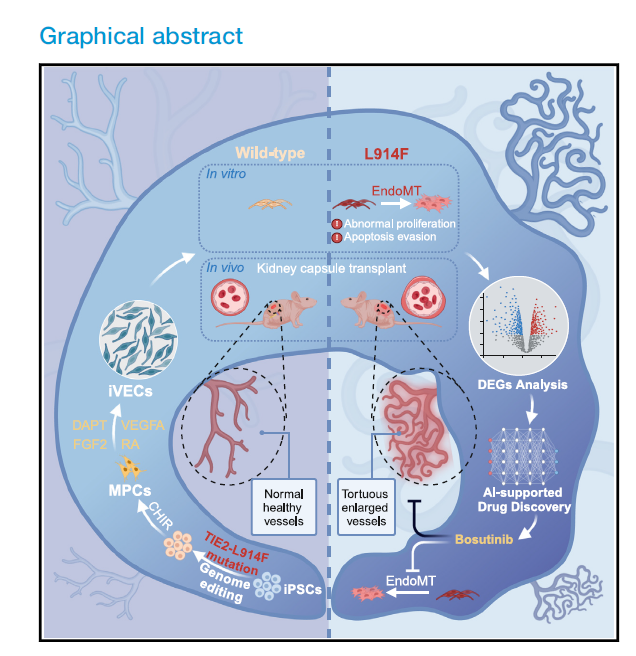
图1 流程示意图
3,功能验证证实iVECs和iAECs的谱系特异性。功能分析显示iVECs表达静脉标志物COUP-TFII,而iAECs表达动脉主要调节因子CXCR4。两种细胞类型都表达泛内皮细胞标志物CD31、CD144和vWF。iVECs表现出典型的静脉功能特征:上调粘附分子并在TNF-α刺激下招募更多THP-1单核细胞,表达较低水平的NOS3并产生较少的一氧化氮,对剪切应力表现出适度的极化反应。体外管腔形成实验和体内移植实验都证实了这些细胞的血管形成能力。移植后一周,两组都观察到血管形成,并保持谱系特异性标志物EphB4和CXCR4的表达。
4,TIE2 L914F突变的iVECs重现静脉畸形表型。使用CRISPR-Cas9基因编辑技术,研究者在iPSCs中引入了杂合子TIE2-L914F突变。突变的iVECs(而非iAECs)显示出VM的典型病理特征:TIE2下调和TIE2、AKT、mTORC磷酸化升高,这是VMs的标志性特征。突变细胞还表现出F-肌动蛋白组织紊乱、管腔形成受损、增殖率增加和抗凋亡能力增强。转录组学分析显示突变的iVECs中增殖基因(如DLK1和WT1)表达升高,凋亡相关基因(包括CHCHD2和PRND)表达下降。基因集富集分析表明Hippo、PI3K-Akt和TGF-β信号通路在突变的iVECs中富集,这些都与异常增殖和抗凋亡高度相关。
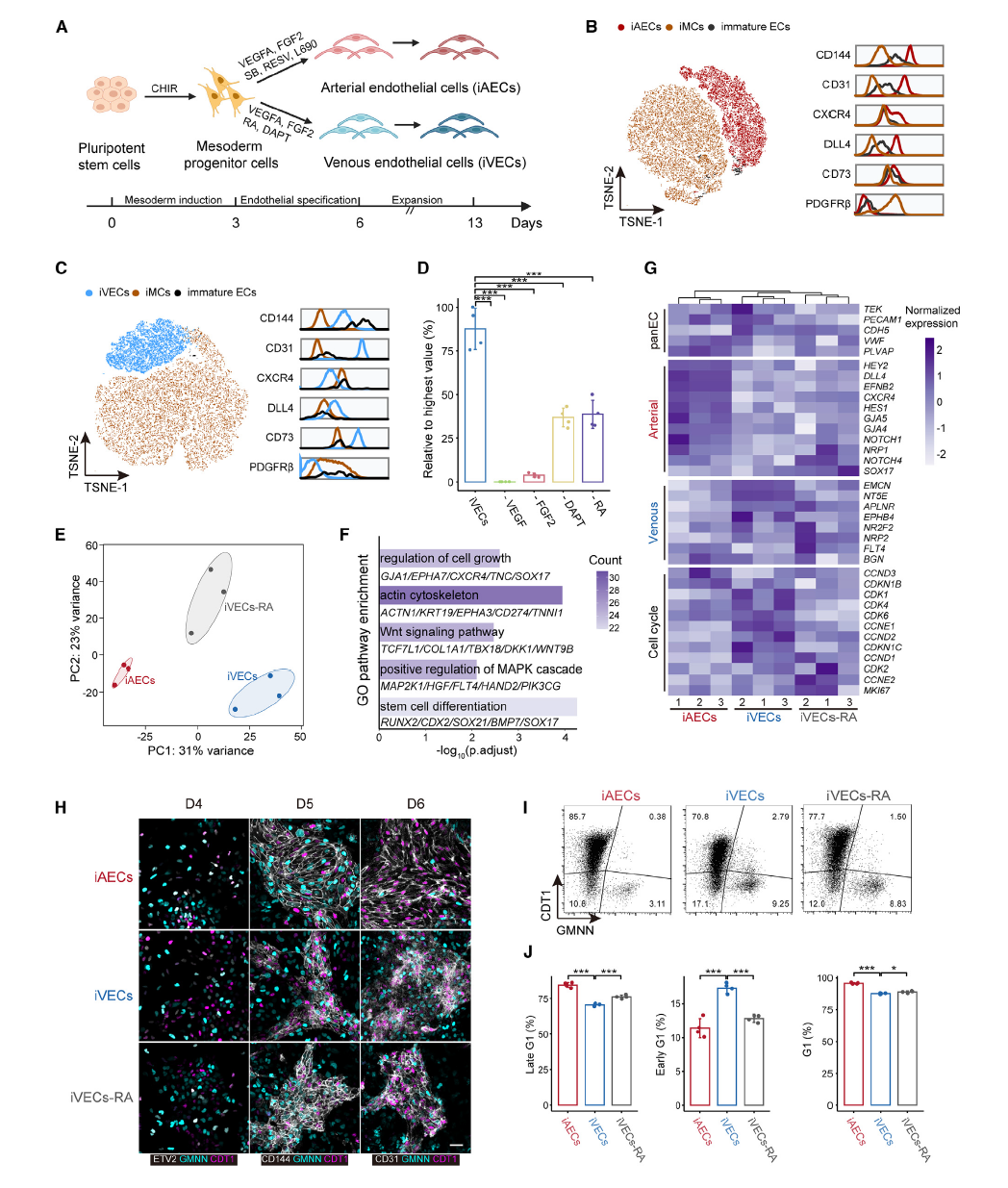
图2 RA通过调控细胞周期促进诱导血管内皮细胞(iVEC)的分化
5,体内模型成功重现静脉畸形病理特征。将携带TIE2-L914F突变的iVECs注射到免疫缺陷小鼠肾包膜下后,与野生型iVECs移植物相比,观察到血管外渗血、异常血管生成和D-二聚体水平升高,这些都是VMs的标志性特征。突变iVEC移植物中的血管呈扩张性(直径>50 μm),类似于VM患者的血管。定量分析显示L914F-iVEC移植物的血管面积显著高于野生型iVECs。免疫荧光染色确认了扩大管腔和突变iVECs移植后的过度增殖表型,这与患者VM病变密切相似。
6,AI辅助药物筛选发现博舒替尼的治疗潜力。研究采用深度学习为基础的疗效系统(DLEPS)结合数字RNA扰动基因测序(DRUG-seq)方法进行药物筛选。DLEPS使用突变与野生型iVECs或原代内皮细胞的差异表达基因列表,在不需要已知或假设靶点的情况下进行化合物库筛选。通过UMAP降维和皮尔逊相关分析,筛选出博舒替尼作为最有前景的治疗候选药物。博舒替尼治疗后,GSEA分析显示与血管生成、血管发育和细胞迁移相关的通路显著下调。体外和体内实验都证实博舒替尼能有效逆转疾病表型,在体内模型中显著减少血管外渗血、异常血管生成、血管面积和管腔长度,其疗效与雷帕霉素相当。
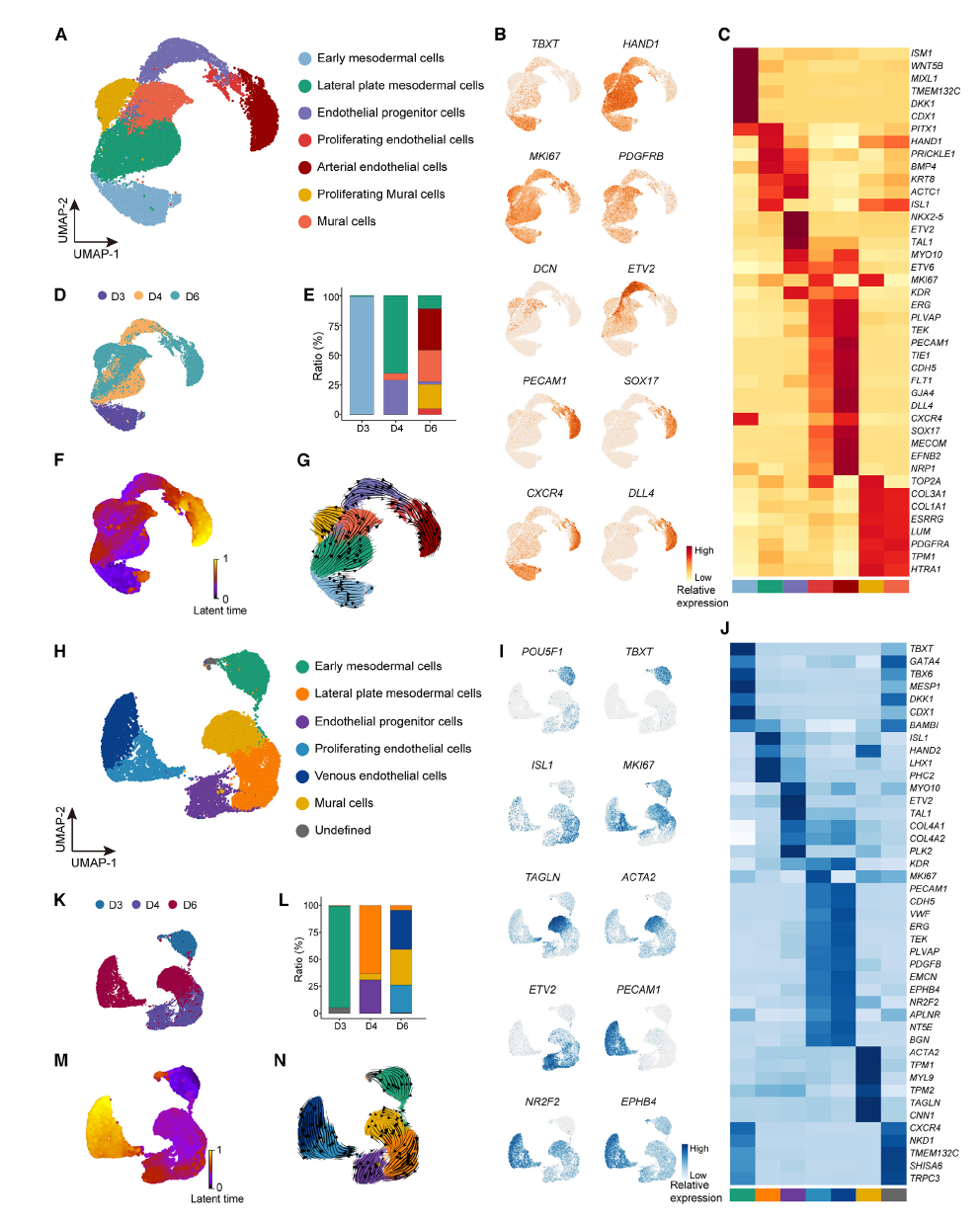
图3 诱导心房内皮细胞(iAECs)和诱导血管内皮细胞(iVECs)分化的转录组重建
7,博舒替尼通过抑制内皮间质转化发挥治疗作用。机制研究显示博舒替尼通过抑制内皮-间质转化(EndoMT)发挥治疗作用。转录组学和蛋白质组学数据显示,博舒替尼处理后,经典内皮标志物(PLVAP、CDH5、KDR和ICAM1)上调,而壁细胞标志物(TAGLN、CNN1和VIM)下调。整合转录组学和蛋白质组学数据发现,几个GO通路被上调,包括内皮细胞分化和细胞连接组装,表明博舒替尼处理后EndoMT的逆转。博舒替尼还能抑制TIE2磷酸化并恢复TIE2表达,同时mTORC的磷酸化和表达都被抑制。此外,博舒替尼还减弱了ERK1/2的磷酸化,从而抑制细胞增殖和血管生成。
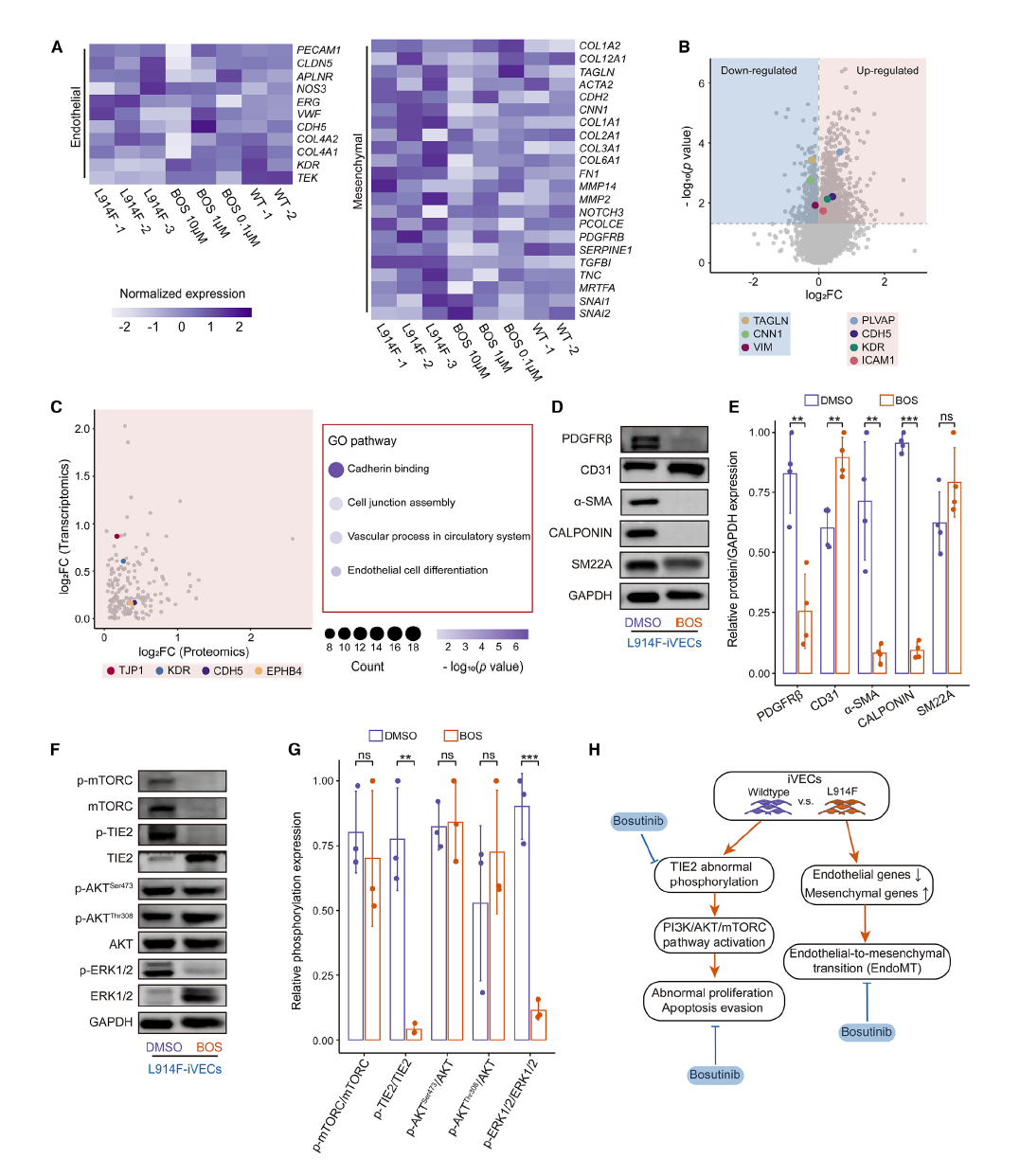
图4 博舒替尼通过抑制内皮 - 间充质转化(EndoMT)逆转血管生成拟态(VMs)
该研究证明了只有静脉内皮细胞(而非动脉内皮细胞)在携带TIE2突变时才会表现出病理性畸形,这一发现解释了为什么临床上没有报告携带相同突变的动脉畸形病例,强调了血管谱系特异性在疾病发病机制中的重要性。研究建立的AI辅助药物筛选平台结合深度学习和高通量转录组分析,为血管疾病的精准治疗提供了新的策略。博舒替尼作为潜在治疗药物的发现,不仅为VM患者提供了新的治疗选择,也为其他血管畸形疾病的治疗提供了参考。该研究的方法学和发现对于推进血管生物学、疾病建模和精准医学具有重要意义。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000