常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-08-16 09:16:17 细胞资源库平台 访问量:178
英文标题:WTAP Mediated m6A Modification Stabilizes PDIA3P1 and Promotes Tumor Progression Driven by Histone Lactylation in Esophageal Squamous Cell Carcinoma
中文标题:WTAP介导的m6A修饰稳定PDIA3P1,促进食管鳞状细胞癌中组蛋白乳酸化驱动的肿瘤进展
发表期刊:《Advanced Science》
影响因子:14.3
作者单位:皖南医学院第一附属医院胸外科、南京医科大学附属无锡人民医院、安徽省非编码RNA基础与临床转化重点实验室
作者信息:
Tao Huang, Qi You, Jiawei Liu, Xuguang Shen, Dengjun Huang, Xinlu Tao, Zhijie He,Chengwei Wu, Xinran Xi, Shouqiang Yu, Feng Liu, Zhihao Wu,* Wenjun Mao,*and Shaojin Zhu*
1.食管鳞癌(ESCC)的现状与挑战
ESCC是常见的消化道恶性肿瘤,预后差,5年生存率仅20%。
长链非编码RNA(lncRNA)在肿瘤进展中发挥重要作用,但PDIA3P1的具体机制尚不明确。
2.代谢重编程与表观调控
肿瘤细胞依赖有氧糖酵解(Warburg效应)产生大量乳酸,乳酸化修饰(如组蛋白乳酸化)与肿瘤发生密切相关。
m6A RNA修饰通过调控lncRNA稳定性参与肿瘤进展。
3.研究创新点
首次揭示PDIA3P1通过糖酵解-乳酸-H4K8la-BMP7轴促进ESCC进展。
阐明WTAP介导的m6A修饰通过IGF2BP1依赖的途径稳定PDIA3P1的分子机制。
1. PDIA3P1的功能验证
通过shRNA和过表达构建稳定细胞系,验证PDIA3P1对糖酵解(2-NBDG摄取、乳酸生成)和肿瘤行为(增殖、凋亡、迁移)的影响。
2. 机制解析
ceRNA机制:PDIA3P1作为miR-152-3p的海绵,上调GLUT1表达。
蛋白互作:PDIA3P1与HK2结合,阻断MARCH8介导的HK2泛素化降解。
表观调控:乳酸诱导H4K8la修饰,激活BMP7转录。
m6A修饰:WTAP介导PDIA3P1的m6A甲基化,IGF2BP1增强其稳定性。
3. 实验技术
RNA-seq、CUT&Tag(H4K8la全基因组定位)、MeRIP-qPCR(m6A检测)、Co-IP(蛋白互作验证)、体内外肿瘤模型
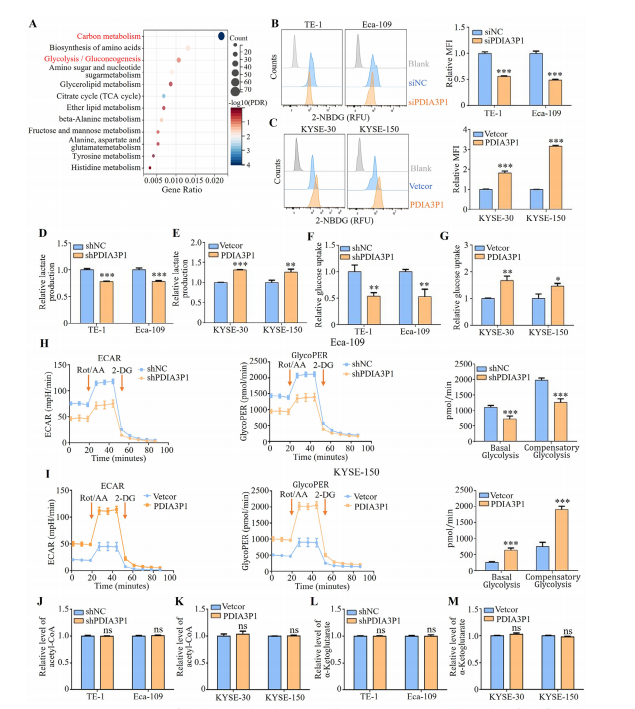
图1:PDIA3P1在食管鳞状细胞癌中作为糖酵解促进因子
(A) 通过RNA测序分析shPDIA3P1与shNC对照组差异基因的KEGG代谢通路。
(B、C) 采用流式细胞术检测转染PDIA3P1-siRNA (B)或PDIA3P1表达质粒(C)细胞的2-NBDG摄取量(MFI:平均荧光强度)。
(C、E) 沉默PDIA3P1 (D)或过表达PDIA3P1(E)细胞的乳酸生成量。
(F、G) 敲低PDIA3P1(F)或过表达PDIA3P1(G)细胞的葡萄糖摄取检测。
(G、I) PDIA3P1敲低(H)或过表达(I)细胞的ECAR(乙酰辅酶A生成速率)、糖酵解质子外排率(glycoPER)、基础糖酵解和代偿性糖酵解的Seahorse代谢分析(Rot/AA:鱼藤酮/抗霉素A;2-DG:2-脱氧-D-葡萄糖)。
(J、K) 沉默PDIA3P1(J)或过表达PDIA3P1(K)细胞的乙酰辅酶A相对水平。
(K、M) 敲低(L)或过表达(M)PDIA3P1细胞的𝛼-酮戊二酸相对含量检测。数据为三次重复实验的平均值±标准差。ns:无显著差异;**P<0.01;***P<0.001。
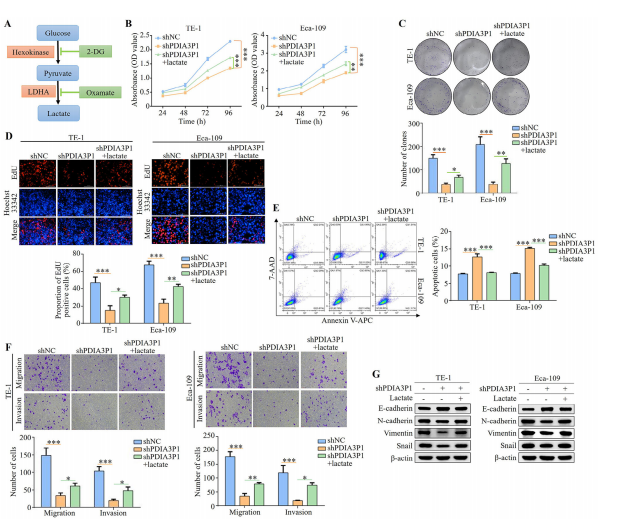
图2:糖酵解介导PDIA3P1调控食管鳞状细胞癌进展
(A) 糖酵解示意图及抑制靶点。
(B-G) 用外源性乳酸(15mm)处理TE-1和Eca-109细胞24小时后,PDIA3P1的稳定沉默效果。
(B) 通过CCK-8检测法评估增殖能力。
(C) 使用集落形成实验分析ESCC细胞生长,上图为统计分析结果。
(D) EdU染色评估ESCC细胞增殖能力,上图为统计分析结果。比例尺:100 μm。
(E) 通过流式细胞术检测TE-1和Eca-109细胞凋亡的Annexin V-APC/7-AAD染色,右图为统计分析结果。
(F) 使用Transwell小室实验检测细胞迁移和侵袭能力,上图为统计分析结果。Transwell比例尺:10 μm。
(G) 蛋白印迹显示E-钙黏蛋白、N-钙黏蛋白、波形蛋白和Snail的表达水平,数据为三次重复实验的平均值±标准差。*P<0.05;**P<0.01;***P<0.001。
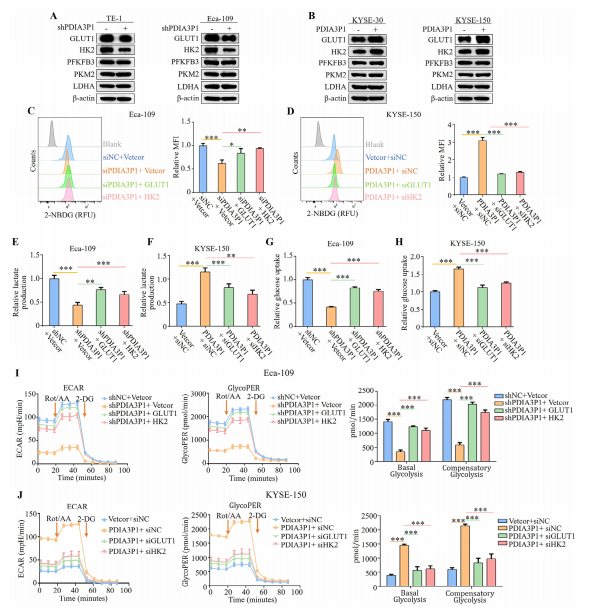
图3:PDIA3P1通过上调GLUT1和HK2促进食管鳞癌细胞糖酵解
(A、B) 西部印迹分析显示,PDIA3P1在TE-1和Eca-109细胞中稳定沉默后(A),或在KYSE-30和KYSE-150细胞中稳定过表达后(B)的GLUT1、HK2、PFKFB3、PKM2及LDHA表达水平。
(B、E、G、I) 在PDIA3P1稳定敲低的Eca-109细胞中,分别转染GLUT1和HK2过表达质粒。
(C、F、H、J) 在PDIA3P1稳定过表达的KYSE-150细胞中,分别转染GLUT1 siRNA和HK2 siRNA。C、D)通过流式细胞术检测相对2-NBDG摄取量(MFI:平均荧光强度)。
(D、F) 使用乳酸检测试剂盒测定相对乳酸生成量。
(H、H) 检测食管鳞癌细胞的相对葡萄糖摄取量。
(I、J)经Seahorse代谢分析仪检测包括ECAR、glycoPER、基础糖酵解速率和代偿性糖酵解速率在内的糖酵解速率。数据以三次重复实验的均值±标准差表示。*P<0.05;**P<0.01;***P<0.001。
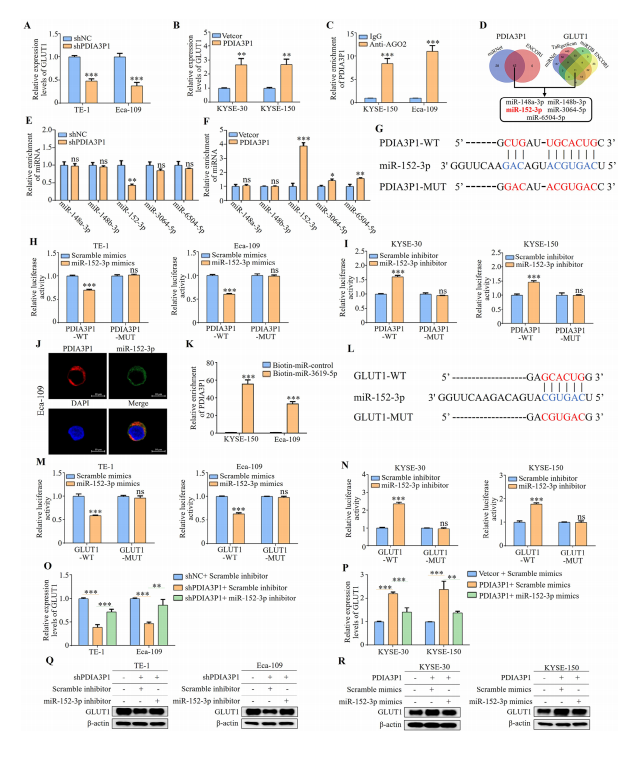
图4:PDIA3P1通过海绵效应调控miR-152-3p来调节GLUT1表达
(A、B) qRT-PCR检测稳定PDIA3P1敲低细胞(A)和稳定PDIA3P1过表达细胞(B)中GLUT1 mRNA水平。
(B) 通过AGO2的RIP实验检测AGO2免疫沉淀沉淀物中的内源性PDIA3P1水平。
(C) 借助miRNet和ENCORI预测PDIA3P1海绵作用的miRNA,以及通过miRNet、TargetScan、miRDB和ENCORI预测的靶向GLUT1的miRNA,交集预测出五个miRNA。
(E、F) AGO2-RIP实验显示PDIA3P1敲低细胞(E)或PDIA3P1过表达细胞(F)中预测的五个miRNA富集情况。G)PDIA3P1与miR-152-3p的潜在结合序列。
(H) TE-1和Eca-109细胞共转染野生型或突变型lncRNA PDIA3P1及miR-152-3p模拟物或对照组,通过双荧光素酶报告基因检测。
(I) 含WT或MUT PDIA3P1转录本的荧光素酶报告基因与miR-152-3p抑制剂或miR对照共转染KYSE-30和KYSE-150细胞。
(J) FISH结果显示PDIA3P1与miR-152-3p在Eca-109细胞胞质中的共定位。
(K) 通过生物素-miR-152-3p或生物素-miR对照富集PDIA3P1。
(L) miR-152-3p在GLUT1 3′-UTR区域的潜在结合序列。
(M) ESCC细胞共转染野生型或突变型GLUT1 3′-UTR及miR-135b-3p模拟物或对照组,通过双荧光素酶报告基因检测。
(N) 含WT或MUT GLUT1 3′-UTR的荧光素酶报告基因与miR-152-3p抑制剂或miR对照共转染ESC癌细胞。O)将miR-152-3p抑制剂转染至稳定PDIA3P1敲低细胞后,通过qRT-PCR检测GLUT1表达水平。P)将miR-152-3p模拟物转染至稳定PDIA3P1过表达细胞后,通过qRT-PCR检测GLUT1表达水平。
(Q、R) 将miR-152-3p抑制剂转染至稳定PDIA3P1敲低细胞(Q)或miR-152-3p模拟物转染至稳定PDIA3P1过表达细胞(R)后,通过Western blot检测GLUT1表达水平。数据以三次重复实验的平均值±标准差表示。*P<0.05;**P<0.01;***P<0.001。
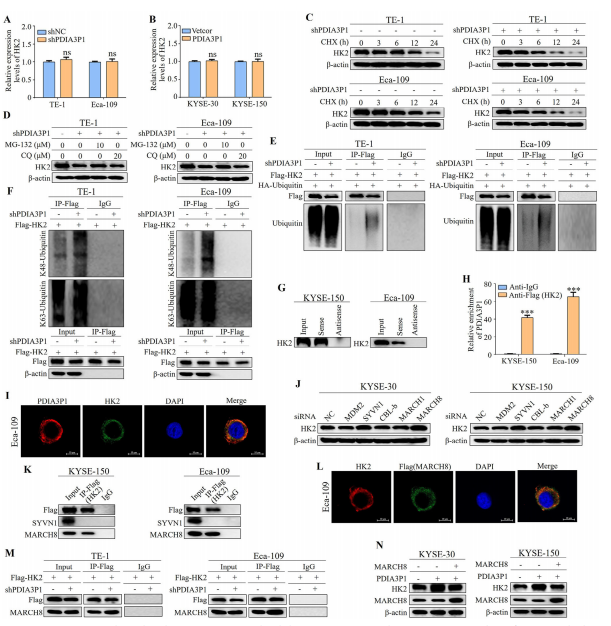
图5:PDIA3P1通过MARCH8介导的泛素-蛋白酶体通路抑制HK2降解
(A、B) qRT-PCR检测PDIA3P1敲低细胞(A)和PDIA3P1过表达细胞(B)中HK2 mRNA水平。
(D) 使用CHX(200 μg/mL)对PDIA3P1敲低细胞进行Western blot分析,检测HK2蛋白稳定性。
(E) PDIA3P1敲低细胞经MG132(10 μM)或CQ(20 μM)处理后HK2表达量的Western blot分析。
(F) 稳定沉默PDIA3P1的细胞中HK2泛素化水平的Western blot检测,IgG作为阴性对照。
(G) 使用Flag抗体对PDIA3P1敲低细胞进行免疫共沉淀,并检测免疫复合物中K48连接泛素和K63连接泛素的表达。
(H) PDIA3P1下拉实验结合Western blot验证其与HK2的相互作用。
(I) 将Flag-HK2质粒转染至KYSE-150和Eca-109细胞后,使用HK2抗体进行RIP实验。(I) FISH和IF分析显示PDIA3P1与HK2在胞质中共定位。
(J) 分别敲低SYVN1、MARCH1、MARCH8、MDM2和CBL-b后,通过Western blot检测HK2表达。
(K) 通过Co-IP实验验证胃癌细胞中SYVN1或MARCH8与HK2的相互作用。
(L) IF分析显示MARCH8与HK2在胞质中共定位。
(M)将Flag-HK2质粒转染至PDIA3P1敲低细胞后,使用抗Flag抗体进行Co-IP检测MARCH8与HK2的相互作用。
(N)将MARCH8 cDNA质粒转染至PDIA3P1-OE细胞,并通过Western blot检测HK2表达。数据为三次重复实验的平均值±标准差。ns:无显著性差异;***P<0.001。
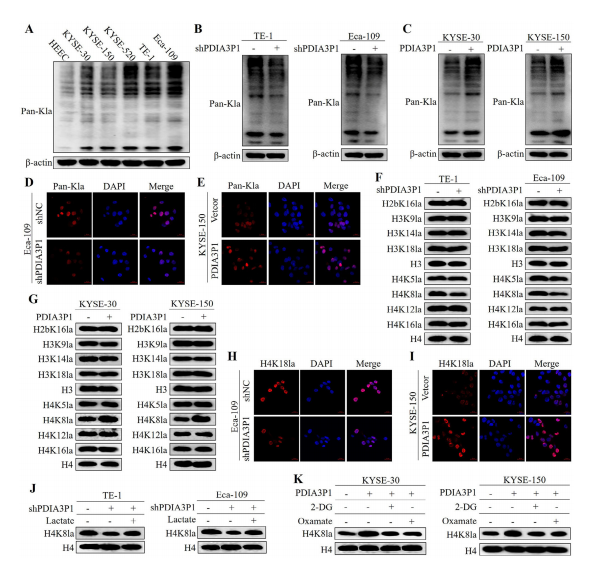
图6:PDIA3P1通过促进糖酵解途径上调H4K8la水平
(A) 蛋白质印迹显示正常细胞系HEEC与五种食管鳞癌细胞系(KYSE-30、KYSE-150、KYSE-520、TE-1和Eca-109)中Pan Kla的表达水平。
(B、C) 蛋白质印迹分析显示PDIA3P1稳定沉默后TE-1和Eca-109细胞(B)以及PDIA3P1稳定过表达后KYSE-30和KYSE-150细胞(C)中Pan Kla的表达变化。
(C、E) 免疫荧光染色代表性图像显示PDIA3P1敲低(Eca-109,D)或PDIA3P1过表达(KYSE-150,E)对Pan Kla表达的影响。
(F、G) PDIA3P1敲低(F)或PDIA3P1过表达(G)细胞中组蛋白特异性乳酸化位点的蛋白质印迹分析。
(G、I) 免疫荧光染色代表性图像显示PDIA3P1敲低(Eca-109,H)或PDIA3P1过表达(KYSE-150,I)对H4K8la表达的影响。
(J) PDIA3P1敲低细胞经乳酸处理24小时后,通过蛋白质印迹检测H4K8乳酸化水平。
(K) PDIA3P1过表达细胞在2-DG或草酰乙酸培养基中培养24小时后,通过蛋白质印迹检测H4K18la水平。
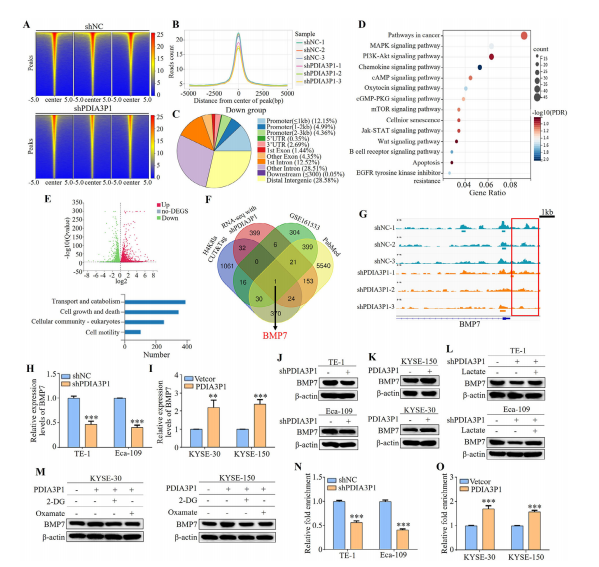
图7:BMP7是ESC细胞中H4K8乳酸化作用的靶标
(A) 通过deepTools可视化H4K8la结合密度:热图展示了shNC和shPDIA3P1细胞中不同H4K8la富集峰的CUT&Tag标签计数。
(B) H4K8la位点相对于翻译起始位点(TSS)的分布情况。
(C) shPDIA3P细胞中下调的H4K8la结合峰全基因组分布。
(D) 候选靶基因中H4K8la结合峰减少的KEGG分析。
(E) 对照组和shPDIA3P1细胞的转录组测序结果。
(F) 通过Venn图整合CUT&Tag、RNAseq、GEO和pubmed数据库,识别H4K8la潜在下游靶标。G)整合基因组浏览器追踪显示BMP7启动子区域H4K8la富集的CUT&Tag轨迹,红色矩形框标注靶基因启动子上的H4K8la峰区。
(H-K) PDIA3P1-KD细胞(H、J)和PDIA3P1-OE细胞(I、K)中BMP7 mRNA及蛋白水平检测。L)PDIA3P1-KD细胞在乳酸培养24小时后BMP7表达的Western blot分析。M)PDIA3P1-OE细胞在2-DG或草酰乙酸培养24小时后BMP7表达的Western blot分析。
(N、O) 使用H4K8la抗体进行CUT&Tag-qPCR分析,检测PDIA3P1-KD细胞(N)和PDIA3P1-OE细胞(O)BMP7启动子结合状态。数据为三次重复实验的平均值±标准差。**P<0.01;***P<0.001。
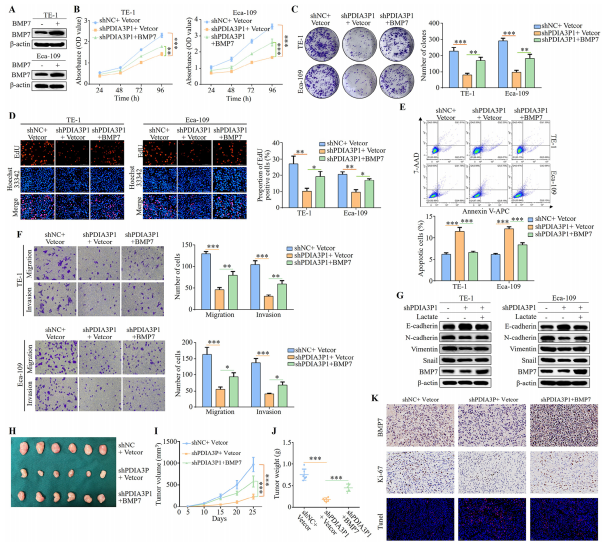
图8:PDIA3P1通过BMP7在体外和体内促进食管鳞状细胞癌的肿瘤发生
(A) Western blot检测BMP7表达水平,反映慢病毒转染BMP7的效果。
(C-G) 使用慢病毒构建TE-1和Eca-109细胞系中BMP7稳定过表达,同时稳定敲低PDIA3P1。B)通过CCK8法检测细胞增殖能力。
(B) 采用集落形成实验评估TE-1和Eca-109细胞的肿瘤生长情况。
(C) 使用EdU法检测食管鳞状细胞癌细胞的增殖能力。EdU标尺:100 μm。
(D) 流式细胞术显示Annexin V-APC和7-AAD染色的细胞凋亡情况。
(E) 通过transwell实验评估迁移和侵袭能力。transwell标尺:10 μm。G) Western blot显示E-Cadherin、N-Cadherin、波形蛋白、Snail和BMP7的表达水平。
(H-K) 将转染对照组、shPDIA3P1或shPDIA3P1与BMP7的Eca-109细胞皮下注射建立裸鼠肿瘤模型(n = 6)。H)各组肿瘤大小的照片及对比。
(I) 每5天测量并记录皮下肿瘤参数,根据以下公式计算肿瘤体积:肿瘤体积= 0.5×长度×宽度×宽度(mm³)。
(J) 各组肿瘤重量。
(K) 裸鼠肿瘤组织代表性免疫组化显示Ki-67和BMP7表达。标尺:20 μm。TUNEL免疫荧光染色显示皮下肿瘤组织切片。标尺:50 μm。这些数据代表三次重复实验的平均值±标准差。*P<0.05;**P<0.01;***P<0.001。
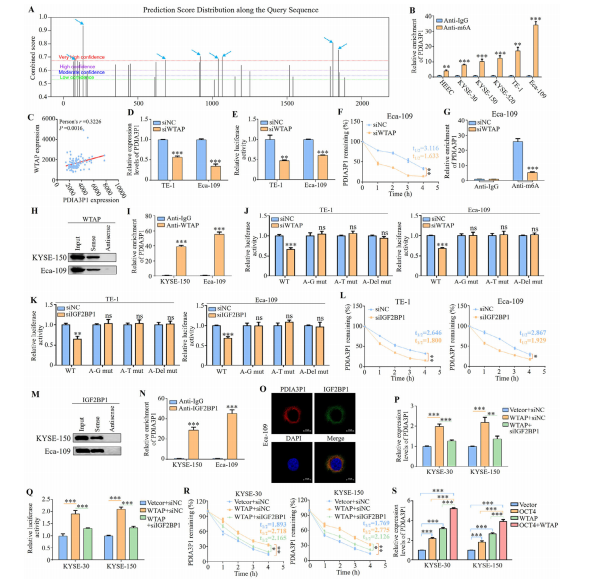
图9:IGF2BP1通过识别WTAP介导的m6A修饰增强PDIA3P1稳定性
(A) SRAMP预测的PDIA3P1特异性m6A峰富集分布。
(B) 正常细胞系HEEC与五种食管鳞癌细胞系(KYSE-30、KYSE-150、KYSE-520、TE-1和Eca-109)中PDIA3P1的m6A修饰水平MeRIP-qPCR分析。
(C) WTAP与PDIA3P1表达呈正相关的相关性分析。
(D) TE-1和Eca-109细胞中WTAP敲低后PDIA3P1表达的qRT-PCR分析。
(E) TE-1和Eca-109细胞共转染pmirGLO-PDIA3P1荧光素酶报告载体与WTAP siRNA后的相对荧光素酶活性。
(F) 经放线菌素D(10 μg mL−1)处理不同时间点的WTAP沉默细胞,通过qRT-PCR检测PDIA3P1水平。
(G) 通过MeRIP-qPCR检测WTAP沉默细胞中PDIA3P1的m6A修饰水平。
(G) PDIA3P1的下拉实验结合Western blot验证其与WTAP的相互作用。
(H) 使用WTAP抗体在KYSE-150和Eca-109细胞中进行RIP实验。
(I) 在TE-1和Eca-109细胞中转染WTAP siRNA后,野生型及其突变体pmirGLO-PDIA3P1报告载体的相对荧光素酶活性(WT:野生型;A-G突变:腺嘌呤残基被鸟嘌呤取代;A-T突变:腺嘌呤残基被胸腺嘧啶取代;A-Del突变:腺嘌呤残基缺失)。
(K) 在食管鳞癌细胞中进行IGF2BP1沉默时,野生型及其突变体pmirGLO-PDIA3P1报告载体的相对荧光素酶活性。
(L) 通过qRT-PCR检测对照组和IGF2BP1沉默细胞中PDIA3P1的稳定性。
(M) 通过PDIA3P1下拉实验结合Western blot验证其与IGF2BP1的相互作用。
(N) 使用IGF2BP1抗体进行RIP实验。
(O) FISH与IF双染色显示PDIA3P1与IGF2BP1在细胞质中的共定位。
(P) 在共转染WTAP过表达载体和IGF2BP1 siRNA的KYSE-30和KYSE-150细胞中,通过qRT-PCR分析PDIA3P1表达水平。
(Q) 共转染WTAP过表达载体和IGF2BP1 siRNA的KYSE-30和KYSE-150细胞中相对荧光素酶活性检测。
(R) 在共转染WTAP过表达载体和IGF2BP2 siRNA的食管鳞癌细胞中,通过qRT-PCR检测PDIA3P1稳定性。
(S) 分别转染OCT4 cDNA或WTAP cDNA后,通过qRT-PCR检测PDIA3P1表达水平。数据为三次重复实验的平均值±标准差。ns:无显著差异;*P<0.05;**P<0.01;***P<0.001。
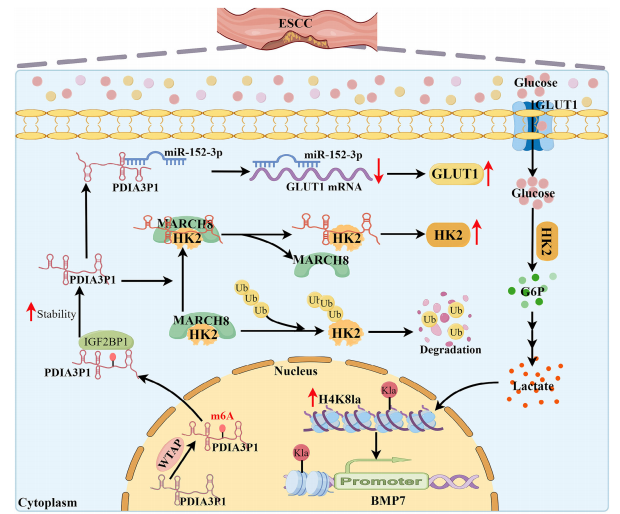
图10:研究示意图
PDIA3P1促进糖酵解:敲低PDIA3P1抑制GLUT1/HK2表达,降低乳酸生成;过表达则相反。
H4K8la激活BMP7转录:PDIA3P1通过增加H4K8la修饰富集于BMP7启动子区,促进其表达。
m6A修饰调控PDIA3P1稳定性:WTAP介导PDIA3P1的m6A修饰,IGF2BP1识别后延长其半衰期。
体内外功能验证:BMP7过表达可逆转PDIA3P1敲低对肿瘤生长的抑制。
科学意义:
揭示了lncRNA、代谢重编程、组蛋白修饰和RNA修饰的交叉调控网络。
提出PDIA3P1作为ESCC治疗的潜在靶点。
转化价值:
为靶向糖酵解或乳酸化修饰的抗肿瘤策略提供理论依据。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:HBV 如何加剧肝纤维化和肝癌?研究揭示 JNK 介导的自噬是关键
下一篇:mRNA 技术新突破:转染牛细胞表达抗毛滴虫抗体,为牛病防治开辟新路径 图片