常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-08-06 17:27:01 细胞资源库平台 访问量:510
卵巢癌是妇科恶性肿瘤中致死率最高的疾病,约70%的患者在确诊时已处于晚期。尽管铂类化疗药物通常具有较高的初始治疗效果,但约70-80%的患者会出现疾病复发,表明存在高耐药率问题。已确立的耐药机制包括损伤识别机制缺失、HER-2/neu过表达、PI3K-Akt信号通路激活、P53功能缺失、BCL-2过表达以及胱天蛋白酶激活干扰等。然而,卵巢肿瘤细胞的异质性和肿瘤微环境(TME)中复杂的细胞-细胞相互作用使得耐药机制的理解更加复杂。
癌症相关成纤维细胞(CAFs)作为TME的重要组成部分,已被广泛验证能够促进肿瘤发生、进展并促进治疗耐药性。因此,有必要开发能够高度模拟TME的体外模型来研究CAFs对耐药性的影响。迄今为止,大多数关于CAFs的研究都采用二维(2D)癌细胞系模型,但这些模型无法有效模拟肿瘤细胞与CAFs之间复杂的相互作用环境,且2D细胞培养无法维持肿瘤的异质性和表观遗传一致性。近年来,三维(3D)类器官培养技术的发展使得利用患者肿瘤组织构建3D肿瘤类器官模型成为可能。这些模型在组织学特征、生物标志物表达和遗传特征方面与原始组织高度相似,为癌症生物学研究提供了更可靠的结果。
近期,山西医科大学第一医院赵烨团队发布在Experimental cell research期刊,题为Constructing a co-culture model of cancer-associated fibroblasts and ovarian cancer organoids and studying mechanisms of drug resistance的研究目的是提供一个可靠的研究平台,以促进卵巢癌的研究,并阐明癌症相关成纤维细胞(CAFs)在促进耐药性过程中涉及的潜在机制。
1,CAFs和卵巢癌类器官的成功建立
研究团队成功从高级别浆液性卵巢癌(HGSOC)患者组织中分离并培养了CAFs和类器官。通过塑料贴壁法富集CAFs,细胞呈现典型的拉长、纺锤状形态。免疫荧光染色显示大多数CAFs对α-平滑肌肌动蛋白(α-SMA)和成纤维细胞激活蛋白(FAP)呈阳性表达,证实了分离的细胞确实是处于激活状态的CAFs,且未被其他细胞类型污染。经过三周培养,卵巢癌类器官成功建立,早期类器官主要由单细胞或小细胞簇组成,成熟的类器官通常表现为直径约20-200μm的多细胞囊性结构。H&E染色和免疫组化染色显示类器官中卵巢癌相关标志物WT-1和PAX-8呈阳性表达,与原发肿瘤组织的表达趋势一致,表明构建的类器官在组织学和表型上与来源肿瘤相匹配。
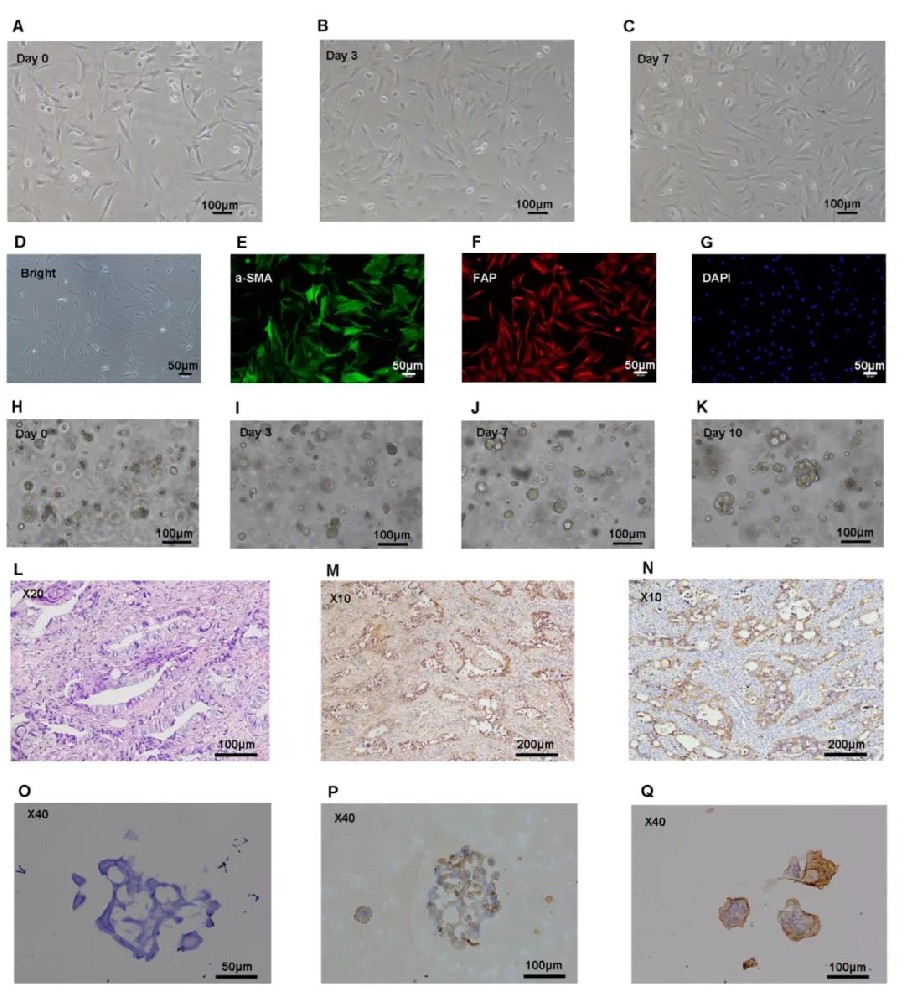
图1 人类卵巢癌相关成纤维细胞与类器官模型的建立
2,CAFs促进类器官生长的共培养模型建立
为研究癌细胞与CAFs之间的相互作用,研究团队构建了包含卵巢癌类器官和CAFs的3D共培养系统。随着培养时间的延长,CAFs进一步伸长,逐渐形成包围类器官的网状结构。部分类器官显示不规则轮廓,表明多个类器官(或细胞)之间发生了融合事件。经过10天的共培养,对消化的单个类器官细胞与CAFs进行计数和测量,观察到CAFs共培养导致形成的类器官尺寸增大,但对数量没有影响。具体而言,共培养组类器官的平均直径显著大于单独培养组,而两组间类器官数量无显著差异。这些结果表明CAFs可能不调节类器官起始的效率,而是促进共培养系统中已形成类器官的生长。
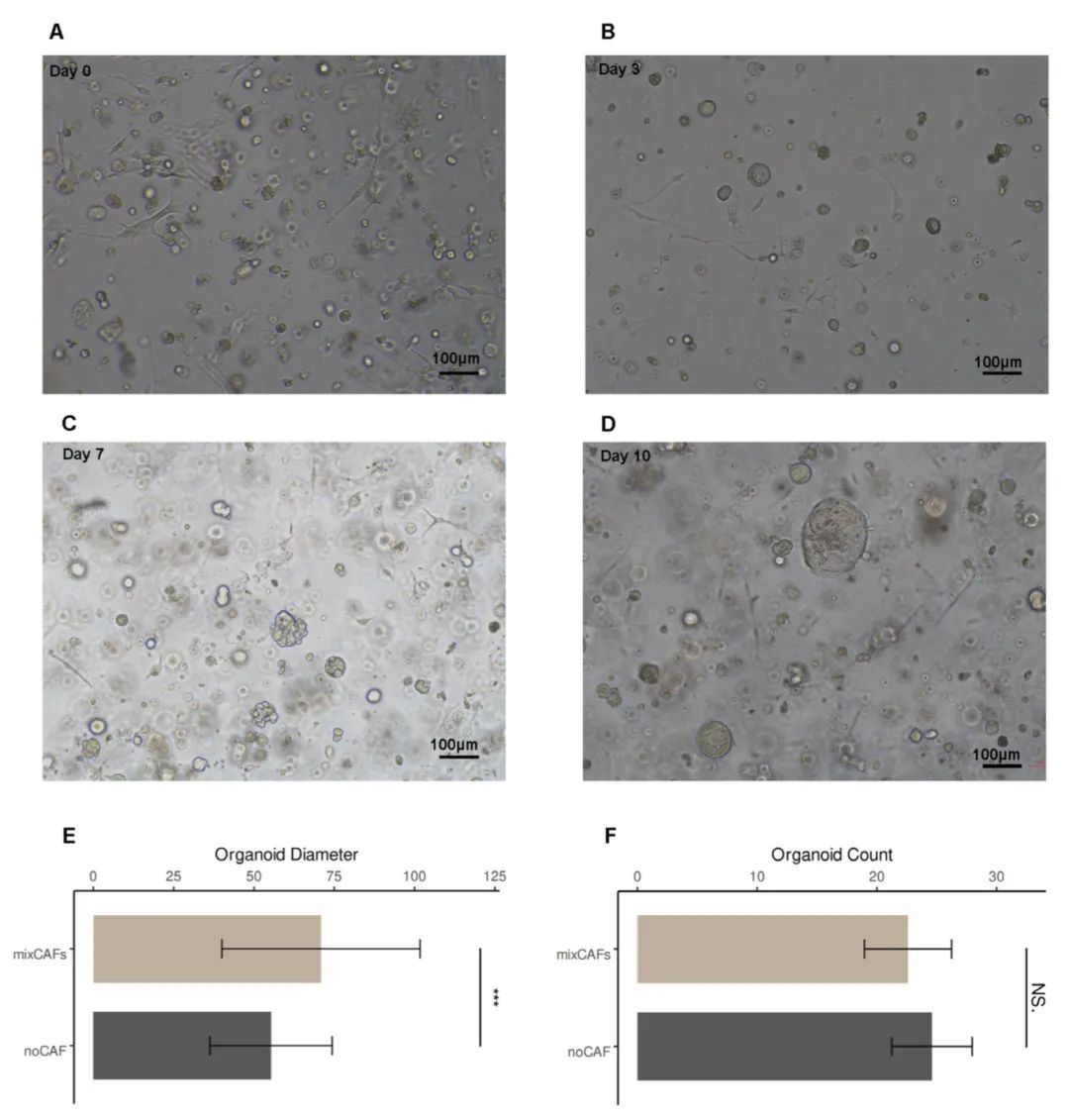
图2 建立类器官与癌症相关成纤维细胞的3D共培养模型
3,CAFs保护癌症类器官免受药物治疗影响
研究进一步检验了CAFs对癌症类器官响应抗癌药物(紫杉醇和顺铂)的影响。在存在或不存在CAFs的情况下,用紫杉醇和顺铂处理卵巢癌类器官。经72小时药物暴露后,共培养系统中的类器官对两种药物均表现出显著增强的耐药性。值得注意的是,与共培养组相比,仅类器官组的药物反应曲线下面积(AUC)明显较小。仅类器官组中紫杉醇和顺铂的IC50值分别为7.151e-006和2.340e-005,而与CAFs共培养后,IC50值分别增加到2.556e-005和4.500e-005,表明药物敏感性降低,与CAFs共培养后出现了显著的耐药性。这一发现证实了CAFs在肿瘤耐药性发展中的重要作用。
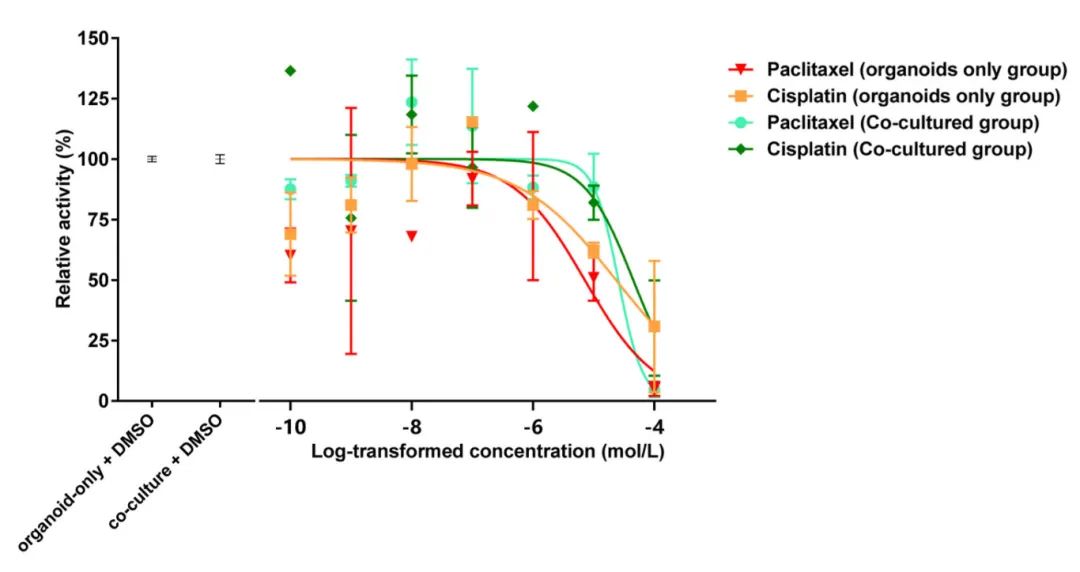
图3 分析类器官药物治疗及其与癌症相关成纤维细胞(CAFs)共培养的曲线下面积(AUC)
4,多重信号通路参与CAFs促进耐药性的机制
为阐明CAFs诱导类器官耐药性的机制,研究团队对CAFs共培养类器官和单独培养类器官进行了转录组分析。结果显示,在检测到的14,681个基因中,有674个差异表达基因(DEGs),其中581个基因在共培养组中上调,93个基因下调。GO富集分析显示DEGs主要定位于基底膜和细胞外基质(ECM)。KEGG通路分析表明PI3K-Akt信号通路、粘着斑、细胞因子-细胞因子受体相互作用、癌症中的蛋白聚糖和ECM-受体相互作用等通路在CAFs共培养组中显著富集。在细胞过程类别中,与单独培养类器官相比,CAFs共培养组中的DEGs在粘着斑和肌动蛋白细胞骨架调节通路中表现出最大的富集。在环境信息处理类别中,PI3K-Akt信号通路最显著富集,占DEGs的12.29%(37/462),其次是细胞因子-细胞因子受体相互作用和MAPK信号通路,分别富集7.97%和5.98%。通过基因集富集分析(GSEA)进一步验证,PI3K-Akt信号通路和细胞因子-细胞因子受体相互作用相关基因在共培养组中上调并发挥重要作用。Western blot验证了四个代表性基因(CXCL12、IGF1、ITGA4和PDGFRB)的蛋白表达水平,结果与RNA-seq分析一致。
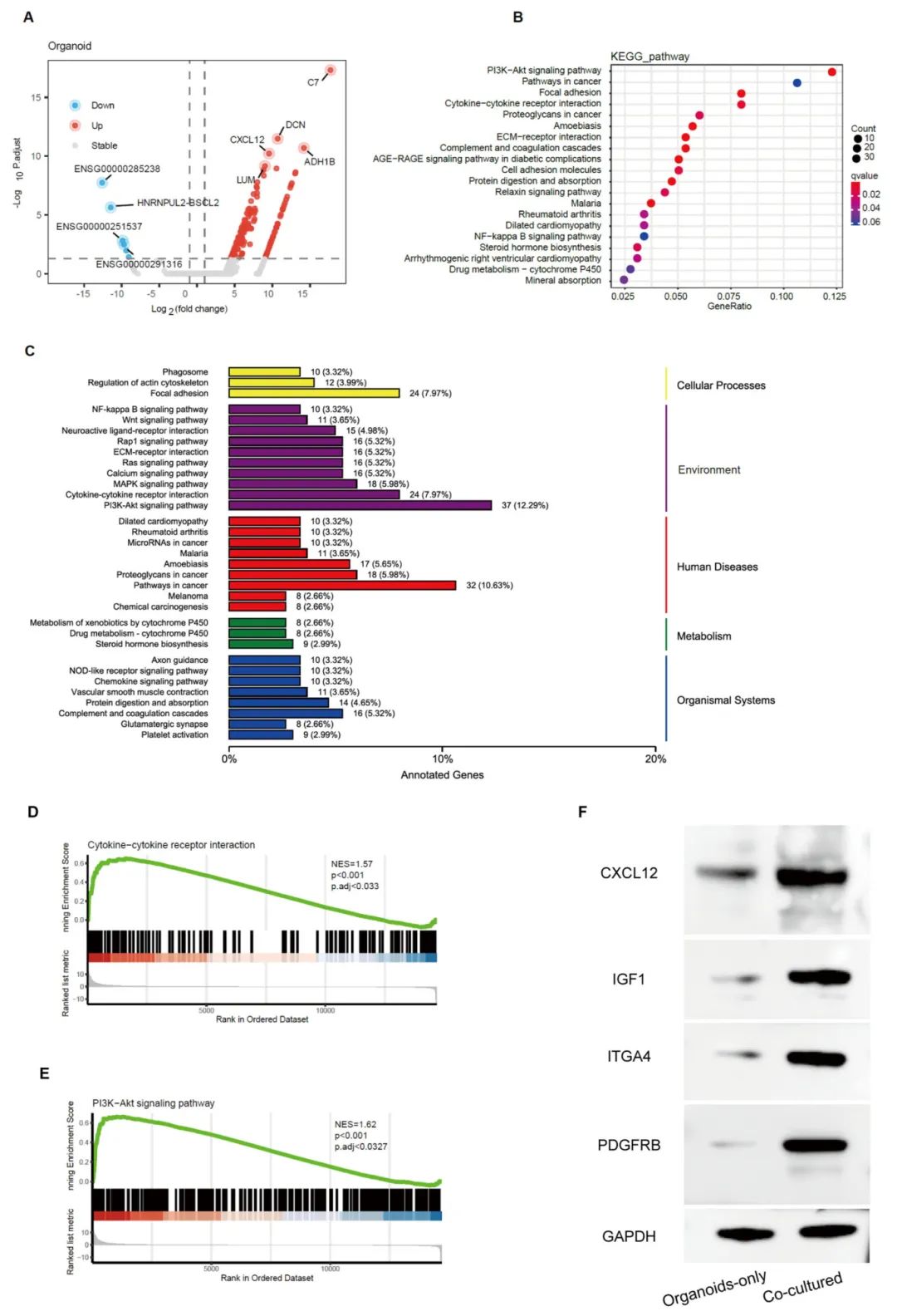
图4 类器官单独培养与癌症相关成纤维细胞共培养类器官的RNA测序分析
5,高表达卵巢癌相关成纤维细胞特征与临床预后不良相关
研究利用共培养类器官中上调的CAF相关基因构建了卵巢癌来源CAF(OV.CAF)特征,该特征代表卵巢癌中CAF相关基因的表达并验证其潜在的临床影响。通过分析三个公共基因表达谱数据集计算OV.CAF特征的ssGSEA评分,以0.75为阈值。结果显示,在所有三个独立数据集中,OV.CAF特征表达升高的患者均表现出不良预后。进一步分析TCGA-OV队列中OV.CAF特征高表达组和低表达组之间的DEGs,观察到PI3K-Akt信号通路、ECM重塑和细胞因子-细胞因子受体相互作用相关基因在OV.CAF特征高表达组中均呈上调趋势。这些发现表明OV.CAF特征可能代表卵巢癌中的CAF浸润,并可作为预后生物标志物。
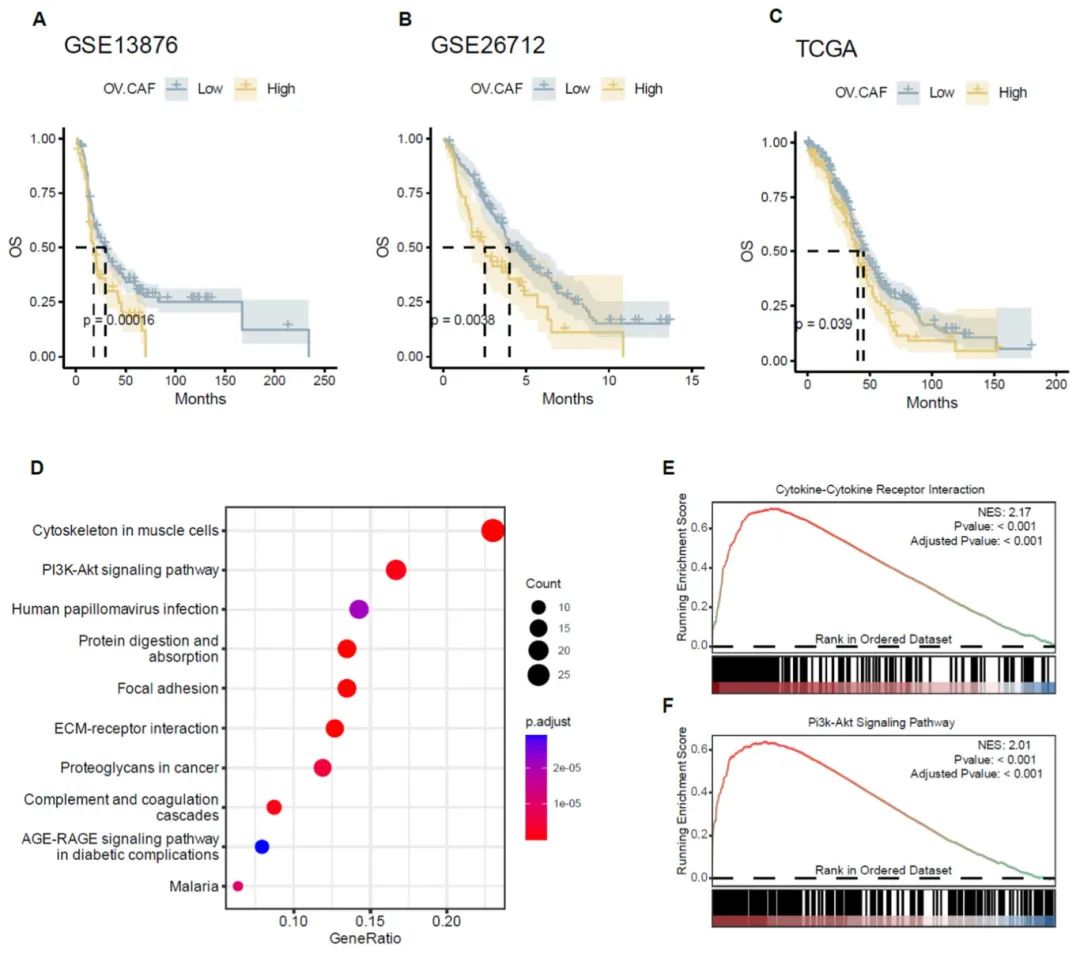
图5 卵巢癌相关成纤维细胞(OV.CAF特征)基因表达特征与三个公共临床数据集中患者预后的关联性
本研究成功构建了包含CAFs的卵巢癌类器官培养模型,复制了肿瘤细胞与CAFs之间的相互作用。研究发现CAFs可能通过涉及PI3K-Akt信号级联、细胞因子-细胞因子受体相互作用和ECM-受体相互作用的多重通路促进类器官生长和耐药性的发生。这为肿瘤研究提供了TME相互作用的临床前模型,特别是在靶向治疗和免疫治疗的背景下,为指导治疗决策提供了重要参考。该模型不仅为阐明卵巢癌耐药机制提供了可靠的研究平台,也为开发针对性治疗策略奠定了基础。研究结果强调了靶向PI3K-Akt信号通路的治疗潜力,特别是通过抑制CAFs与肿瘤细胞之间关键配体和受体的串扰来破坏这种相互作用。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:人诱导多能干细胞衍生肠上皮细胞模型:解析 PFAS 肠道转运的新型工具
下一篇:三阴性乳腺癌患者来源类器官和异种移植模型中WEE1抑制剂的抗癌药物敏感性测试和临床前评估