常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-08-06 09:15:00 细胞资源库平台 访问量:231
全氟烷基物质(PFAS)作为一类持久性有机污染物,其通过饮食等途径进入人体的机制一直是毒理学研究的关键问题。传统 Caco-2 细胞模型因缺乏真实肠道的多细胞组成,难以准确模拟 PFAS 的肠道转运过程。近期发表于《Archives of Toxicology》的研究首次构建了人诱导多能干细胞(hiPSC)衍生的肠上皮细胞(IEC)模型,系统比较了该模型与 Caco-2 细胞及原代 IEC 模型的 PFAS 转运特性,为化学品肠道吸收机制研究和风险评估提供了更具生理相关性的新型工具。
本研究利用 hiPSC 衍生的 IEC 模型,评估了 5 种 PFAS(PFOS、PFOA、PFNA、PFHxS、HFPO-DA)的肠道转运特性,并与 Caco-2 细胞和原代 IEC 模型(EpiIntestinal)对比。hiPSC-IEC 模型形成具有紧密连接和黏液层的极化单层,包含肠上皮细胞、干细胞、杯状细胞等多种类型,其肠道特异性基因表达水平显著高于其他模型。PFAS 在 hiPSC-IEC 模型中的顶侧到底侧表观渗透率(Papp)顺序为:PFHxS > PFOA > HFPO-DA > PFNA > PFOS,且转运模式与原代模型高度相似。该研究证实 hiPSC-IEC 模型可作为评估化学品肠道转运的理想体外模型。
全氟烷基物质(PFAS)作为一类广泛应用于工业和消费品的持久性有机化合物,可通过饮食等途径进入人体并引发肝毒性、免疫毒性等健康风险,但目前对其跨肠道屏障的转运机制知之甚少。传统 Caco-2 细胞模型因仅含肠上皮细胞、缺乏黏液层和多种肠道细胞类型,难以真实模拟体内转运过程;原代肠上皮细胞(IEC)模型虽生理相关性高,但存在来源有限、培养周期短等局限。人诱导多能干细胞(hiPSC)衍生的 IEC 模型可定向分化为包含肠上皮细胞、干细胞、杯状细胞等的极化单层,具备黏液分泌和紧密连接形成能力,为解析 PFAS 肠道转运提供了新型仿生模型。
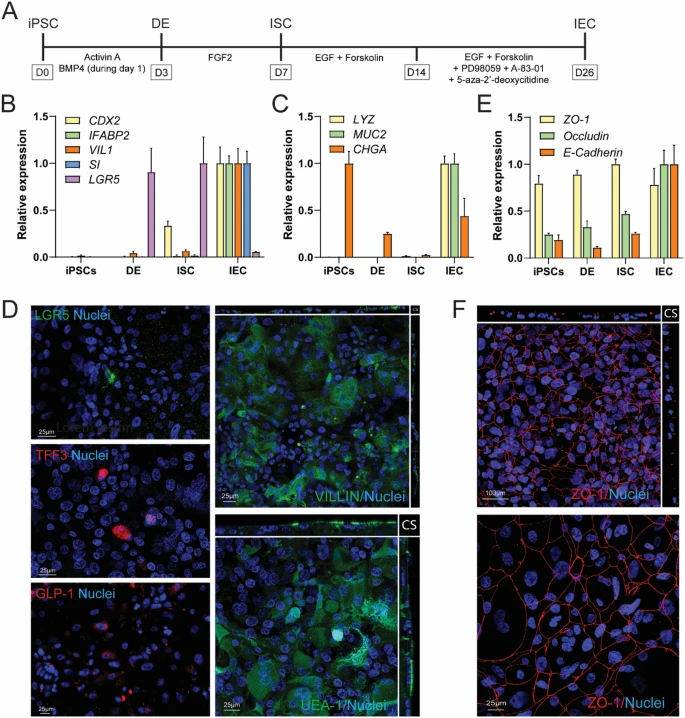
Figure 1:hiPSC 衍生肠上皮细胞层的分化与表征
hiPSC 经 Activin A 诱导形成定型内胚层,再通过 FGF2、EGF 等因子逐步分化为肠干细胞(ISC)和 IEC 层。免疫荧光显示 IEC 层表达肠上皮标志物 VILLIN、SI,干细胞标志物 LGR5,以及杯状细胞标志物 MUC2 和肠内分泌细胞标志物 CHGA。电镜观察证实其形成顶端微绒毛和紧密连接结构,TEER 值稳定维持在 360 Ω・cm²,Lucifer 黄转运实验显示屏障完整性良好。
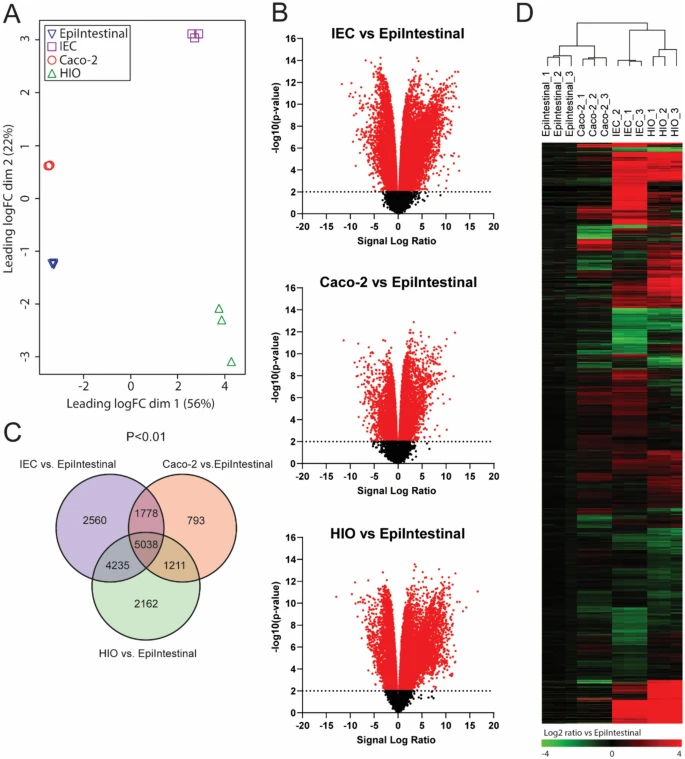
Figure 2:转录组分析揭示模型间基因表达差异
多维标度分析(MDS)显示 hiPSC-IEC 与原代 IEC 模型的基因表达差异大于 Caco-2,但 492 个肠道特异性基因中,hiPSC-IEC 模型的高表达基因数量(255 个)显著多于 Caco-2(136 个)和肠类器官(196 个)。基因集富集分析(GSEA)发现 hiPSC-IEC 模型中细胞黏附、细胞因子信号通路基因上调,DNA 复制相关基因下调,提示其更接近体内肠上皮功能状态。
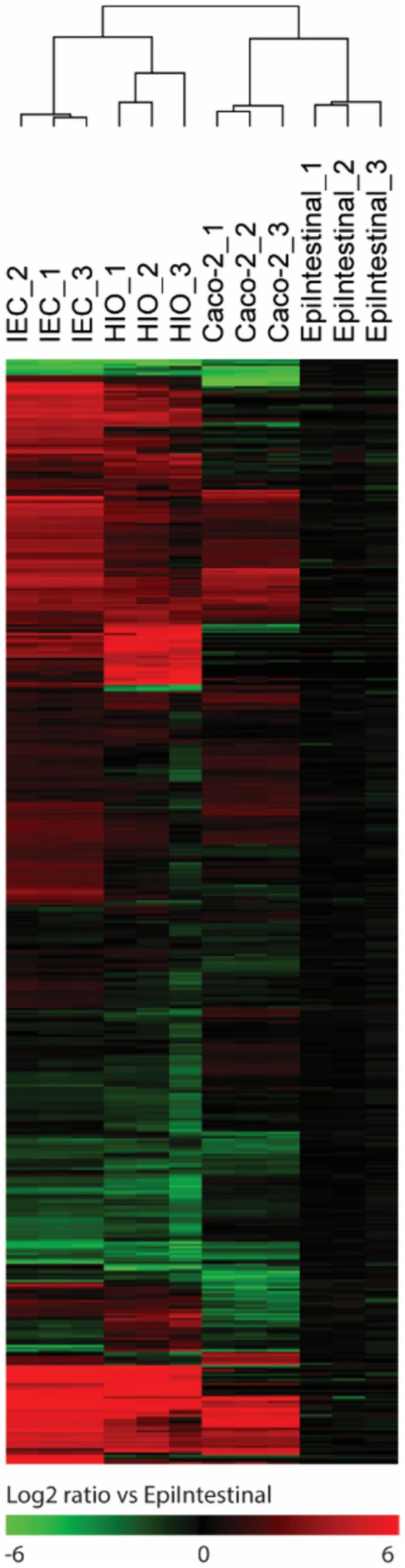
Figure 3:肠道转运蛋白基因表达特征
在 37 种关键转运蛋白中,hiPSC-IEC 模型高表达 SLC51B(胆汁酸转运蛋白)、SLC7A5(中性氨基酸转运蛋白),而 Caco-2 细胞高表达 SLC1A5(丙氨酸转运蛋白)。外排转运蛋白 ABCC4 在 hiPSC-IEC 中表达下调,可能解释其对 PFAS 的高通透性;OATP2B1 和 ASBT 等 PFAS 相关转运蛋白在 hiPSC-IEC 中均有表达,提示潜在的主动转运机制。
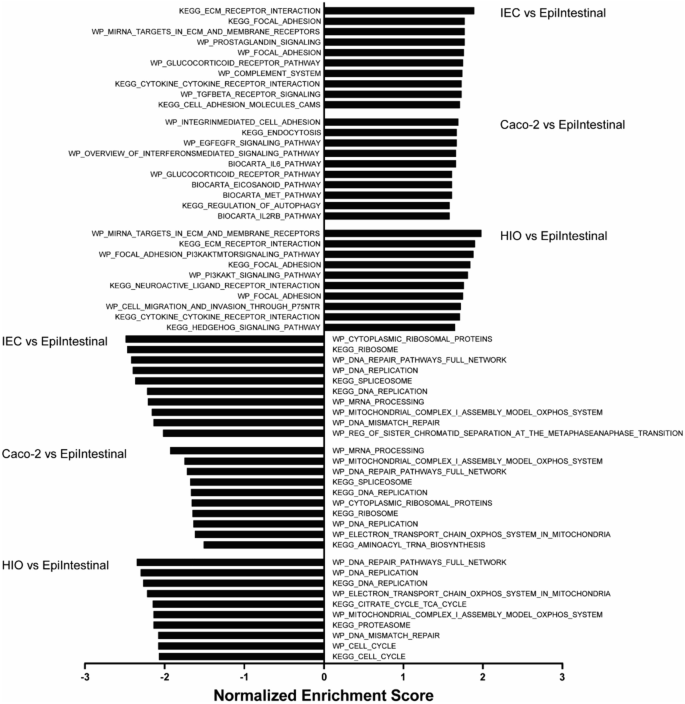
Figure 4:模型化合物转运验证
高渗透性药物华法林(Papp=15.96×10⁻⁶ cm/s)、普萘洛尔(26.71×10⁻⁶ cm/s)在 hiPSC-IEC 中的转运效率显著高于低渗透性药物阿替洛尔(2.12×10⁻⁶ cm/s)、依那普利(2.95×10⁻⁶ cm/s),与原代模型和 Caco-2 的趋势一致,但 hiPSC-IEC 对低渗透性化合物的转运能力更强,可能与黏液层组成差异有关。
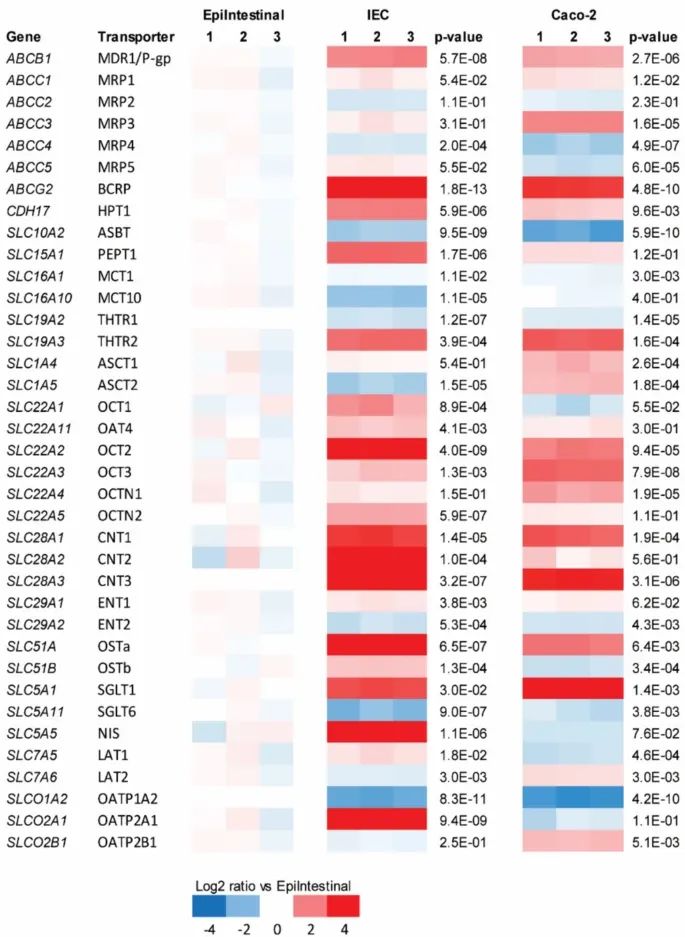
Figure 5:PFAS 在不同模型中的顶侧到底侧转运
hiPSC-IEC 模型中 PFAS 的 Papp 顺序为 PFHxS(3.95×10⁻⁶ cm/s)> PFOA(3.27×10⁻⁶ cm/s)> HFPO-DA(3.09×10⁻⁶ cm/s)> PFNA(1.95×10⁻⁶ cm/s)> PFOS(0.63×10⁻⁶ cm/s),与原代模型(PFHxS=12.48×10⁻⁶ cm/s)的转运顺序一致,但数值较低,可能与模型厚度和细胞组成有关。值得注意的是,HFPO-DA 仅在 hiPSC-IEC 中检测到显著转运,Caco-2 模型中未检出。
Figure 6:PFAS 转运的双向性分析
各 PFAS 的底侧到顶侧(B-A)与 A-B 转运比率均 < 2,提示被动扩散为主要转运机制。PFHxS 的外排比率(1.70)最高,PFOS 最低(1.31),与 A-B 转运效率呈正相关。模型间外排比率无显著差异,表明 PFAS 在肠道中的跨膜转运以被动扩散为主,主动外排贡献有限。
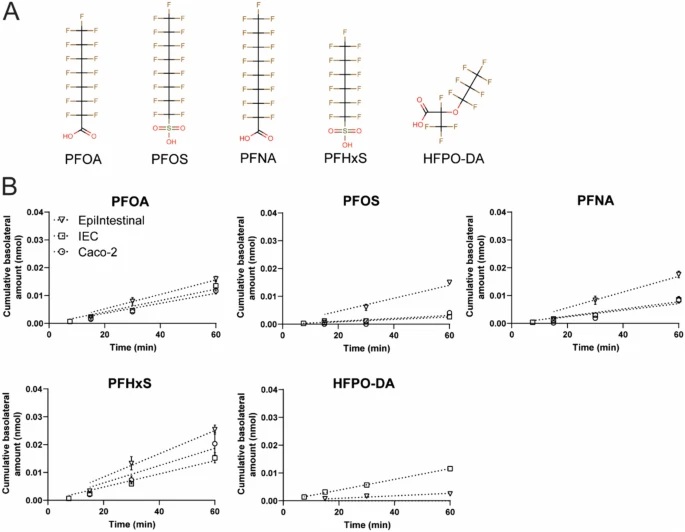
Figure 7:模型间 PFAS 转运效率的定量对比
原代 IEC 模型的 PFAS Papp 值普遍高于 hiPSC-IEC 和 Caco-2,其中 PFHxS 在原代模型中达 12.48×10⁻⁶ cm/s,是 hiPSC-IEC 的 3 倍。Caco-2 对 PFOS 的转运(2.88×10⁻⁶ cm/s)高于 hiPSC-IEC,可能与 Caco-2 细胞的高 TEER 值和转运蛋白表达差异有关。hiPSC-IEC 与原代模型的转运顺序一致性,证实其生理相关性。
本研究证实,hiPSC 衍生的 IEC 模型通过 26 天定向分化可形成具有紧密连接(ZO-1、Occludin)和黏液层的极化单层,其肠道特异性基因(如 CDX2、VIL1)表达水平显著高于 Caco-2 细胞和原代 IEC 模型,且包含肠上皮细胞、干细胞、杯状细胞等多种类型。5 种 PFAS 在该模型中的顶侧到底侧表观渗透率(Papp)顺序为 PFHxS > PFOA > HFPO-DA > PFNA > PFOS,与原代模型转运顺序一致,且对高 / 低渗透性化合物的区分能力与生物药剂学分类系统吻合。该模型为研究化学品跨肠道屏障转运及风险评估提供了更具生理相关性的体外工具。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:大麻二酚及其代谢物对睾丸 Leydig 细胞的毒性机制研究
下一篇:癌症相关成纤维细胞与卵巢癌类器官共培养模型构建及耐药机制