常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-08-07 12:33:44 细胞资源库平台 访问量:230
三阴性乳腺癌(TNBC)是一种缺乏雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2(HER2)扩增的侵袭性乳腺癌亚型,约占所有乳腺癌的10-15%。TNBC具有高度异质性,可分为六种分子亚型:基底样型(BL1和BL2)、间质型(M)、间质干细胞样型(MSL)、免疫调节型(IM)和管腔雄激素受体型(LAR)。由于缺乏明确的分子靶点,TNBC对常规化疗反应较差,治疗选择有限,预后不良。因此,迫切需要建立相关的临床前模型来筛选有效的抗癌药物并预测治疗反应。
患者来源肿瘤类器官(PDOs)和患者来源异种移植物(PDXs)因能够复制患者肿瘤的病理生理特征而被认为是基础研究和精准医学的重要模型。PDOs支持高通量筛选并表现出一致的药物反应,相较于PDX模型具有实验周期短、成本低等优势。然而,由于起始患者组织量有限,限制了广泛药理学方法的应用。PDX来源类器官(PDXOs)作为PDXs的病理生理等价物,已被证明可用于药物筛选和发现。
WEE1是G2/M期检查点的主要看门人,在调节细胞周期和修复DNA损伤方面起关键作用。WEE1水平升高与多种癌症的侵袭性相关,最近研究发现WEE1在TNBC患者中高表达,特别是在BL1亚型中。然而,在涉及转移性TNBC患者的II期临床试验中,WEE1抑制剂与顺铂联合治疗的客观缓解率为26%,未达到预设的30%截止值。该临床试验未考虑TNBC患者队列中的WEE1蛋白水平,因此本研究旨在通过PDO、PDXO和PDX模型评估WEE1抑制剂的治疗潜力。相关研究结果以题Anti-cancer drug sensitivity testing and preclinical evaluation of the anti-cancer potential of WEE1 inhibitor in triple-negative breast cancer patient-derived organoids and xenograft models发布在Breast cancer research期刊。
1,PDOs、PDXs和PDXOs的成功建立及特征保持
研究团队成功从5例TNBC患者的手术标本中建立了PDO细胞系(PDO#2、#3、#4、#5),其中PDO#1未能扩增成功。这些PDOs表现为不同大小的内聚性实心球体,在ER、PR和HER2状态方面与患者肿瘤完全匹配。通过将PDOs注射到NSG小鼠的乳腺脂肪垫中,成功建立了PDX#1、#2和#3模型,并通过连续移植维持了3-4代。所有PDX模型均出现肺转移,这与原发患者的转移模式一致。PDX肿瘤生长速度在各代间有所差异,P1-P4代相比P0代达到100mm³肿瘤体积所需时间更短,表明具有高增殖特征的肿瘤细胞在PDX肿瘤传代过程中被选择性富集。
从新鲜PDX肿瘤标本中成功建立了PDXO#1、#2和#3,可传代培养至5次。免疫组织化学结果显示,所有PDXs和PDXOs均保持了原始TNBC患者ER阴性、PR阴性和HER2阴性的状态。CK5和波形蛋白在PDX#1、#2和#3肿瘤组织中强表达,EGFR在PDX#1和#2中高表达但在PDX#3中不表达,这与患者组织的免疫组化结果一致。Western blot分析显示PDX#3肿瘤的WEE1表达水平明显高于其他PDX肿瘤,这一发现为后续的靶向治疗研究提供了重要基础。
2,WEE1高表达与TNBC基底样亚型患者预后不良相关
通过Kaplan-Meier生存分析数据库对158例TNBC基底样亚型患者进行分析发现,WEE1基因高表达与较短的总生存期显著相关(HR=2.17,95% CI 1.02-4.61,p=0.039),平均随访时间为120个月。这一发现证实了WEE1可作为预测TNBC基底样亚型患者预后不良和指导靶向治疗的潜在生物标志物。在患者队列中,患者#3诊断为TNBC基底样亚型并伴有远处转移,表现出高WEE1表达,这与数据库分析结果一致。免疫组织化学染色显示,WEE1主要定位于肿瘤细胞核内,在患者#3的肿瘤中表达水平最高,为WEE1靶向治疗提供了理论依据。
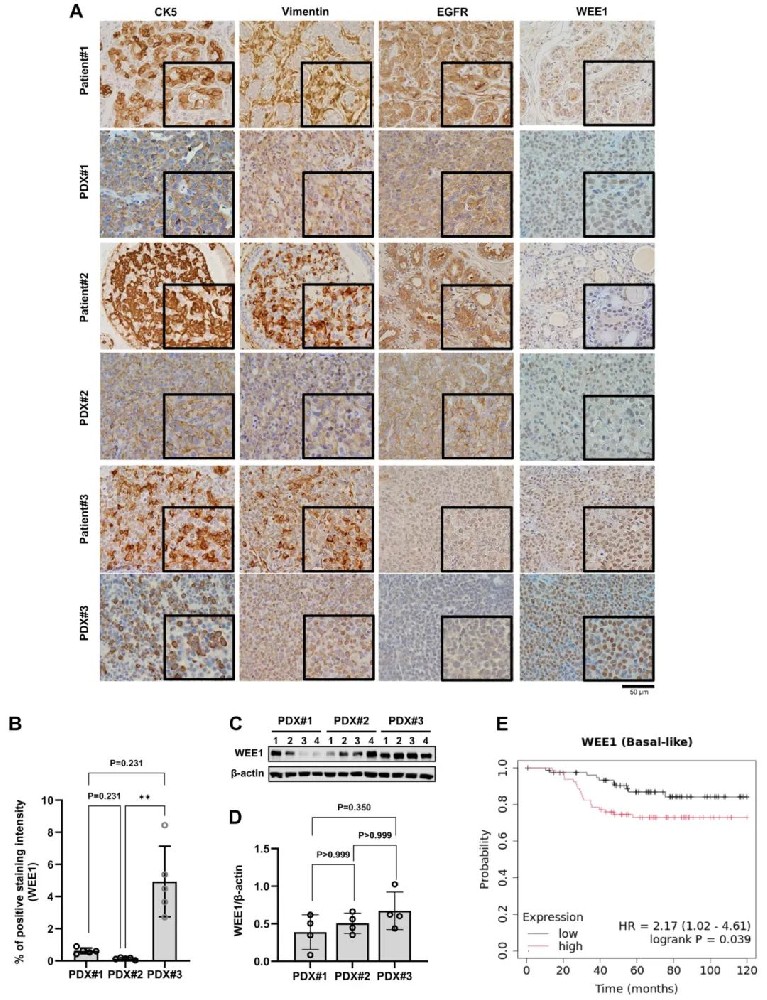
图1 高WEE1表达与基底样亚型三阴性乳腺癌患者的不良生存结局相关
3,AZD1775显著抑制PDX肿瘤生长并改变关键蛋白表达
在体内药效学研究中,30mg/kg的AZD1775经口给药显著抑制了PDX#1(p=0.01587)和PDX#3(p=0.00794)的肿瘤生长,但对PDX#2无显著影响(p=0.46340)。治疗组小鼠体重无明显变化,表明该剂量具有良好的耐受性。AZD1775治疗显著降低了PDX#1和PDX#3中磷酸化CDK1(Tyr15)的水平,仅在PDX#3中观察到磷酸化WEE1水平显著降低和磷酸化γH2AX水平显著升高。免疫组织化学分析与Western blot结果一致,显示AZD1775治疗后PDX#1和#3中Ki67增殖标志物表达下降。这些结果表明,WEE1抑制剂通过干扰细胞周期检查点、诱导DNA损伤和抑制细胞增殖来发挥抗肿瘤作用,且在WEE1高表达的肿瘤中效果更为显著。
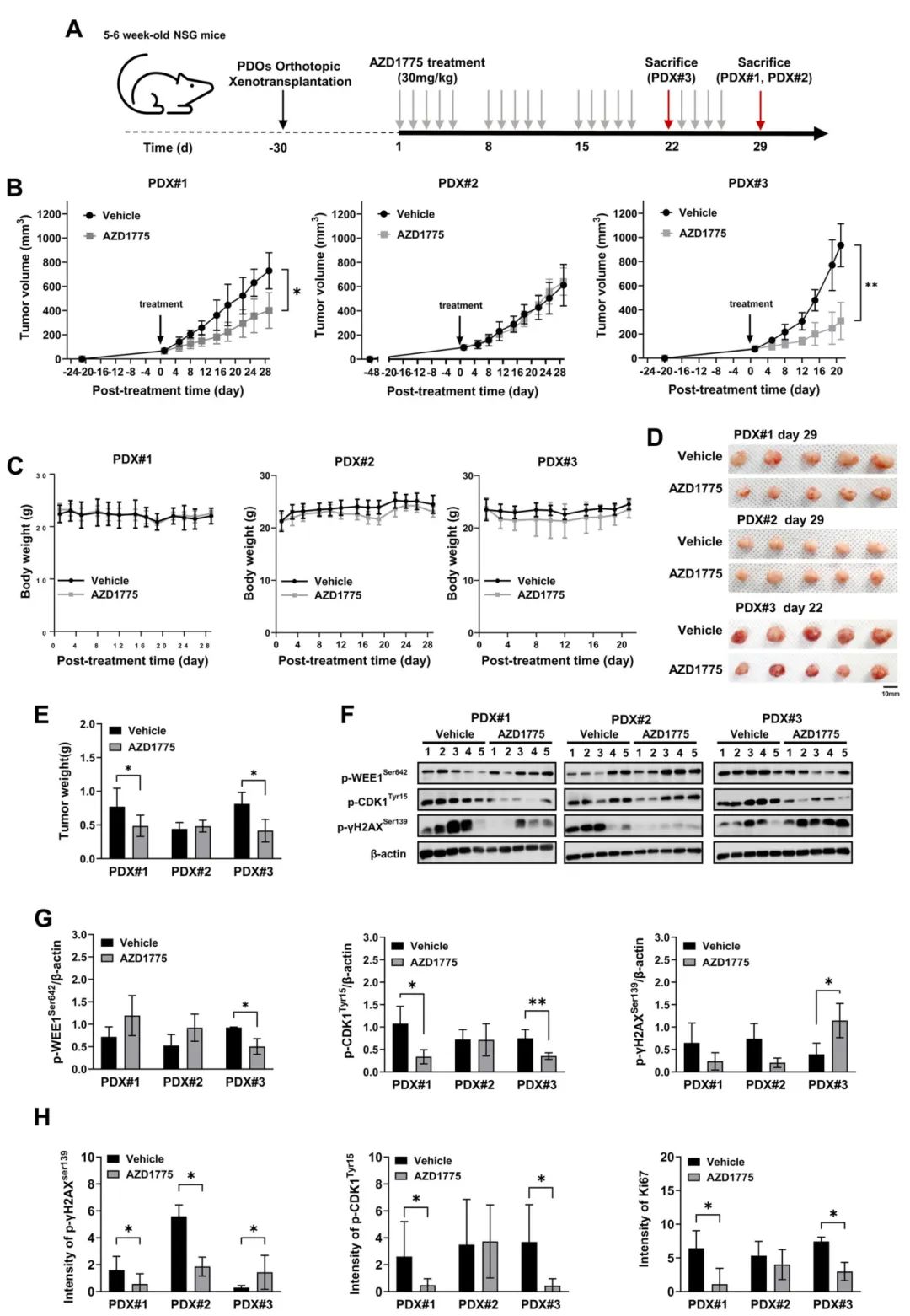
图2 口服AZD1775通过增加γH2AX磷酸化水平,同时降低CDK1磷酸化及Ki67表达,从而抑制PDX小鼠的肿瘤生长
4,AZD1775诱导G2/M期阻滞和DNA损伤导致细胞死亡
在PDXOs的细胞周期分析中,AZD1775处理显著增加了G2/M期细胞比例,并以剂量依赖性方式减少了G0/G1期细胞比例。流式细胞术分析显示,AZD1775处理后出现显著的剂量依赖性DNA含量>4N的非整倍体细胞增加,特别是在PDXO#3中最为明显。双重染色实验显示,磷酸化γH2AX阳性且具有非整倍体(>4N DNA含量)的细胞比例在PDXO#1和#3中明显高于PDXO#2,表明AZD1775导致了严重的DNA损伤和非整倍体形成。在药物敏感性测试中,PDXO#3对AZD1775的敏感性最高(IC50=1.40μM),其次是PDXO#1(IC50=2.17μM)和PDXO#2(IC50=4.97μM)。Caspase 3/7染色显示所有PDXOs在IC50浓度的AZD1775处理下凋亡细胞显著增加,Calcein-AM活力染色进一步证实了PDXO#3对AZD1775的高度敏感性。
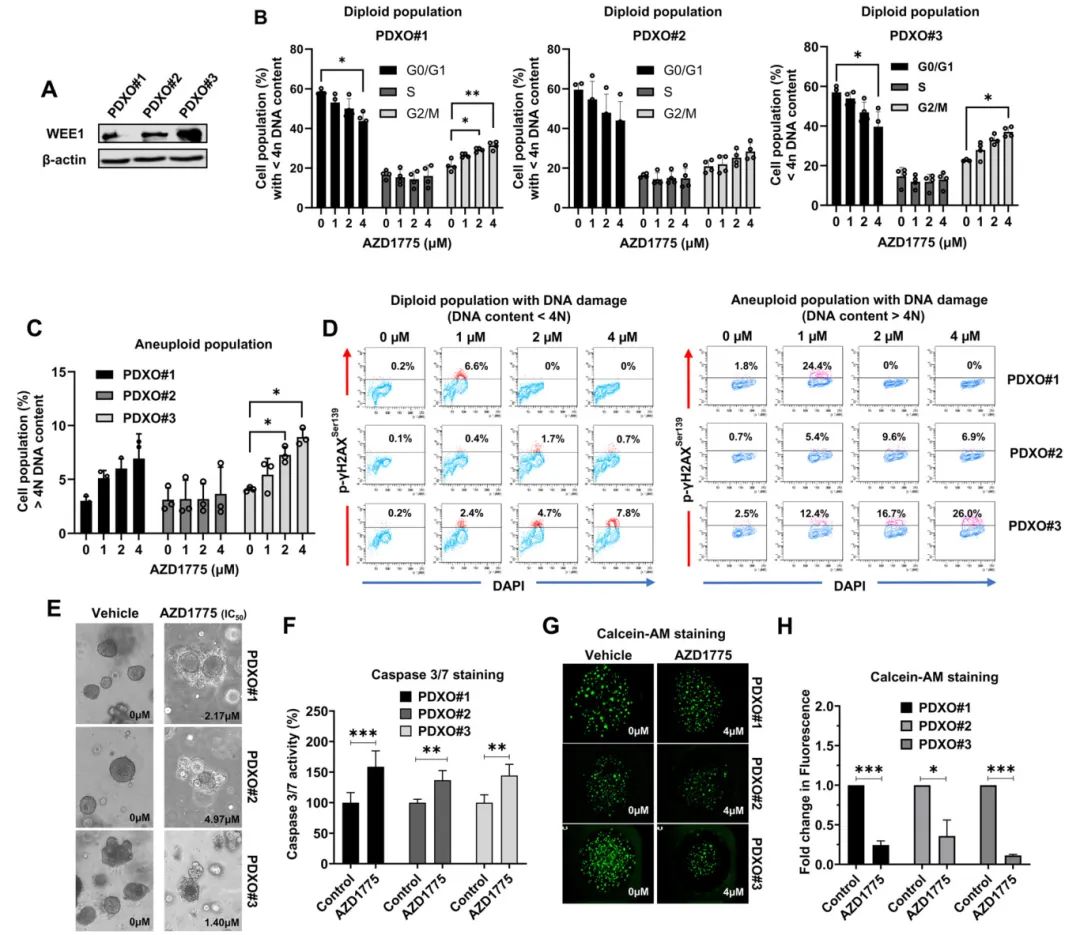
图3 AZD1775导致异常的G2/M期阻滞,并增加了p-γH2AX阳性非整倍体细胞群,从而在PDXO模型中引发非整倍性、DNA损伤和细胞死亡
5,PDOs和PDXOs抗癌药物反应的高度一致性
为评估PDOs和PDXOs之间药物反应的一致性,研究团队使用高通量筛选系统对18种抗癌药物进行了3D细胞活力评估。通过Lin一致性相关系数(CCC)分析发现,PDO#3和PDXO#3在四种抗癌药物(AZD1775、多柔比星、依维莫司、奎西司他)的反应中表现出实质性相关性(CCC=0.97-0.98)。中等相关性药物包括艾日布林、帕博西尼、多西他赛和紫杉醇(CCC=0.91-0.94)。相比之下,吉西他滨、AZD6738、拉帕替尼等药物显示出较弱的相关性。这种高度一致性表明PDXOs可以作为PDOs的有效替代模型用于药物筛选,特别是在患者组织量有限的情况下,为个体化治疗药物选择提供了可靠的体外评估平台。
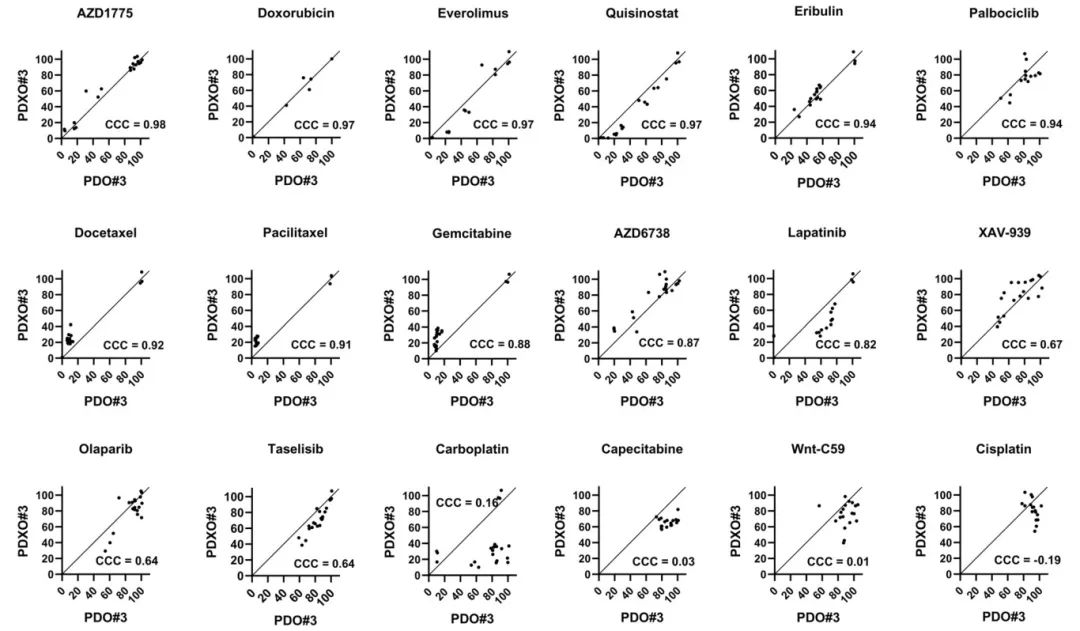
图4 PDO和PDXO对抗癌药物的反应具有高度一致性
6,模型药物反应与患者临床治疗反应的对比验证
研究团队将PDOs和PDXOs的药物反应与患者接受新辅助或辅助化疗的临床记录进行了对比分析。患者#1接受周紫杉醇新辅助化疗后肿瘤进展,PDXO#1在200μM紫杉醇处理下无反应,与患者临床反应一致。患者#2接受多西他赛+环磷酰胺治疗后无复发,PDXO#2对多西他赛在4.2μM浓度下显示50%细胞毒性反应。患者#3接受多西他赛+阿霉素以及吉西他滨+紫杉醇姑息治疗后肿瘤缩小,PDO#3和PDXO#3对相应药物均显示敏感性。患者#4的肿瘤对新辅助化疗部分反应,PDO#4对紫杉醇显示敏感性。这些对比分析结果支持PDOs和PDXOs作为预测抗癌药物反应性和选择敏感药物的替代模型的有效性,为TNBC患者的个体化治疗提供了重要的临床前评估工具。
本研究成功建立了保持TNBC患者肿瘤免疫组织学特征的PDOs、PDXOs和PDXs模型,证明了WEE1靶向治疗在TNBC基底样亚型患者中的治疗潜力。研究发现WEE1高表达与TNBC基底样亚型患者预后不良显著相关,为WEE1作为预后生物标志物和治疗靶点提供了科学依据。AZD1775在WEE1高表达的PDXs和PDXOs中显示出显著的抗肿瘤活性,通过抑制CDK1磷酸化、诱导G2/M期阻滞、激活DNA损伤反应和促进细胞凋亡发挥作用。
研究建立的高通量药物筛选体系揭示了PDOs和PDXOs在抗癌药物反应方面的高度一致性,证明了这些模型作为成本效益高、时间节约的个体化治疗筛选平台的价值。模型药物反应与患者临床治疗反应的良好对应性进一步验证了其临床转化应用的潜力。本研究为未来TNBC患者WEE1靶向临床试验提供了科学依据,并为建立个体化精准医疗策略奠定了重要基础。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:癌症相关成纤维细胞与卵巢癌类器官共培养模型构建及耐药机制