常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-08-05 17:37:18 细胞资源库平台 访问量:159
关节软骨损伤在临床实践中极为常见,主要由外伤、炎症、遗传或退变等因素引起。由于关节软骨缺乏血管、神经和淋巴管,细胞密度低且细胞迁移能力有限,其天然自我再生能力极其有限。目前临床常用的手术治疗方法包括微骨折手术、自体软骨移植和自体软骨细胞植入术,但这些治疗方法都存在固有的局限性。
近年来,再生医学的进步催生了软骨类器官(CORGs)这一有前景的软骨修复新策略。软骨类器官是三维体外细胞培养物,由一种或多种细胞类型组成,能够增殖和分化以模拟软骨组织的生理环境和功能。构建软骨类器官需要模拟软骨细胞外基质(ECM)的支架,以支持软骨细胞增殖并维持其生理功能。
相比于合成材料,脱细胞细胞外基质(dECM)具有调节细胞生长、维持稳态、影响细胞特性和胚胎发育的生化和机械线索。ECM不仅能作为刺激体内组织修复的基质,还可作为组织和器官工程的支架。在软骨组织工程中,ECM因其良好的生物相容性、免疫相容性和为干细胞提供生态位的特性而发挥重要作用。研究表明,ECM衍生的生物材料能在组织再生和修复过程中激活巨噬细胞,诱导M2型巨噬细胞表面标志物的表达,并促进促愈合因子的分泌。
近期,中国人民解放军总医院汪爱媛/彭江联合西南医科大学附属医院阳运康发布在Journal of Orthopaedic Translation期刊,题为Construction of cartilaginous organoids based on cartilage extracellular matrix microcarriers to promote articular cartilage regeneration through immune regulation的研究探究了利用软骨细胞外基质微载体(CEMMs)构建软骨类器官(CORGs)的可行性,评估其异位软骨形成潜能,并分析其对SD大鼠膝关节软骨原位修复与再生的影响。
1,软骨细胞外基质微载体的成功制备与表征
研究成功制备了直径为210.4±56.89μm的软骨细胞外基质微载体(CEMMs)。光镜观察显示CEMMs周围存在大量绒毛状结构,扫描电镜显示表面具有交错胶原纤维网络。DAPI染色证实与天然软骨相比,dECM实现了完全脱细胞化,软骨陷窝中无明显细胞核。DNA定量分析显示dECM中DNA含量显著低于天然软骨,确认脱细胞化过程成功。番红O和甲苯胺蓝染色显示dECM组织中ECM染色强烈且均匀,表明脱细胞化后基质损失较少,大部分ECM成分得以保留。
2,CEMMs的生物学功能验证
生物相容性和细胞毒性检测显示,CEMMs具有良好的生物相容性,细胞存活率超过85%。CCK-8检测证实CEMMs提取液对人关节软骨细胞(hACs)和人脐带间充质干细胞(hUCMSCs)无细胞毒性。值得注意的是,培养5天后实验组的光密度值高于对照组,表明CEMMs能促进hUCMSCs的增殖。Ki67荧光染色进一步验证了CEMM提取液能促进干细胞增殖。划痕实验和Transwell实验评估了CEMMs的干细胞招募能力,结果显示CEMMs组的细胞迁移率明显高于对照组,证明CEMMs能促进干细胞迁移,可能有助于招募内源性间充质干细胞。
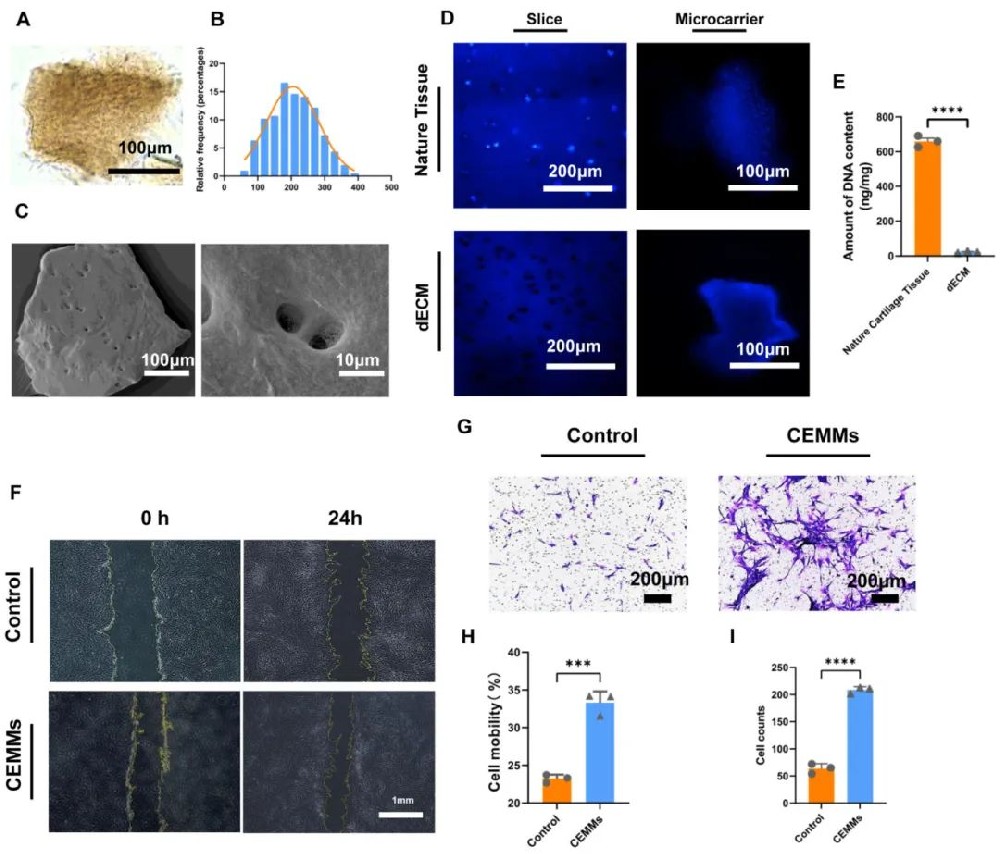
图1 软骨细胞外基质微载体(CEMMs)的表征与生物学特性
3,CEMMs对巨噬细胞极化的免疫调节作用
研究通过与不同条件培养基共培养大鼠骨髓来源巨噬细胞(BMDMs)72小时,发现CEMMs组的BMDMs呈长梭形,而IFN-γ+LPS和天然软骨组呈卵圆形。qRT-PCR分析显示,CEMMs组中M1表型相关基因CD86、iNOS和IL-1β的表达低于其他组,而M2表型相关基因Arg-1、CD206和CD163的表达更高。免疫荧光分析CD86/CD206和Arg-1/IL-1β蛋白表达提供了类似结果。这些发现表明CEMMs促进BMDMs向M2表型极化,可能通过调节免疫微环境促进组织再生。
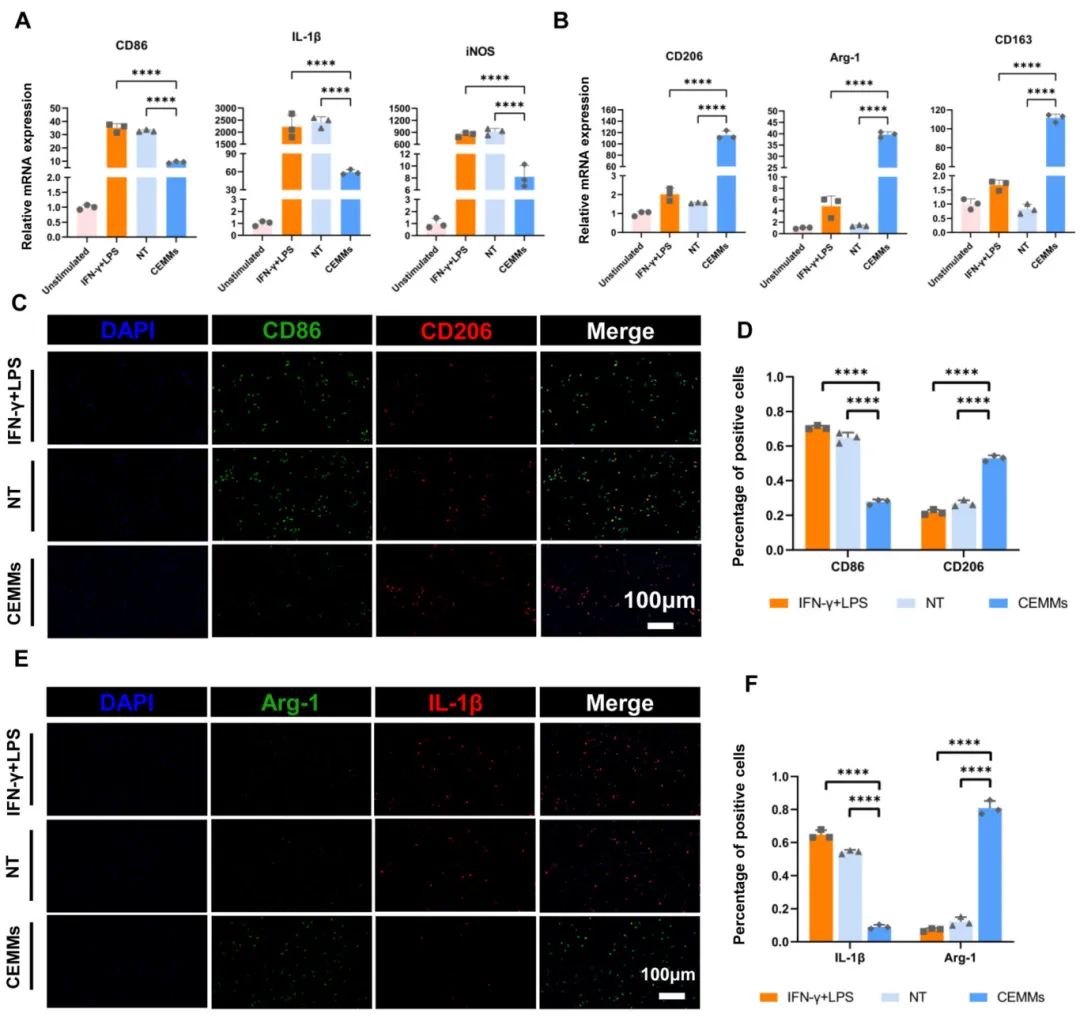
图2 CEMMS对大鼠巨噬细胞极化的影响
4,基于CEMMs的功能化软骨类器官构建
考虑到细胞粘附、扩增和细胞活力的平衡,研究在XPAN培养基中培养细胞3天以允许细胞在CEMMs上粘附和增殖,然后在CDM培养基中进行21天的软骨诱导。形态学特征和H&E、甲苯胺蓝染色的组织学评估显示,随着诱导培养时间的增加,包裹CEMMs的ECM和细胞也增加。qRT-PCR分析显示早期软骨转录因子SOX9随诱导时间延长持续增加表达,但在第21天显著下降,提示此时CORGs从早期向成熟软骨状态转变。软骨细胞表型标志物COLIIA1和ACAN在第7天开始增加,第14天和第21天表达更强。分泌功能分析显示总胶原和GAG含量随培养时间延长呈不同程度增加,其中第14天的CORGs具有相对最佳的细胞表型和软骨形成活性。
5,转录组学分析揭示类器官发育规律
转录组分析显示CORGs的基因表达模式与中胚层向软骨发育的转变一致。早期软骨发育阶段(D7 vs D0)上调的差异表达基因富集于早期软骨分化和ECM相关通路,包括"核糖体"、"肽生物合成过程"、"翻译"等代谢和能量相关的GO条目。中期软骨形成阶段(7-14天),与ECM和干细胞分化相关的GO条目如"糖胺聚糖结合"、"细胞外基质结构成分"等被上调。晚期软骨形成阶段(14-21天),与ECM和金属离子相关的GO条目如"离子转运"、"过渡金属离子结合"等被富集,提示细胞参与矿化基质的分泌和相互作用。KEGG通路富集分析显示TGF-β信号通路在早期软骨形成中上调,PI3K-Akt、Wnt和Hippo信号通路在中期上调,而Wnt、PI3K-Akt、TNF信号通路在晚期上调。
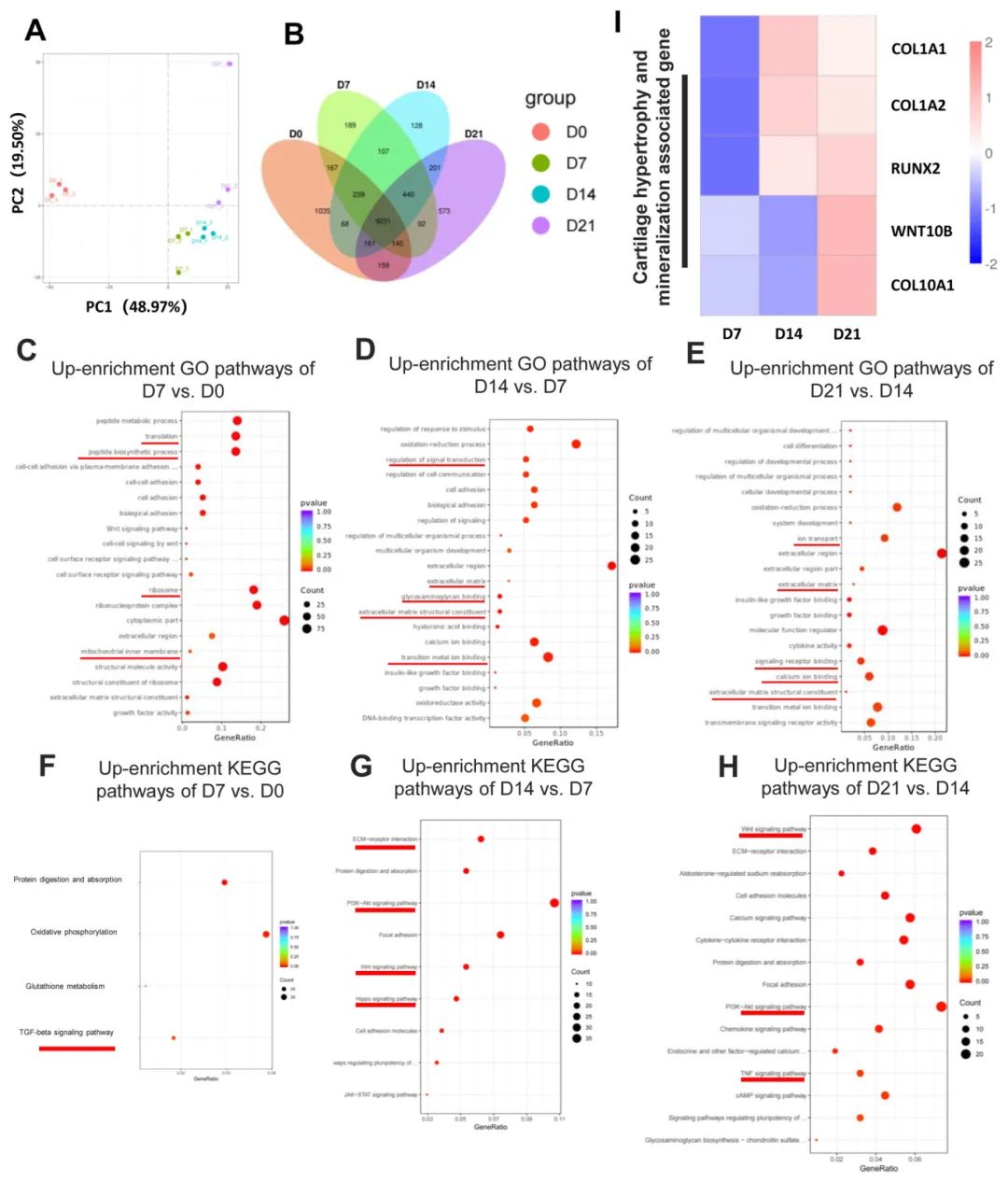
图3 在软骨形成分化过程中,CORGs遵循从中胚层到软骨发育基因的表达模式
6,体内软骨组织形成验证
为保护CORGs免受直接皮下植入的影响,将CORGs与GelMA水凝胶杂交后植入免疫缺陷小鼠皮下2个月。大体观察显示CORGs形成了半透明的软骨组织,而水凝胶组保持透明且未观察到软骨组织形成。H&E染色显示CORGs+GelMA组在CEMMs周围存在相对均匀的软骨细胞和胶原,番红O和甲苯胺蓝染色显示大量软骨基质成分和软骨细胞排列在CEMMs周围。免疫组化染色显示CORGs+GelMA组皮下存在多个II型胶原强阳性纤维。SOX9免疫荧光染色显示CORGs+GelMA组皮下异位组织中存在大量SOX9阳性细胞。HuNu染色发现大量HuNu阳性和阴性细胞,推测除CORGs来源的细胞外,免疫缺陷小鼠的一些细胞也参与了新软骨组织的形成。
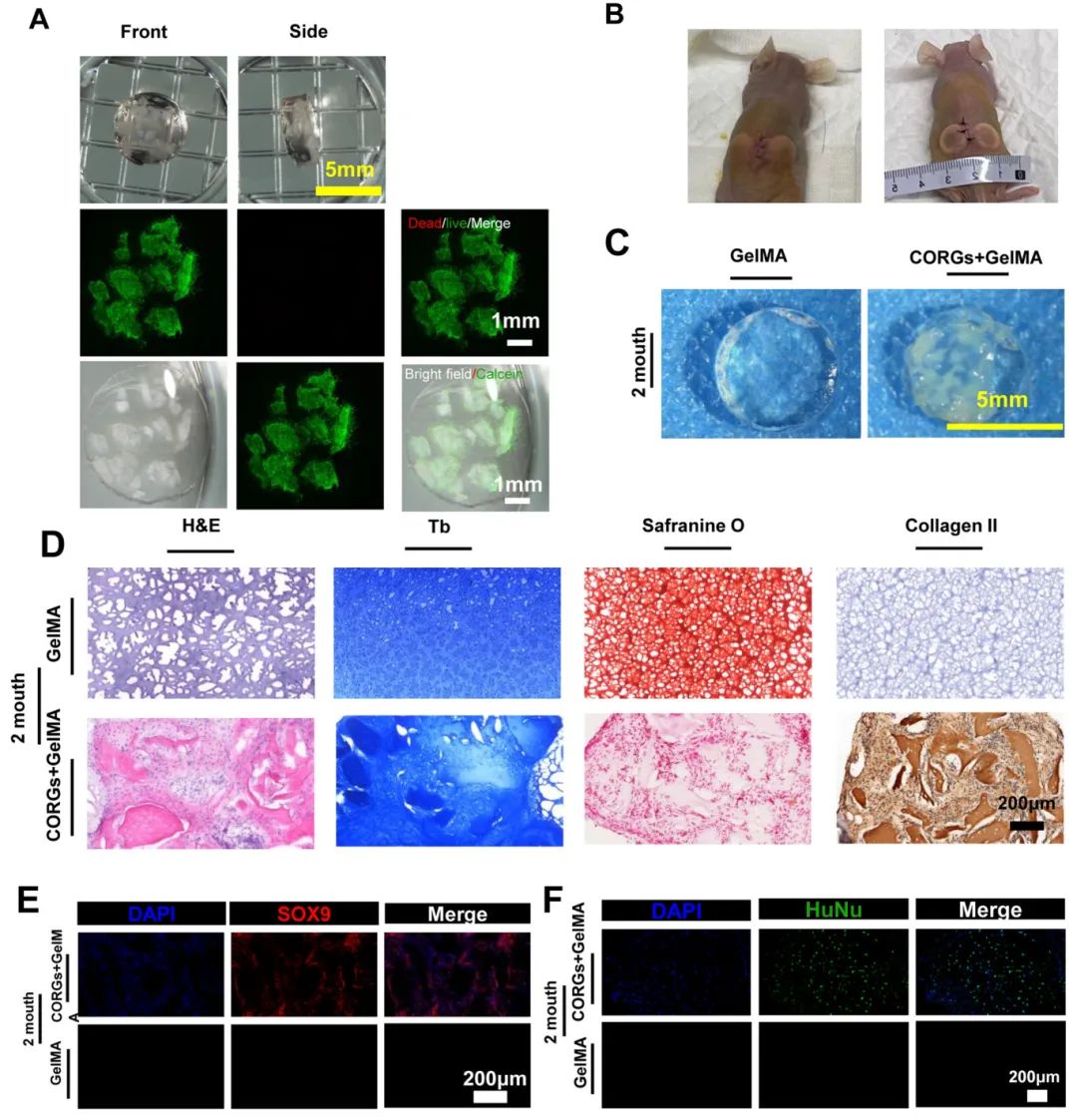
图4 软骨类器官在体内形成新的软骨组织
7,软骨缺损修复的体内验证
在SD大鼠软骨缺损模型中,CORGs植入7天后的滑膜组织免疫荧光分析显示,CEMMs基CORGs降低了CD86表达同时增强了CD206表达,表明能够通过促进M2巨噬细胞极化来调节关节微环境。长期修复结果显示,在6周和12周时,CORGs组的修复效果优于对照组和GelMA组。12周时,CORGs组缺损区域几乎完全平整,与周围组织整合良好,着色正常,且缺损区域无未降解的CEMMs。ICRS评分显示类似趋势。Micro-CT分析显示CORGs组圆形缺损填充更好,表面更光滑平整,软骨下骨修复更佳。组织学分析显示CORGs组在12周时表现出更规律排列的再生组织纤维,软骨特异性基质变得均匀,尽管略薄于假手术组。II型胶原免疫组化显示CORGs组修复区域有更多的II型胶原和更有序的纤维排列。
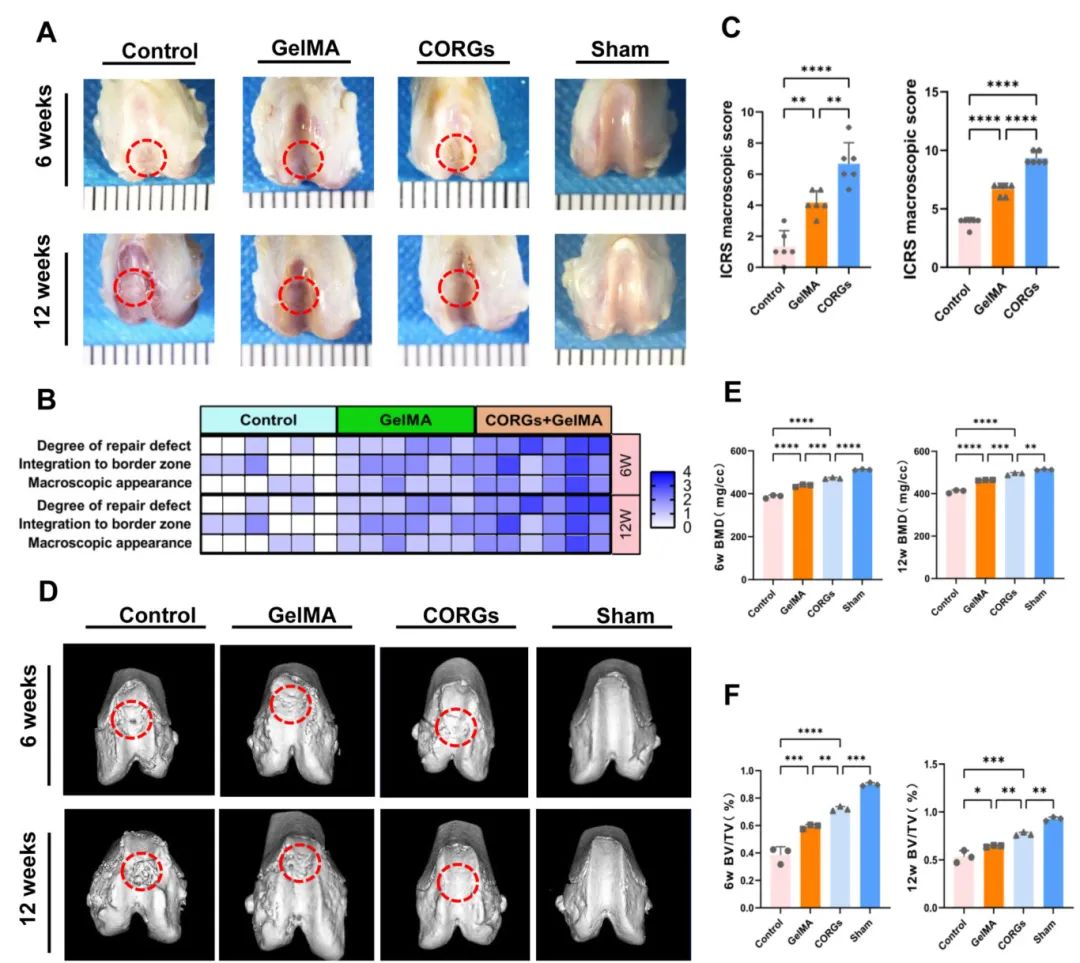
图5 大体与显微CT成像评估及评分
本研究成功构建了基于天然生物材料(ECM)和间充质干细胞的软骨类器官,为治疗软骨损伤展现了巨大潜力,为软骨组织再生工程的创新策略铺平了道路。该研究开辟了使用软骨来源脱细胞ECM构建CORGs的新途径,拓宽了dECM材料在类器官构建中的应用。CORGs优异的软骨再生功能提示其在软骨损伤临床治疗应用中的潜在探索价值。研究证实了CEMMs具有促进干细胞迁移、招募干细胞和发挥免疫调节作用的生物学效应,而基于CEMMs的CORGs保留了这些免疫调节功能以支持软骨再生。该技术为解决软骨组织有限的自我修复能力提供了新的解决方案,有望转化为临床应用以治疗由骨关节炎、运动损伤、先天性缺陷和外伤引起的软骨损伤。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000