常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-07-17 09:01:24 细胞资源库平台 访问量:154
乙肝病毒(HBV)感染是全球主要公共卫生问题之一,有超过2.5亿人慢性感染HBV。而其中有超三分之一的人口集中在我国,人数接近1亿人。NTCP工具细胞,特别是外源表达NTCP的肝癌细胞系如HepG2-NTCP和Huh7-NTCP,因其易操作、短周期、重现性佳的特点,在乙肝病毒(HBV)研究中扮演着至关重要的角色。这些细胞模型能够有效模拟HBV的感染过程,为研究HBV的生命周期、宿主限制因子、病毒复制以及药物筛选提供了一个强大而便捷的体外平台。它们不仅有助于揭示HBV感染的分子机制,如DDX3作为宿主限制因子阻碍cccDNA转录,GPC5作为附着因子在感染入胞过程中的作用,还能通过直接与NTCP相互作用或下调NTCP表达来筛选和验证抗病毒药物的活性,例如环孢菌素A及其衍生物、雷帕霉素及其衍生物等。此外,这些工具细胞还促进了对HBV宿主特异性分子的发现,为发展支持HBV感染的小动物模型提供了可能,这对于乙肝相关研究和药物开发具有重大意义。
英文标题:Deep learning NTCP model for late dysphagia after radiotherapy for head and neck cancer patients based on 3D dose, CT and segmentations
中文标题:基于3D剂量、CT和分割的头颈部癌放疗后晚期吞咽困难深度学习NTCP模型
发表期刊:《medRxiv》(预印本)
影响因子:
作者单位:
1. Department of Radiotherapy, University Medical Center Groningen, University of Groningen, Groningen, The Netherlands
2. Department of Radiation Oncology, the University of Texas MD Anderson Cancer Center, Houston, USA
3. Department of Head and Neck Surgery, the University of Texas MD Anderson Cancer Center, Houston, TX, USA
作者信息:
S.P.M. de Vettea, H. Neha, L. van der Hoeka
头颈部癌(HNC)放疗后晚期放射性吞咽困难(RAD)严重影响患者生活质量,甚至增加吸入性肺炎风险。传统正常组织并发症概率(NTCP)模型依赖离散剂量参数预测毒性,但无法完全捕捉吞咽功能相关的复杂解剖和剂量分布信息。深度学习(DL)可整合 3D 剂量、CT 和器官分割数据,有望提升预测性能。本研究旨在通过 3D 深度学习 NTCP 模型优化 RAD 预测,并与传统模型对比,同时探索临床变量的整合方式及模型关注的关键解剖区域。
纳入 1484 例 HNC 患者(荷兰格罗宁根大学医学中心(UMCG)1112 例,美国 MD 安德森癌症中心(MDACC)338 例),UMCG 队列用于模型训练(70%)、内部验证(15%)和独立测试(15%),MDACC 队列用于外部验证。以放疗后 6 个月≥2 级吞咽困难(CTCAE v4 或等效 PSS-HN 评分)为终点,采用 ResNet 架构构建深度学习模型,输入包括 3D 剂量分布、CT、器官分割(3D 输入)及临床变量(1D 输入,如预处理吞咽困难、肿瘤位置等),对比传统 NTCP 模型(基于吞咽器官平均剂量等参数)的性能,通过 AUC、校准曲线、Nagelkerke R² 和 Brier 评分评估。采用留一法分析各输入模态的贡献,通过 Grad-CAM++ 生成注意力图识别关键解剖区域。
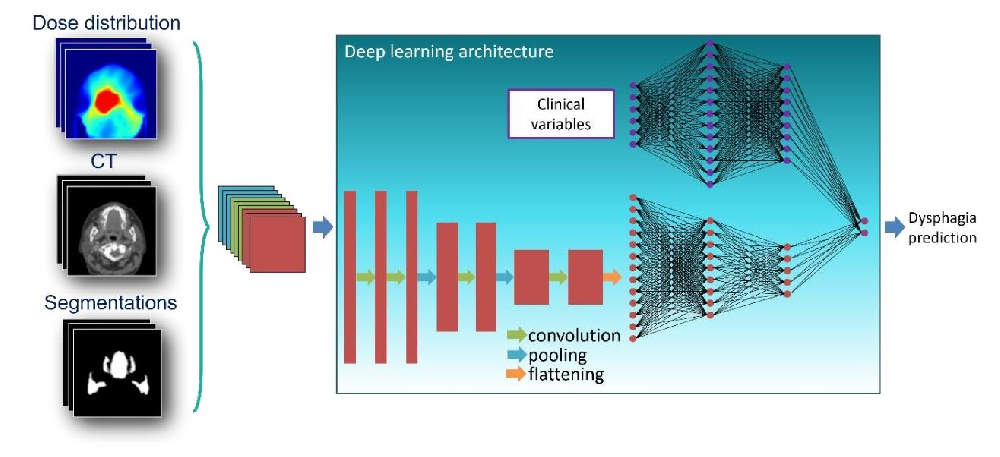
图1:深度学习模型总体架构
展示模型输入与处理流程,3D 输入(剂量分布、CT、器官分割)经卷积、池化和扁平化处理,1D 输入(临床变量)并行处理,最终融合输出 RAD 风险预测。该架构可单独使用 3D 输入,或结合 3D 与 1D 输入(两种融合方式:单独训练后逻辑回归整合,或同步优化权重)。
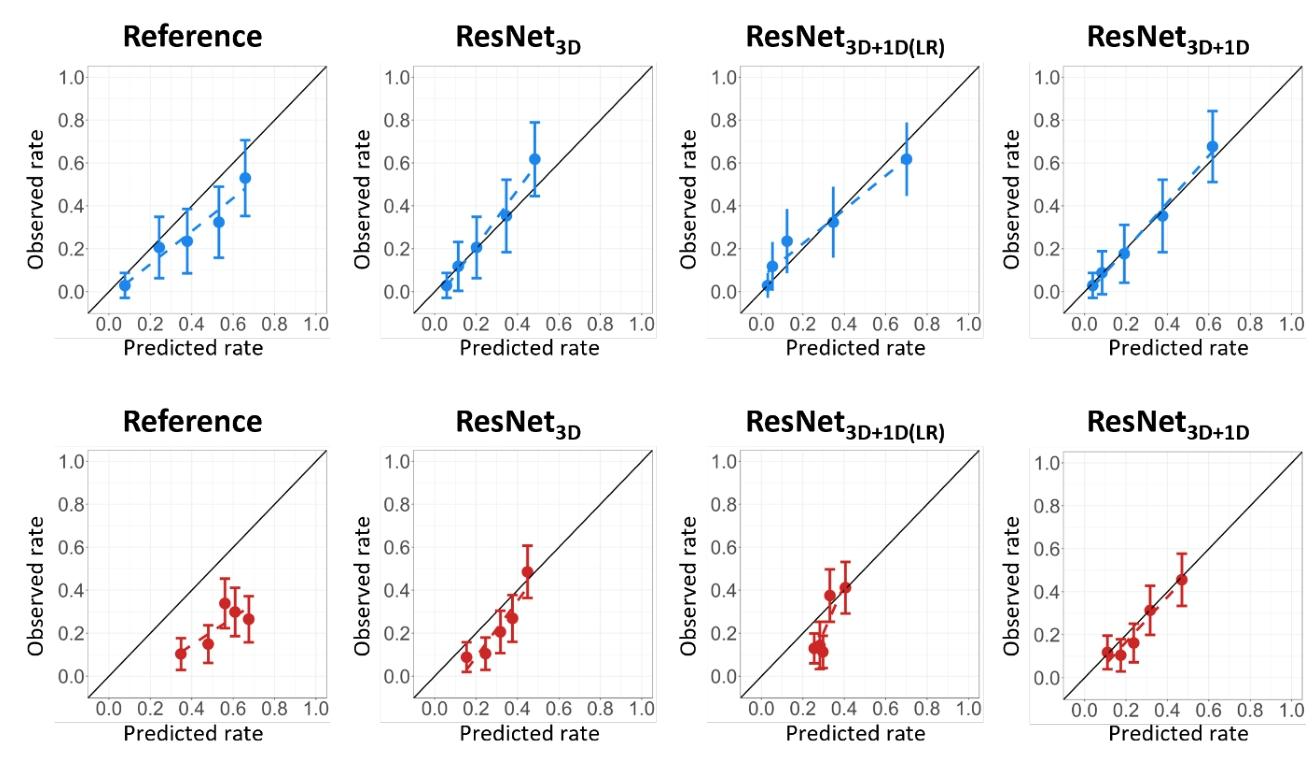
图2:模型校准曲线(独立测试队列与外部测试队列)
蓝色曲线为 UMCG 独立测试队列,红色为 MDACC 外部测试队列。深度学习模型(ResNet3D、ResNet3D+1D 等)的预测风险与实际 RAD 发生率更接近,校准效果优于传统 NTCP 模型,其中 ResNet3D+1D 校准最佳,传统模型在外部队列中偏差较大。
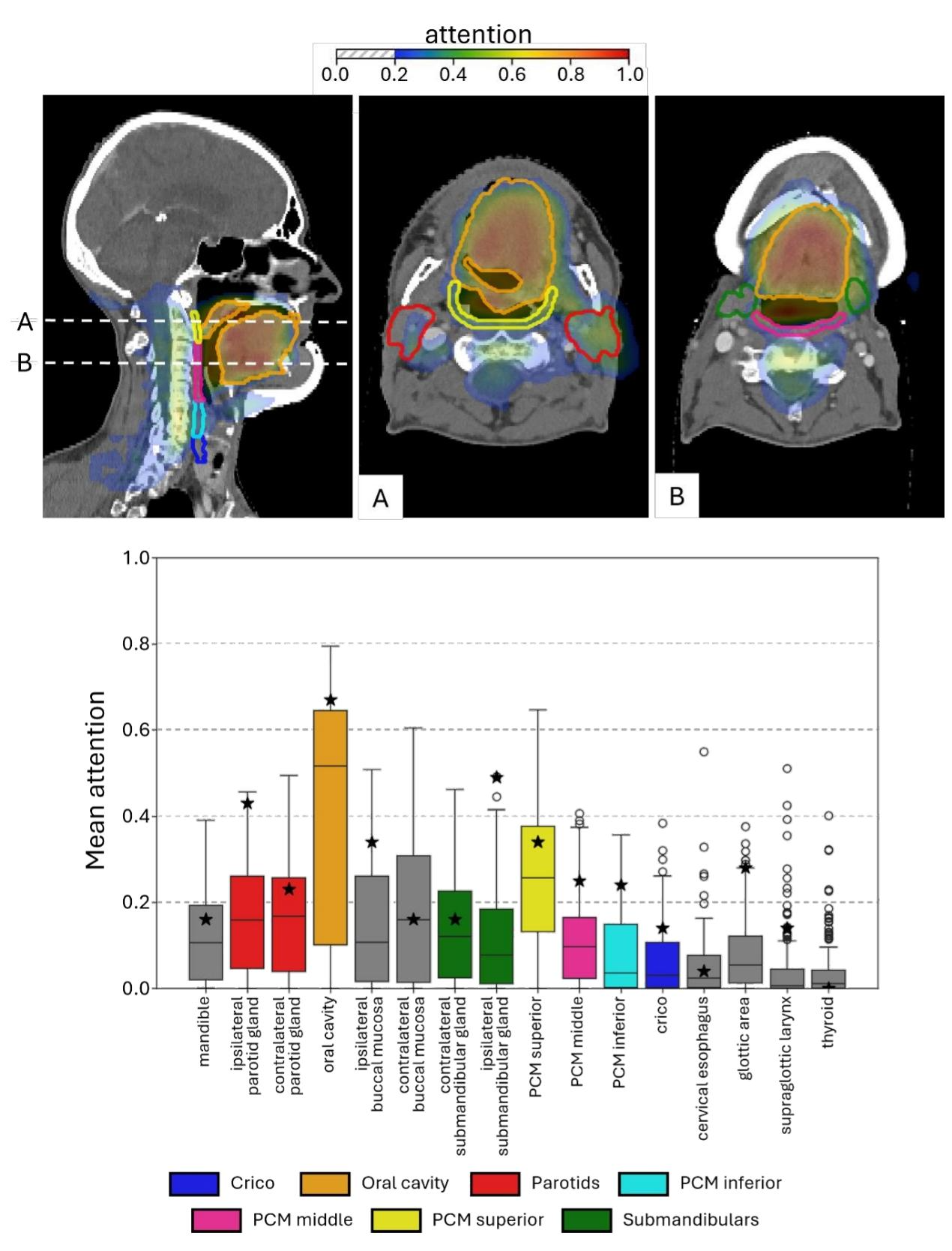
图3:注意力图
上图为 1 例发生 RAD 患者的注意力图,显示口腔、咽缩肌(PCM)、唾液腺等区域对预测贡献显著;下图为独立测试队列中各器官的平均注意力值,口腔和上咽缩肌(PCM superior)是整体队列中模型关注的核心区域,与吞咽功能密切相关。
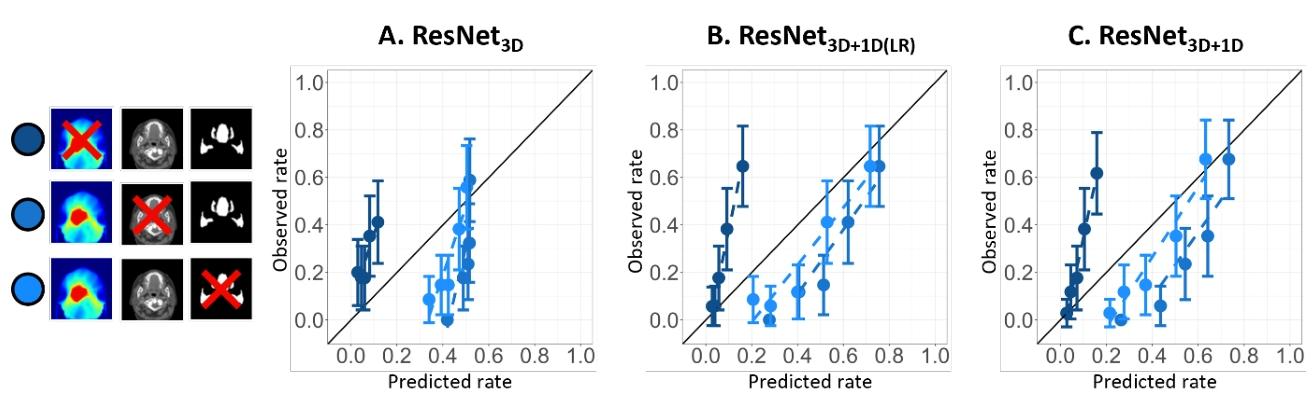
图4:独立测试队列留一法分析校准曲线
不同颜色代表省略不同输入模态的模型性能:省略剂量数据时预测值整体偏低,省略分割数据时预测值偏高且分布集中,省略 CT 时 ResNet3D 预测值集中在 0.5 左右,而结合 1D 输入的模型分布更宽。表明剂量是模型预测的核心输入,CT 和分割数据可辅助优化预测精度。
深度学习 NTCP 模型在头颈部癌放疗后 RAD 预测中表现优于传统模型,独立测试队列 AUC 达 0.80-0.84(传统模型 0.76),外部队列 AUC 达 0.73-0.74(传统模型 0.63),且校准更优。结合 3D 输入(剂量、CT、分割)与 1D 临床变量可进一步提升性能,其中同步优化权重的融合方式(ResNet3D+1D)效果最佳。注意力图证实口腔和上咽缩肌是影响 RAD 的关键区域,留一法分析表明剂量数据对模型预测至关重要。该研究表明,整合 3D 剂量和解剖信息的深度学习模型可更精准预测 RAD,为放疗计划优化和临床决策提供依据。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:通过持续激活 toll 样受体 - 2(TLR2)促进肿瘤抗原交叉呈递的支架疫苗
下一篇:基于生物发光的活细胞内源性蛋白质相互作用定量检测方法