常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-07-04 09:00:00 细胞资源库平台 访问量:221
英文标题:Cholesterol-rich lysosomes induced by respiratory syncytial virus promote viral replication by blocking autophagy flux
中文标题:呼吸道合胞病毒诱导的富含胆固醇的溶酶体通过阻断自噬促进病毒复制
发表期刊:《Nature Communications》
影响因子:14.7
作者单位:暨南大学国家生物活性分子与药物评估重点实验室、暨南大学附属第一医院皮肤科、暨南大学生命科学与技术学院广东省生物工程医学重点实验室
作者信息:
Lifeng Chen, Jingjing Zhang, Weibin Xu, Jiayi Chen, Yujun Tang, Si Xiong, Yaolan Li, Hong Zhang, Manmei Li, Zhong Liu
溶酶体与胆固醇代谢
溶酶体是单层膜细胞器,负责降解生物大分子并维持细胞稳态。
溶酶体胆固醇代谢异常会导致自噬流受损,影响细胞功能。
呼吸道合胞病毒(RSV)的挑战
RSV是导致婴幼儿和老年人呼吸道疾病的主要病原体,目前尚无特效治疗方法。
RSV通过劫持宿主胆固醇代谢和自噬通路促进自身复制,但具体机制尚不明确。
研究创新点
首次揭示RSV通过下调溶酶体酸性脂肪酶(LAL)活性,阻断胆固醇从溶酶体到内质网的运输,激活SREBP2-LDLR轴,促进外源性胆固醇在溶酶体中积累。
发现胆固醇富集的溶酶体通过抑制自噬流,为RSV融合蛋白(F蛋白)提供储存位点,从而促进病毒复制。
病毒与细胞模型
使用HEp-2、16HBE和原代支气管上皮细胞(HBECs)作为RSV感染的体外模型。
构建LDLR敲除小鼠(LDLR)作为体内模型。
胆固醇代谢分析
通过荧光探针Filipin III和Amplex™ Red胆固醇检测试剂盒观察胆固醇分布和含量。
利用溶酶体提取试剂盒分离溶酶体,检测RSV-F蛋白的富集情况。
自噬流评估
使用mRFP-GFP-LC3B串联传感器监测自噬体到自噬溶酶体的转化。
通过透射电镜(TEM)观察自噬溶酶体的数量。
分子机制研究
通过免疫荧光和共聚焦显微镜分析ORP1L、VAP-A、Rab7等蛋白的相互作用。
利用双荧光素酶报告系统检测SREBP2的转录活性。
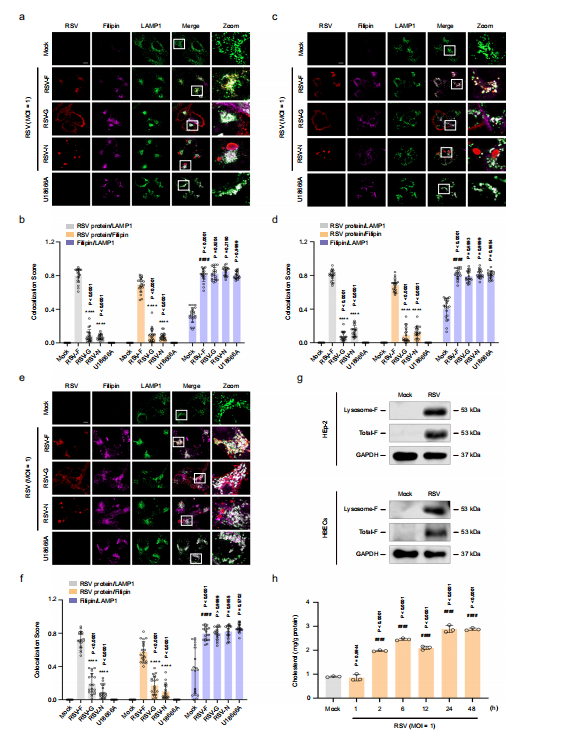
图1:RSV-F蛋白在感染细胞的富胆固醇溶酶体中积聚
HEp-2、16HBE或HBECs细胞在指定时间内在添加或不添加U18666A(10 μM)的情况下进行模拟感染或RSV感染(MOI=1)。
图(a-f) 在模拟感染、RSV感染(感染后24小时)和U18666A处理的细胞中,RSV蛋白(RSV-F、RSV-G和RSV-N)、胆固醇(菲律宾菌素III)和LAMP-1的免疫共定位(HEp-2(a,b);16HBE(c,d);HBECs(e,f)。比例尺:10微米。数据(n=20张显微照片)为三个独立实验的代表性结果。g 溶酶体中RSV-F蛋白的Western印迹分析。
图(h) 使用Amplex™ Red胆固醇检测试剂盒测定HEp-2细胞在RSV感染后0小时、1小时、2小时、6小时、12小时、24小时和48小时的胆固醇含量(n=3次独立实验)。图像参数:每像素缩放比例(a、c、e:0.032×0.032 μm2);图像大小-像素(a、c、e:2432×2432);图像大小-缩放后(a、c、e:78.01×78.01 μm2);物镜(a、c、e:平面复消色差63×/1.40油镜DIC M27);扫描放大倍数(a、c、e:1.3)。数据以均值±标准差表示,采用单因素方差分析进行统计学分析(与空白对照组相比,####P < 0.0001;与病毒对照组相比,****P < 0.0001)。

图2:呼吸道合胞病毒(RSV)感染通过降低溶酶体酸性脂肪酶(LAL)活性阻断胆固醇从溶酶体外排
HEp-2细胞在奥利司他(10μM)存在或不存在条件下,模拟感染或RSV感染(MOI=1)不同时长。图(a、b)采用流式细胞术测定RSV感染24小时后HEp-2细胞中LAL活性(n=3次独立实验)。图(c)采用RT-PCR测定RSV感染12或24小时后HEp-2细胞中LAL基因mRNA水平(n=3次独立实验)。
图(d、e) Western blotting分析RSV感染12或24小时后HEp-2细胞中LAL蛋白表达(n=3次独立实验)。数据以均值±标准差表示,统计学分析采用双尾Student t检验(c、e)或单因素方差分析(b)(与空白对照组比较**P<0.01,****P<0.0001)。
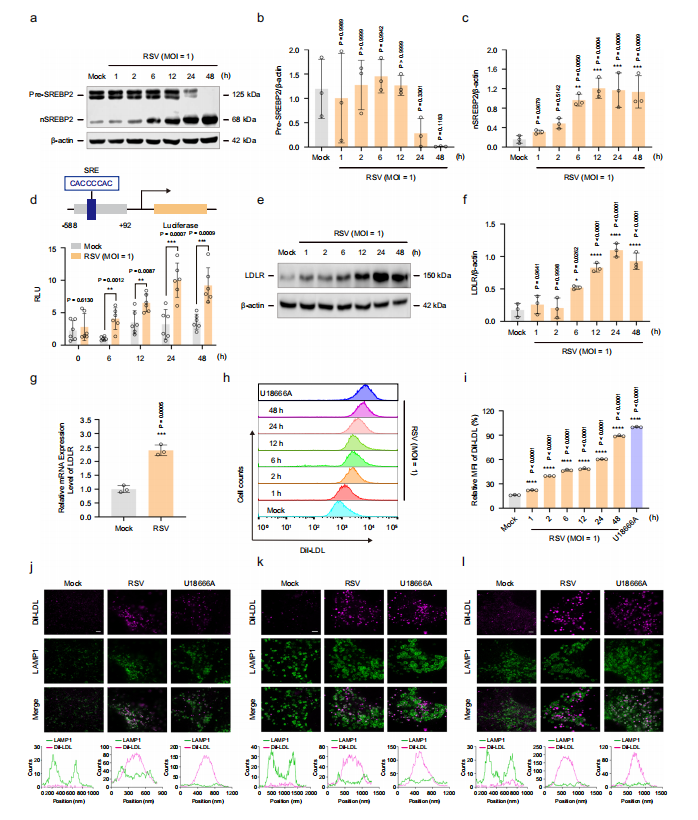
图3:RSV通过激活SREBP2-LDLR轴促进溶酶体胆固醇蓄积从而增强LDL摄取
实验采用瞬时表达pGL3-SRE-LUC和pRL-TK的HEK293T细胞、HEp-2细胞、16HBE细胞或HBECs细胞,在U18666A(10μM)存在或缺失条件下,分别进行模拟感染或RSV感染(MOI=1)不同时长。
图(a-c) Western blot检测HEp-2细胞在RSV感染后0、1、2、6、12、24、48小时的SREBP2蛋白表达(n=3次独立实验)。
图(d) 双荧光素酶报告系统检测HEK293T细胞RSV感染后0、6、12、24、48小时的SREBP2转录活性(n=6次独立实验)。
图(e-f) Western blot检测HEp-2细胞RSV感染后不同时间点的LDLR蛋白表达(n=3次独立实验)。
图(g)RT-PCR检测HEp-2细胞RSV感染24小时后LDLR基因mRNA水平(n=3次独立实验)。h-i 流式细胞术检测HEp-2细胞RSV感染后对外源胆固醇(Dil-LDL,30μg/mL)的摄取动态(n=3次独立实验)。
图(j-l) 免疫荧光共定位显示Dil-LDL与LAMP-1在模拟感染组、RSV感染组(感染后24小时)及U18666A处理组中的分布情况(HEp-2(j);16HBE(k);HBECs(l))。比例尺:2μm。数据均来自三次独立实验的代表性结果。成像参数:像素尺寸(j,l:20nm;k:25nm);图像尺寸(j,l:20×20μm²,1000×1000像素²;k:20×20μm²,800×800像素²);物镜倍数(j,k,l:100×,1.45)。数据以均值±标准差表示,统计学分析采用双尾Student's t检验(d,g)或单因素ANOVA(b,c,f,i)(*P<0.05,**P<0.01,***P<0.001,****P<0.0001,与空白对照组比较)。
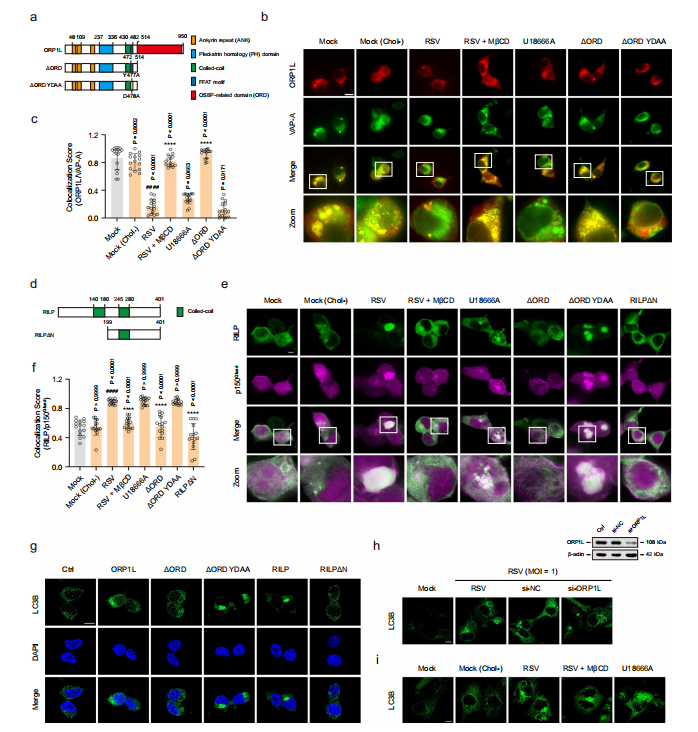
图4:RSV诱导溶酶体胆固醇积累通过调控ORP1L促进自噬体向微管负端运输
瞬时转染指定质粒的HEK293T细胞或HEp-2细胞在si-NC(阴性对照核苷酸,50 nM)、si-ORP1L(50 nM)、U18666A(10 μM)或MβCD(100 μM)存在或不存在条件下,模拟感染或RSV感染(MOI=1)24小时。
图(a-c)感染HEK293T细胞中ORP1L与VAP-A的免疫共定位(n=15显微视野)。比例尺:10 μm。
图(d-f)感染HEK293T细胞中RILP与p150Glued的免疫共定位(n=15显微视野)。比例尺:10 μm。g 通过免疫荧光检测ORP1L或RILP对HEK293T细胞LC3B定位的影响。比例尺:10 μm。
图(h)通过免疫荧光检测si-ORP1L或si-NC对感染HEp-2细胞LC3B定位的影响。比例尺:10 μm。i 感染HEp-2细胞LC3B定位的免疫荧光分析。比例尺:10 μm。图像参数:像素尺寸(b: 0.031×0.031 μm2;e: 0.025×0.025 μm2;h, i: 0.032×0.032 μm2);图像尺寸-像素(b: 1024×1024;e: 2048×2048;h, i: 2432×2432);图像尺寸-实际(b: 64.00×64.00 μm2;e: 50.71×50.71 μm2;h, i: 78.01×78.01 μm2);物镜(b: 63×1.40NA油镜;e, h, i: 平场复消色差63×/1.40油镜DIC M27);扫描放大倍数(b: 1.6;e: 2.0;h, i: 1.3)。数据为三次独立实验的代表性结果,以均值±标准差表示,采用单因素方差分析进行统计学处理(####P<0.0001与空白对照组比较;****P<0.0001与病毒对照组比较)。
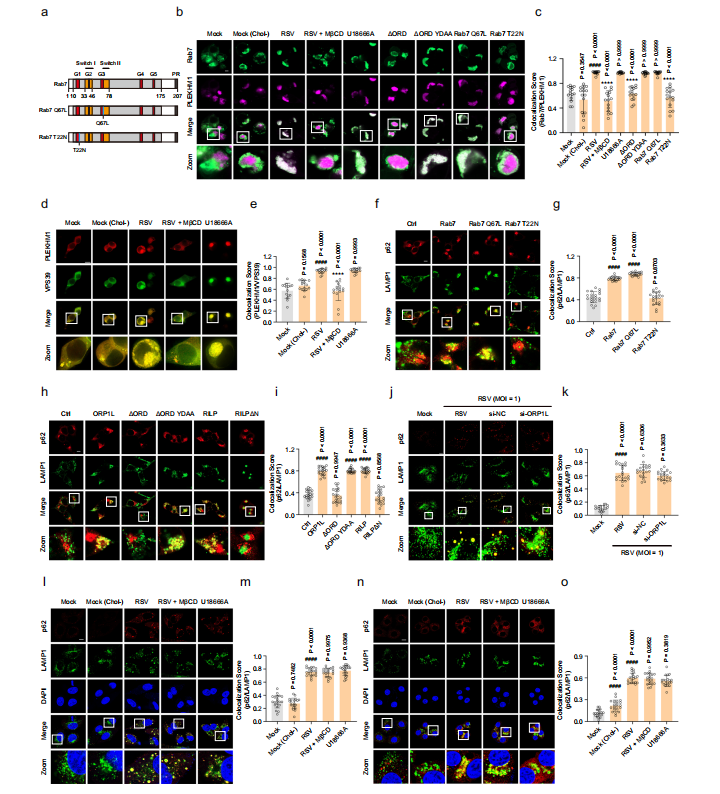
图5:RSV诱导的溶酶体胆固醇积累通过调控ORP1L促进自噬溶酶体形成
瞬时转染指定质粒的HEK293T细胞、HEp-2或16HBE细胞,在si-NC(50 nM)、si-ORP1L(50 nM)、U18666A(10 μM)或MβCD(100 μM)存在或不存在条件下,模拟感染或RSV感染(MOI=1)24小时。
图(a-c)感染HEK293T细胞中Rab7与PLEKHM1的免疫共定位(n=15显微视野)。比例尺:10 μm。d,e 感染HEK293T细胞中PLEKHM1与VPS39的免疫共定位(n=15显微视野)。比例尺:10 μm。
图(f-i)通过免疫荧光检测Rab7、ORP1L或RILP对HEK293T细胞中p62与LAMP1共定位的影响(n=20显微视野)。比例尺:10 μm。j,k 通过免疫荧光检测siORP1L或si-NC对感染HEp-2细胞中p62与LAMP1共定位的影响(n=20显微视野)。比例尺:10 μm。
图(l-o)感染细胞(HEp-2:l,m;16HBE:n,o)中p62与LAMP1的免疫共定位(n=20显微视野)。比例尺:10 μm。图像参数:像素尺寸(b: 0.025×0.025 μm²;d,j: 0.031×0.031 μm²;f,h: 0.028×0.028 μm²;l,n: 0.032×0.032 μm²);图像尺寸-像素(b: 2048×2048;d: 1024×1024;f,h,l,n: 2432×2432;j: 1536×1536);图像尺寸-实际(b: 50.71×50.71 μm²;d: 64.00×64.00 μm²;f,h: 67.61×67.61 μm²;l,n: 78.01×78.01 μm²;j: 96.00×96.00 μm²);物镜(b,f,h,l,n: 平面复消色差63×/1.40油镜DIC M27;d,j: 63×1.40 NA油镜);扫描缩放(b: 2.0;d,j: 1.6;f,h: 1.5;l,n: 1.3)。数据来自三次独立实验的代表性结果,以均值±标准差表示,采用单因素方差分析进行统计学处理(####P<0.0001与空白对照组相比;****P<0.0001与病毒对照组相比)。
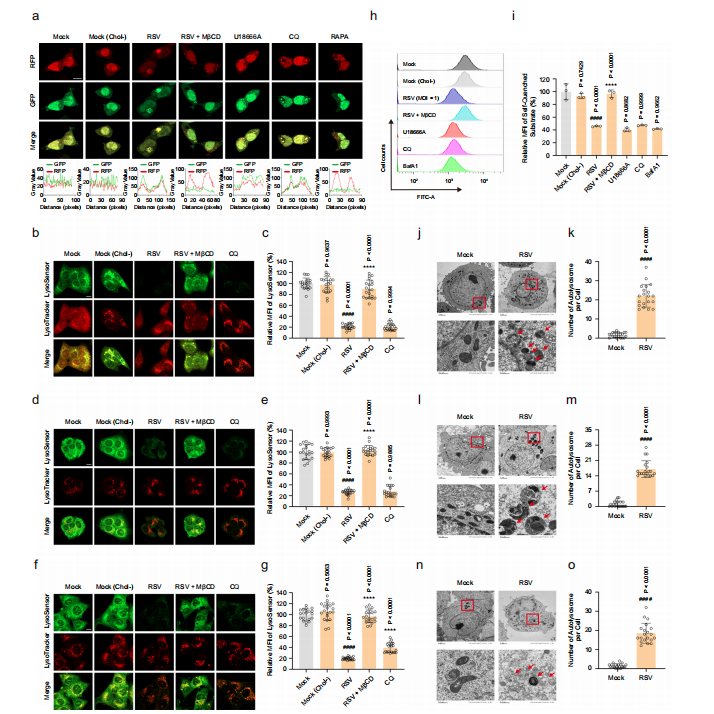
图6:RSV诱导的溶酶体胆固醇积累通过抑制自噬溶酶体降解阻断自噬流
瞬时表达mRFP-GFP-LC3B的HEK293T细胞、HEp-2细胞、16HBE细胞或HBECs细胞在U18666A(10 μM)、CQ(5 μM)、RAPA(200 nM)、MβCD(100 μM)或BafA1(200 nM)存在或不存在的情况下,模拟感染或感染RSV(MOI=1)24小时。
图(a)使用配备Airyscan的共聚焦显微镜测量感染HEK293T细胞中mRFP-GFP-LC3B的荧光强度。比例尺:10 μm。数据为三次独立实验的代表性结果。
图(b–g)使用配备Airyscan的共聚焦显微镜测量感染细胞中LysoSensor的荧光强度(HEp-2(b、c);16HBE(d、e);HBECs(f、g))。比例尺:10 μm。数据(n=20张显微照片)为三次独立实验的代表性结果。
图(h、i)使用流式细胞术检测RSV对感染HEp-2细胞溶酶体活性的影响(n=3次独立实验)。j–o 使用透射电镜检测感染细胞中自噬溶酶体的数量(HEp-2(j、k);16HBE(l、m);HBECs(n、o))。红色箭头指示自噬溶酶体。比例尺:2 μm或500 nm。数据(n=20个细胞)为三次独立实验的代表性结果。图像参数:像素缩放(a:0.025×0.025 μm2;b、d、f:0.038×0.038 μm2);图像尺寸-像素(a、b、d、f:2048×2048);图像尺寸-缩放(a:50.71×50.71 μm2;b、d、f:78.01×78.01 μm2);物镜(a、b、d、f:plan-apochromat 63×/1.40 oil DIC M27);扫描缩放(a:2.0;b、d、f:1.3)。数据以均值±标准差表示,统计学分析采用双尾Student t检验(k、m、o)或单因素ANOVA(c、e、g、i)(####P<0.0001与空白对照组相比;****P<0.0001与病毒对照组相比)。
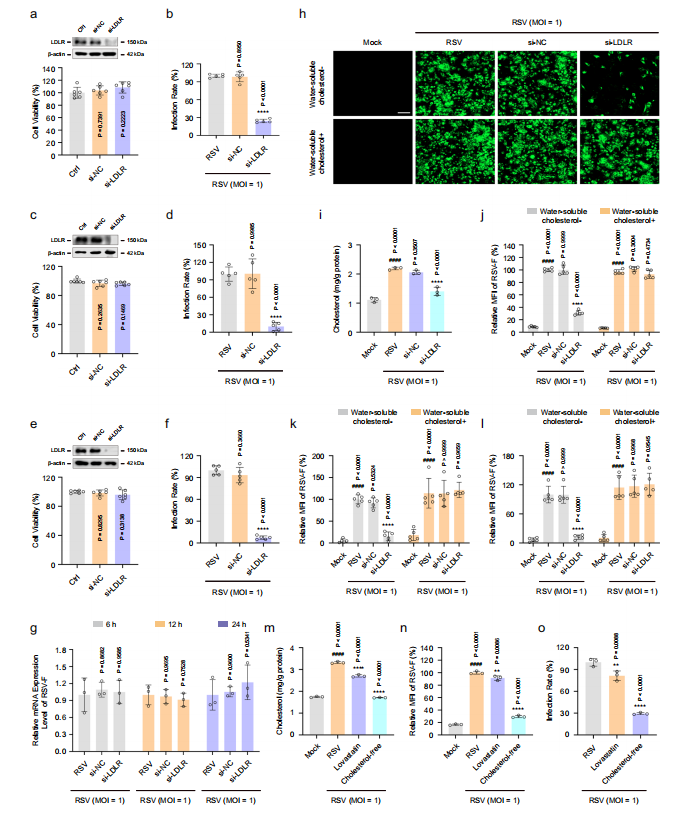
图7:敲低LDLR通过调节感染细胞外源性胆固醇摄取降低RSV-F蛋白含量
HEp-2、16HBE或HBECs细胞模拟感染或RSV感染(MOI=1)后,在正常或无胆固醇培养基中培养,并分别加入si-LDLR(50 nM)、siNC(50 nM)、水溶性胆固醇(40 μM)或洛伐他汀(25 μM)处理指定时长。
图(a、c、e)使用CCK-8法检测si-LDLR对细胞的毒性作用(HEp-2(a);16HBE(c);HBECs(e))(n=6次独立实验)。
图(b、d、f)采用免疫荧光法检测si-LDLR对RSV感染细胞病毒滴度的影响(HEp-2(b);16HBE(d);HBECs(f))(n=5次独立实验)。
图(g)通过RT-PCR测定RSV感染后6 h、12 h和24 h时si-LDLR对HEp-2细胞中RSV F基因mRNA水平的影响(n=3次独立实验)。
图(h–l)分别使用Amplex™ Red胆固醇检测试剂盒或免疫荧光法测定RSV感染24 h后si-LDLR对胆固醇含量或RSV-F蛋白水平的影响(HEp-2(h–j);16HBE(k);HBECs(l))(h、j、k、l:n=5次独立实验;i:n=3次独立实验)。比例尺:100 μm。m–o 采用Amplex™ Red胆固醇检测试剂盒和免疫荧光法分别测定外源性或内源性胆固醇对感染HEp-2细胞胆固醇含量(m)、RSV-F蛋白水平(n)及病毒滴度(o)的影响(n=3次独立实验)。数据以均值±标准差表示,采用单因素方差分析进行统计学处理(与空白对照组比较####P < 0.0001;与病毒对照组比较**P < 0.01,****P < 0.0001)。
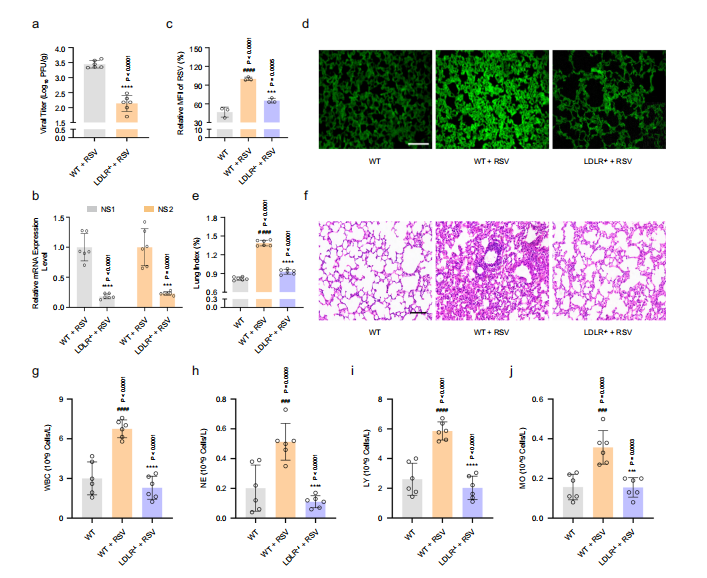
图8:敲除LDLR在体内抑制RSV感染。野生型或LDLR−/− C57BL/6小鼠分别进行模拟感染或RSV感染
RSV感染后第4天,分别采用空斑试验、RT-PCR和免疫荧光法测定各组肺组织中病毒滴度(a: n=6只小鼠)、RSV NS1和NS2 mRNA水平(b: n=6只小鼠)及RSV蛋白水平(c,d: n=3只小鼠)。比例尺:200微米。
图(e)肺指数为肺重与体重比值(n=6只小鼠)。
图(f)采用苏木精-伊红染色对各组肺组织进行病理学分析。比例尺:100微米。
图(g-j)使用五分类血液分析仪检测各组外周血中白细胞(WBC)、中性粒细胞(NE)、淋巴细胞(LY)和单核细胞(MO)数量(n=6只小鼠)。数据以均值±标准差表示,采用双尾Student t检验(a,b)或单因素方差分析(c,e,g-j)进行统计学分析(与空白对照组比较###P<0.001,####P<0.0001;与病毒对照组比较***P<0.001,****P<0.0001)。
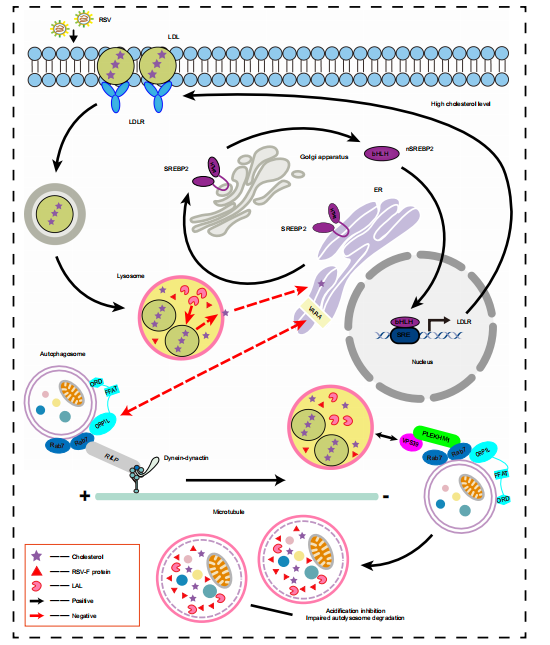
图9:呼吸道合胞病毒(RSV)驱动溶酶体胆固醇重编程以促进病毒复制的示意图
RSV重编程感染细胞的胆固醇代谢:通过降低溶酶体酸性脂肪酶(LAL)活性阻断胆固醇从溶酶体向内质网(ER)的转运,激活SREBP2-LDLR轴,促进感染细胞对外源性胆固醇的摄取与溶酶体蓄积。感染细胞内高胆固醇水平通过改变ORP1L功能,触发自噬体向微管负端运输及自噬溶酶体形成。另一方面,富含胆固醇的溶酶体呈现酸化抑制与功能障碍,损害自噬溶酶体降解与自噬流,为RSV-F蛋白储存创造位点。抑制低密度脂蛋白受体(LDLR)可有效逆转RSV诱导的胆固醇含量升高,从而阻断RSV感染。
创新策略:
揭示了RSV通过溶酶体胆固醇代谢重编程和自噬流抑制促进病毒复制的新机制。
提出LDLR作为抗RSV药物开发的潜在靶点。
转化意义:
为RSV感染的治疗提供了新思路,靶向胆固醇代谢或LDLR可能成为抗病毒新策略。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:BODIPY - 腔肠素偶联物作为 NanoLuc 的自发光底物
下一篇:靶向抗癌的化合物竟是检测干扰剂?这项研究揭开药物筛选的 "障眼法"