常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-06-27 17:36:44 细胞资源库平台 访问量:266
英文标题:Nanoparticles destabilizing the cell membranes triggered by NIR light for cancer imaging and photo-immunotherapy
中文标题:近红外光触发的纳米粒子破坏细胞膜,用于癌症成像和光免疫治疗
发表期刊:《Nature Communications》
影响因子:14.7
作者单位:北京分子科学国家实验室、中国科学院化学研究所、中国科学院大学
作者信息:
Dongsheng Tang, Minhui Cui, Bin Wang, Ganghao Liang, Hanchen Zhang, Haihua Xiao
癌症治疗的现状与挑战
化疗和分子靶向治疗是当前主要的临床癌症治疗手段,但存在毒性大、疗效不佳和耐药性等问题。
聚合物-药物偶联物和基于聚合物的药物递送系统成为研究热点,但阳离子聚合物对正常细胞的毒性限制了其应用。
光动力疗法(PDT)的优势与局限
PDT通过光激发敏化剂产生活性氧(ROS)杀死肿瘤细胞,但单独使用PDT诱导的免疫原性细胞死亡(ICD)效果不足。
阳离子聚合物可作为佐剂,通过破坏内体/溶酶体膜增强免疫反应。
研究创新点
设计了一种近红外光(NIR-II)激活的纳米颗粒(mt-NPBodipy),结合光动力治疗和免疫治疗,实现时空可控的肿瘤靶向治疗
纳米颗粒设计与合成
Aza-TPA-Bodipy:NIR-II荧光分子,具有高效ROS生成能力(量子产率16.4%)。
PBodipy:含ROS响应性硫缩酮键的聚合物,用于光控释放。
Pmt:膜靶向阳离子聚合物,含胆固醇分子,用于破坏细胞膜。
mt-NPBodipy:通过自组装形成,具有肿瘤靶向性和光控释放特性。
体外实验
细胞摄取与膜破坏:通过共聚焦显微镜观察纳米颗粒在细胞膜上的定位及膜破坏效果。
细胞毒性:MTT实验评估纳米颗粒对CT26细胞的杀伤效果。
RNA测序分析:研究mt-NPBodipy对细胞转录组的影响。
体内实验
生物分布与成像:通过NIR-II荧光成像评估纳米颗粒在肿瘤中的富集情况。
抗肿瘤效果:在CT26荷瘤小鼠模型中评估肿瘤抑制率、免疫细胞浸润及免疫记忆效应。
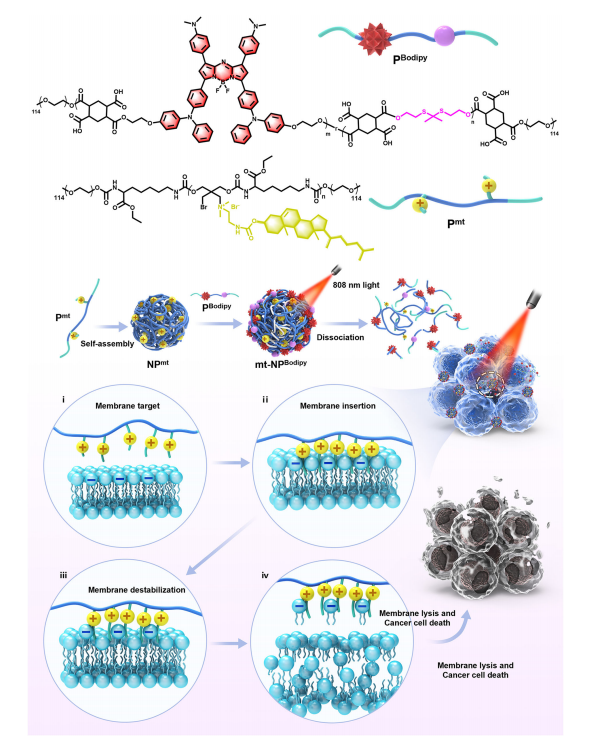
图1:纳米粒子在近红外光作用下导致细胞膜不稳定性的示意图
PBodipy含有NIR-II荧光Bodipy单元和ROS响应的硫代酮键,这些单元能被近红外光激发产生ROS,进而导致硫代酮键断裂和聚合物降解。Pmt含有大量胆固醇以靶向细胞膜,并含有季铵盐以破坏细胞膜。Pmt自组装形成NPmt,随后被PBodipy屏蔽成mt-NPBodipy。当用808纳米激光激发时,mt-NPBodipy解离,释放出阳离子聚合物Pmt。通过静电相互作用,Pmt能够靶向并插入细胞膜(i,ii),进而破坏并裂解细胞膜(iii,iv),最终导致肿瘤细胞死亡。源数据见源数据文件。
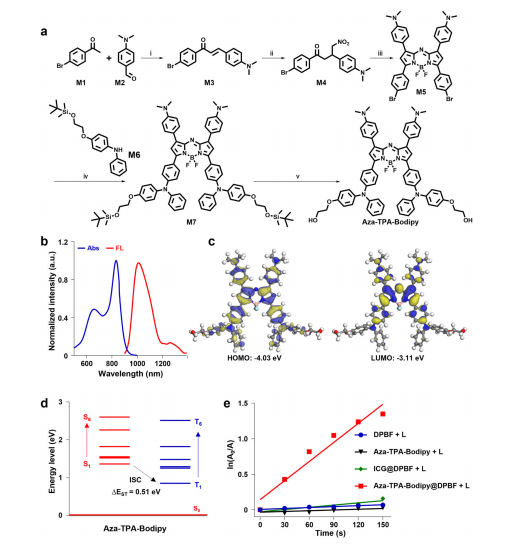
图2:Aza-TPA-Bodipy的合成与表征
图(a) Aza-TPA-Bodipy的合成路线。试剂和条件:i)醋酸,吡啶,甲苯,80°C,24小时。ii)亚硝酸甲酯,三乙胺,乙醇,95°C,48小时。iii)醋酸铵,正丁醇,120°C,24小时;BF3OEt2,二异丙基乙胺,二氯甲烷,25°C,24小时。iv)二(3-丁基)钯(III),P(t-Bu)3,碳酸叔丁酯,甲苯,85°C,24小时。v)氢氟酰吡啶,二氯甲烷,室温,2小时。
图(b) Aza-TPA-Bodipy在四氢呋喃中的吸收光谱和光致发光光谱。
图(c)通过DFT计算优化了Aza-TPA-Bodipy的几何结构和HOMO-LUMO分布。
图(d)通过垂直激发优化结构(见图c)计算出S1-S6和T1-T6的能量水平。
图(e) ln(A0/A)与光照时间的关系图,其中A0和A分别表示辐照前后的DPBF吸光度(415 nm)。源数据文件中提供了源数据。
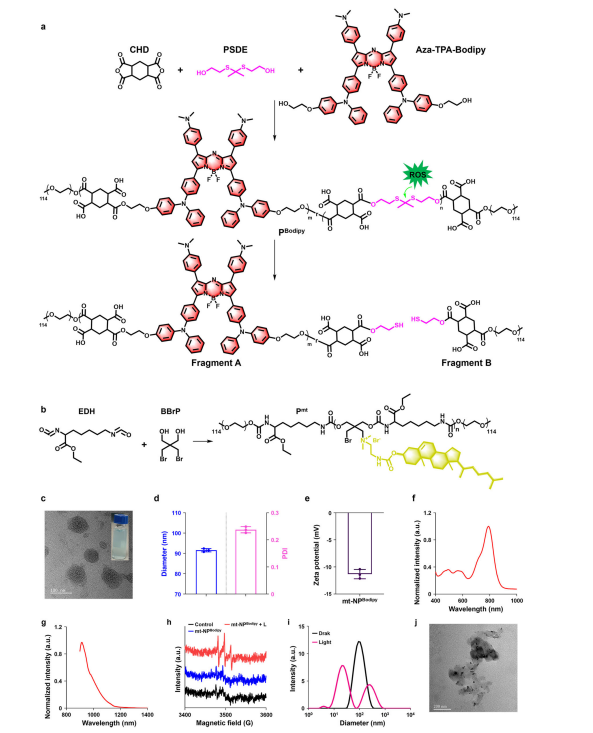
图3:mt-NPBodipy的制备与表征
图(a)PBodipy的合成路线。试剂和条件:干燥DMF,室温,48小时;mPEG5000OH,室温,24小时。
图(b)Pmt的合成路线。试剂和条件:干燥DMF,室温,48小时;mPEG5000OH,室温,24小时。DMF/CH3CN,N,N-二甲基胆碱,80°C,24小时。
图(c) mt-NPBodipy的代表性TEM图像(n = 3次独立实验)。
图(d) mt-NPBodipy的水动力直径和PDI(n=3次独立实验)。
图(e) mt-NPBodipy的ζ电位(n = 3次独立实验)。
图(f) mt-NPBodipy的吸收光谱。
图(g) mt-NPBodipy的PL光谱。
图(h) mt-NPBodipy在近红外光照射下,以TEMP为陷阱的ESR光谱。
图(i)近红外光照射后mt-NPBodipy的水动力直径变化。
图(j)近红外光照射10分钟后mt-NPBodipy的代表性TEM图像(n = 3次独立实验)。数据以平均值±标准差的形式呈现。源数据文件见源数据文件。
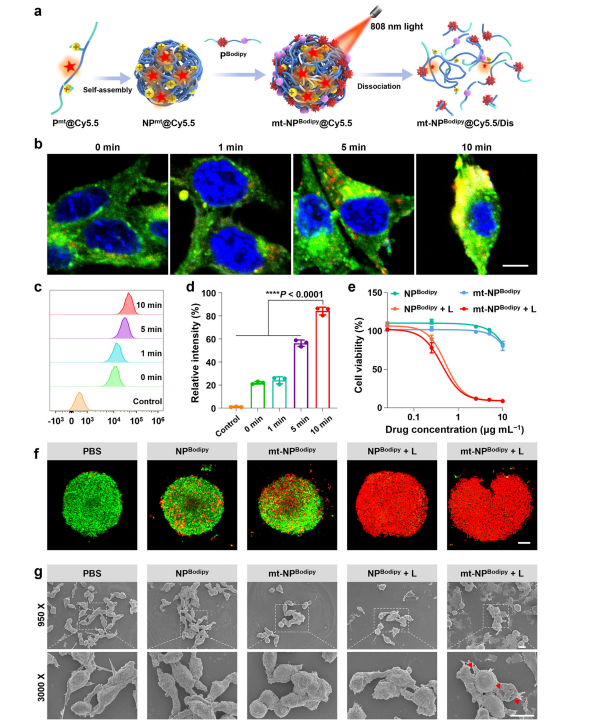
图4:体外评估mt-NPBodipy
图(a) mt-NPBodipy + L的机制示意图。
图(b) CT26细胞与mt-NPBodipy@Cy5.5共孵育后的CLSM图像。叠加图像显示了mt-NPBodipy@Cy5.5在细胞内的定位。DiO(绿色)用于染色细胞膜。mt-NPBodipy@Cy5.5与DiO的共定位以黄色表示。比例尺为10微米。
图(c)通过FCM测定法,图(d)量化CT26细胞与mt-NPBodipy@Cy5.5共孵育后的结果(n = 3次实验重复)。数据通过单因素方差分析(ANOVA)并进行Bonferroni多重比较后检验。*p < 0.05,**p < 0.01,***p < 0.001,****p < 0.0001。
图(e) CT26细胞经mt-NPBodipy + L处理后的药物反应曲线(n = 4次实验重复)。
图(f) CT26细胞的3D肿瘤球体经PBS、NPBodipy、mt-NPBodipy、NPBodipy + L和mt-NPBodipy+L(10μg/mL−1)处理12小时后的CLSM图像。比例尺为100微米。
图(g) CT26细胞经PBS、NPBodipy、mt-NPBodipy、NPBodipy + L和mt-NPBodipy+L(10μg/mL−1)处理12小时后的SEM图像。比例尺为10微米。对于(b,f,g),实验独立重复三次,结果相似。
对于图(d)和图(e),数据以平均值±标准差的形式呈现。源数据文件作为源数据文件提供。
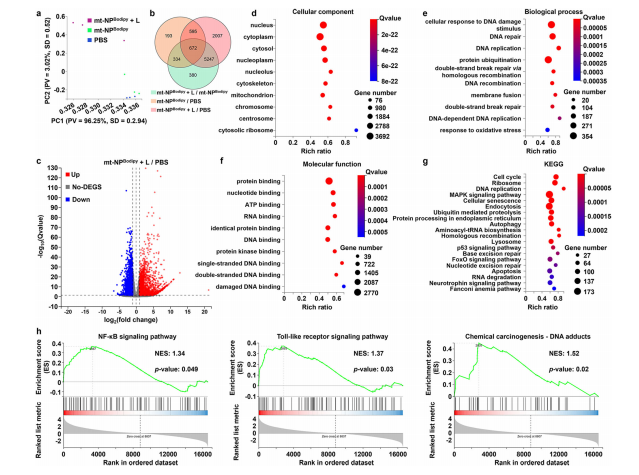
图5:CT26细胞经mt-NPBodipy + L处理后的转录组分析
图(a) CT26细胞经PBS、mt-NPBodipy和mt-NPBodipy + L处理后表达基因的主成分分析(PCA)得分图。
图(b)已识别差异表达基因的维恩图。
图(c)与PBS相比,火山图显示了8521个差异表达基因(总基因数为16592个),其中4416个基因上调,4105个基因下调。
图(d-f)经mt-NPBodipy + L处理后,细胞中细胞组分(d)、生物过程(e)和分子功能(f)的GO分类。
图(g)经mt-NPBodipy + L处理后差异表达基因的KEGG富集分析。
图(h)GSEA显示mt-NPBodipy + L处理细胞中改变的基因正向富集(数据通过GSEA软件包分析,未作任何修改)。
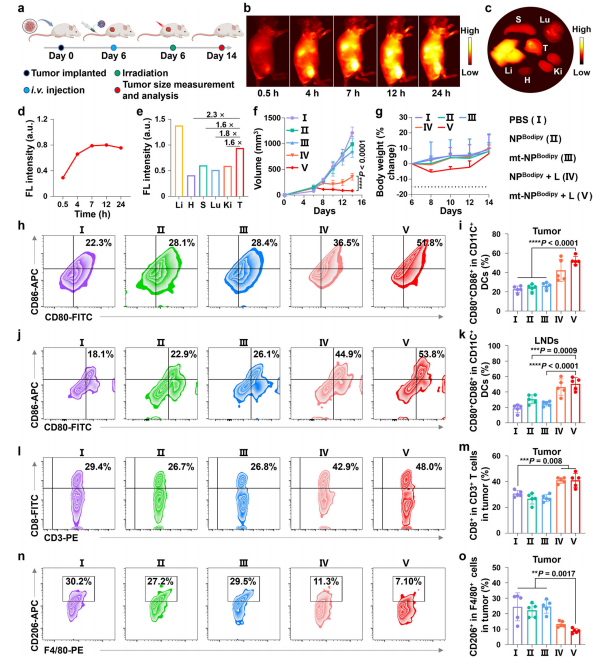
图6:在携带CT26肿瘤的BALB/c小鼠模型中,评估了mt-NPBodipy + L的成像和光免疫治疗特性
图(a)在CT26肿瘤携带的BALB/c小鼠模型中,使用mt-NPBodipy + L治疗的时间表图。图由Biorender.com创建。
图(b)小鼠在不同时间点注射mt-NPBodipy后,体内NIR-II荧光生物成像。
图(c)小鼠在24小时后被处死后,主要组织和器官(脾脏S;心脏H;肺Lu;肾脏Ki;肝脏L;肿瘤T)的NIR-II荧光成像。
图(d)不同时间点肿瘤部位的半定量NIR-II荧光分析。
图(e) 24小时后器官的半定量NIR-II荧光分析(脾脏S;心脏H;肺Lu;肾脏Ki;肝脏L;肿瘤T)。f肿瘤生长抑制曲线的比较。
图(g)动物模型体重变化的监测。
图(h)在肿瘤组织中,通过CD11c+细胞门控的CD80+ CD86+树突状细胞的流式细胞术图。
图(i)(h)的量化结果。
图(j)淋巴结中,通过CD11c+细胞门控的CD80+ CD86+树突状细胞的流式细胞术图。
图(k)(j)的量化。
图(l)在肿瘤组织中,对CD3+细胞进行CD8+门控的流式细胞术图。
图(m)(l)的量化。
图(n)在肿瘤组织中,对F4/80+细胞进行CD206+门控的M2巨噬细胞的流式细胞术图。
图(o)(n)的量化。数据以均值±标准差表示。每组有5只生物学独立的小鼠。数据通过单因素方差分析(ANOVA)和Bonferroni多重比较后检验(i,k,m,o)以及双因素方差分析(ANOVA)和Bonferroni多重比较后检验(f)进行分析。*p < 0.05,**p < 0.01,***p < 0.001,****p < 0.0001。源数据文件见源数据文件。
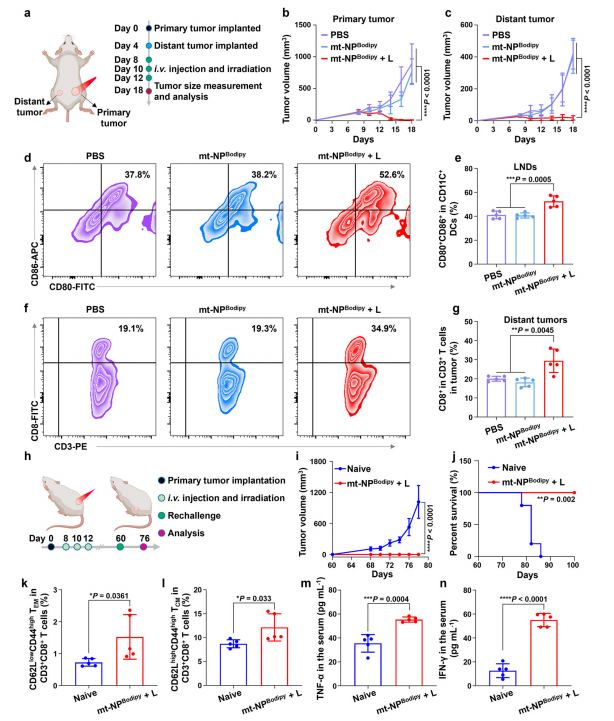
图7:mt-NPBodipy + L消除远处肿瘤并诱导长期免疫记忆效应
图(a)在BALB/c小鼠携带CT26肿瘤模型中,mt-NPBodipy+L的治疗方案用于消除远处肿瘤。图由Biorender.com制作。
图(b)对原发肿瘤(n = 7)的生长抑制曲线进行比较。
图(c)对远处肿瘤(n = 7)的生长抑制曲线进行比较。
图(d)通过流式细胞术(FCM)分析,门控在淋巴结中的CD11c+细胞上的CD80+ CD86+树突状细胞。
图(e)对d的量化结果。f通过流式细胞术(FCM)分析,门控在远处肿瘤中的CD3+细胞上的CD8+。g对f的量化结果。
图(h)在BALB/c小鼠携带CT26肿瘤模型中,mt-NPBodipy + L的治疗方案用于诱导长期免疫记忆效应。图由Biorender.com制作。
图(i)治疗小鼠的平均肿瘤生长曲线(n = 5)。
图(j)治疗小鼠的生存曲线(n = 5)。
图(k)从淋巴结中的CD8+ T细胞中相对定量效应记忆T细胞(Tem,CD62L+ CD44+)亚群。
图(l)从淋巴结中的CD8+ T细胞中相对定量中心记忆T细胞(Tcm,CD62L+ CD44+)亚群。
图(m,n)肿瘤再挑战后血清中TNF-α (m)和IFN-γ (n)的细胞因子水平。数据以均值±标准差表示(e,g,k-n)。每组n = 5只生物学独立的小鼠(e,g,k-n)。数据通过双因素方差分析结合Bonferroni多重比较后检验(b,c,和i),Log-rank(Mantel-Cox)检验(j),以及双尾非配对t检验(e,g,k-n)进行分析。*p < 0.05,**p < 0.01,***p < 0.001,****p < 0.0001。源数据见源数据文件。
创新策略:
通过NIR-II光控纳米颗粒实现细胞膜破坏、光动力治疗和免疫治疗的协同作用。
阳离子聚合物Pmt 直接破坏肿瘤细胞膜,克服了传统PDT免疫激活不足的局限。
转化意义:
为实体瘤治疗提供了一种高效、低毒的多模式联合治疗方案。
通过光控释放实现精准治疗,减少对正常组织的损伤。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:NanoLuc-EGFR 工程细胞系用于活细胞中 EGFR 蛋白动态的实时监测研究
下一篇:荧光 “导航仪” 精准切除胶质母细胞瘤,小鼠模型验证生存期延长 25%