常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-06-28 09:00:00 细胞资源库平台 访问量:236
在生物医学研究和药物开发领域,生物发光成像技术因其高信噪比而被广泛应用于细胞测定和动物成像研究。然而,传统的荧光素酶种类有限,限制了同时成像多个分子和细胞事件的能力。为了突破这一限制,科学家们开发了一种新型的ATP非依赖性荧光素酶——NanoLuc(NL),它源自深海虾Oplophorus gracilirostris,并经过工程改造以增强蛋白质稳定性。NanoLuc作为一种小型(19 kDa)、高亮度的荧光素酶,其亮度是传统萤火虫或海肾荧光素酶的100倍,并且使用furimazine作为底物产生明亮的辉光型发光。NanoLuc的意义在于其为双报告基因生物发光分子成像提供了新的可能。它不仅可以在活体小鼠的表层和深层组织中成像,而且其生物发光随时间的变化可以用来定量肿瘤生长,甚至在少量血清中也能检测到分泌的NL。此外,NanoLuc与萤火虫荧光素酶的结合使用,为在完整细胞和活体小鼠中定量TGF-β信号传导的两个关键步骤提供了一种新型双荧光素酶成像策略,从而在正常生理、疾病和药物开发中扩展了信号转导的成像能力。NanoLuc的作用不仅体现在其高灵敏度和高稳定性上,它还具有更小的尺寸,这使得在标记细胞和蛋白质时对样本的侵入性更小,有助于保持细胞或组织的天然状态。NanoLuc的快速反应、低背景发光和多样灵活等特点,使其在生物学和医学研究中具有广泛的应用前景。因此,NanoLuc作为一种新的报告基因,不仅增强了我们对生物过程的理解和疾病机理的研究,而且在开发潜在治疗方法和疗法方面发挥了重要作用。
英文标题:Investigating NanoLuc-EGFR engineered cell lines for real-time monitoring of EGFR protein dynamics in live cells
中文标题:NanoLuc-EGFR 工程细胞系用于活细胞中 EGFR 蛋白动态的实时监测研究
发表期刊:《Biochemical and Biophysical Research Communications》
影响因子:2.2
作者单位:
Department of Radiation Oncology, University of Michigan, Ann Arbor, MI, 48109, USA
Department of Internal Medicine, University of Michigan, Ann Arbor, MI, 48109, USA
作者信息:
Ranjit K. Mehta, Mingjia Tan, Mohammed K. Hassan, Tengda Zhao, David M. Markovitz, Theodore S. Lawrence, Mukesh K. Nyati
表皮生长因子受体(EGFR)在细胞生长、分化及多种恶性肿瘤发生中起关键作用,当前针对 EGFR 的药物开发转向促进蛋白降解而非仅抑制激酶活性,但传统检测方法(如免疫印迹、ELISA)只能对固定细胞或裂解物进行间断性检测,无法实时动态监测活细胞中 EGFR 的降解过程。新兴的生物发光标记技术通过 CRISPR 方法将 NanoLuc 荧光素酶的 11 氨基酸肽段(HiBiT)融合到 EGFR 的 N 端,为实时定量分析 EGFR 蛋白动态提供了可能,而 NanoLuc-EGFR 细胞系的建立有望推动 EGFR 相关药物开发及蛋白调控机制研究。
研究通过 CRISPR/Cas9 技术构建 A549-HiBiT-EGFR 细胞系,利用 Nano-Glo HiBiT 检测系统优化底物浓度(细胞外检测 1:400 稀释,裂解检测 1:200 稀释)和细胞密度(1000 cells/well),实现活细胞表面及总 EGFR 水平的定量检测。采用免疫印迹验证 AT13387 和 H84T BanLec 诱导的 EGFR 降解,并通过免疫荧光观察 EGFR 及磷酸化 EGFR 的定位与表达变化,同时利用细胞活力检测(CellTiter-Glo)确保实验条件的可靠性。
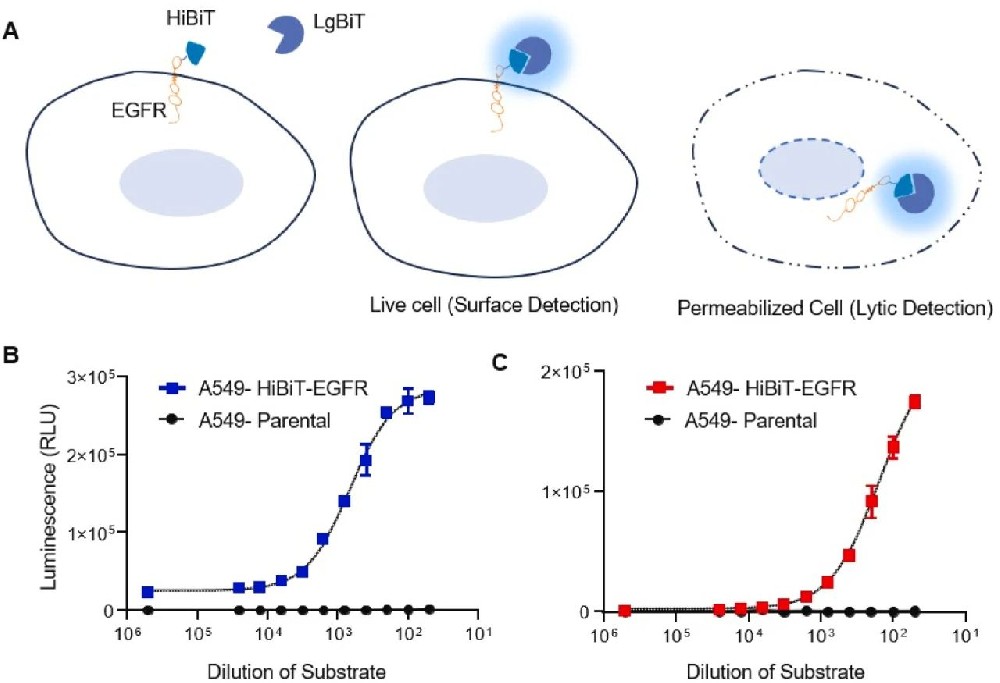
图1:EGFR 检测底物用量的开发与优化及在 HiBiT 细胞中的验证
通过 split NanoLuc 荧光素酶系统,将 HiBiT 标签融合到 EGFR 的 N 端,与 LgBiT 亚基结合后催化底物产生生物发光信号,实现活细胞表面(细胞外检测)和总 EGFR(裂解检测)的定量分析。优化后发现,1:400 稀释的细胞外检测底物和 1:200 稀释的裂解检测底物能显著提高信号特异性,且 parental A549 细胞无发光信号,证实了检测的特异性。
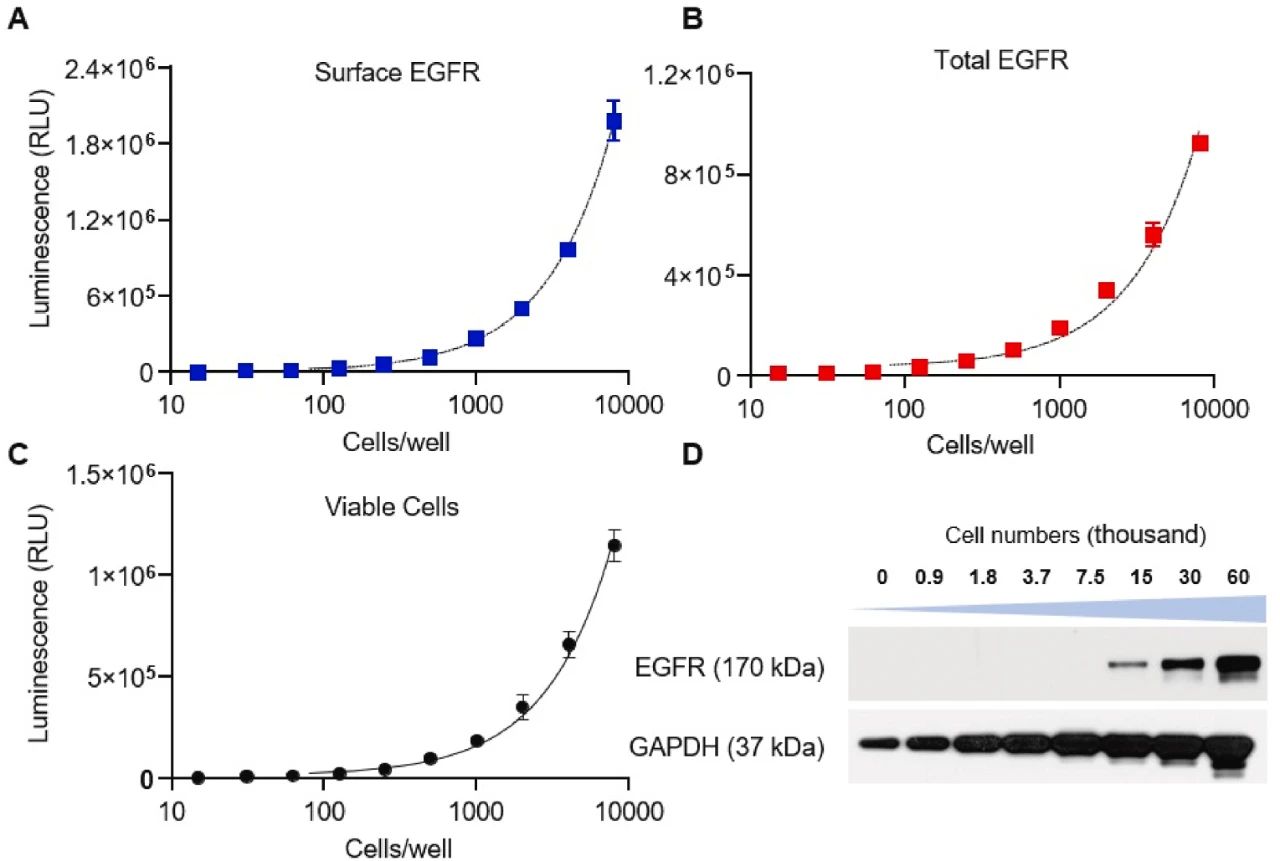
图2:EGFR 检测的细胞数量优化
在 96 孔板中优化细胞密度发现,1000 cells/well 即可有效检测表面和总 EGFR 水平,且与传统免疫印迹法相比,HiBiT 检测灵敏度更高(免疫印迹需至少 15,000 cells)。细胞活力检测显示,该密度下细胞 viability 与 EGFR 检测信号呈正相关,确保了实验数据的可靠性。
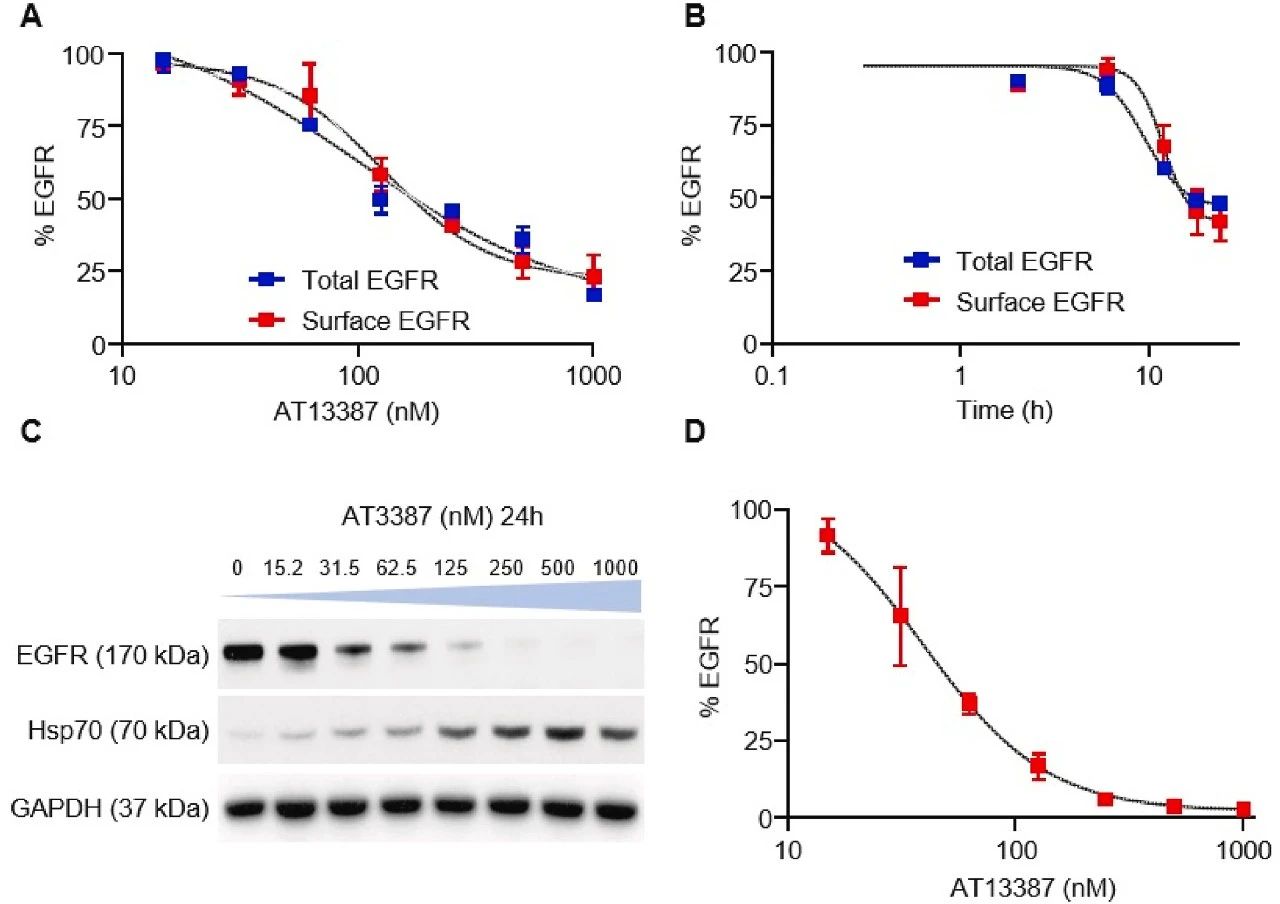
图3:AT13387 诱导 EGFR 降解的验证
AT13387(Hsp90 抑制剂)处理 A549-HiBiT 细胞后,EGFR 的生物发光信号呈浓度和时间依赖性降低,免疫印迹结果与之一致,且 Hsp70 表达代偿性升高,证实 AT13387 通过抑制 Hsp90 促进 EGFR 降解。
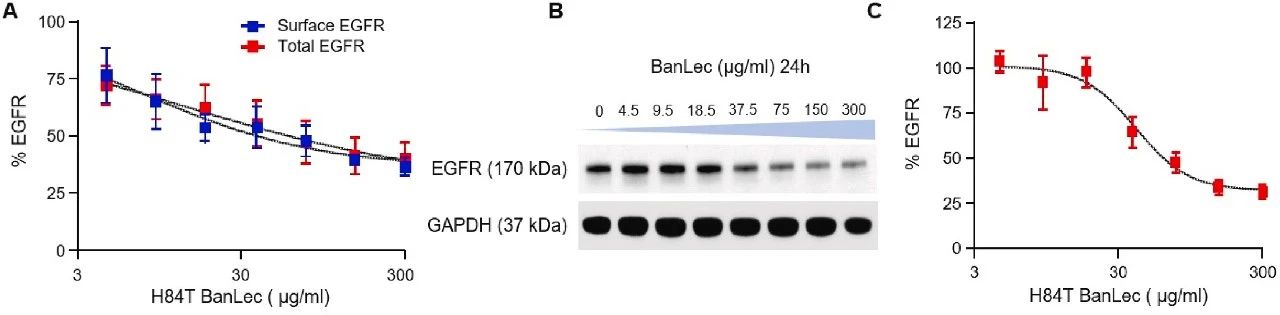
图4:H84T BanLec 诱导 EGFR 降解的验证
基因工程香蕉凝集素 H84T BanLec 处理后,EGFR 的表面和总蛋白水平均随浓度增加而显著降低,免疫印迹进一步验证了 EGFR 的降解,表明 H84T BanLec 可通过结合 EGFR 的高甘露糖聚糖诱导其内吞和溶酶体降解。
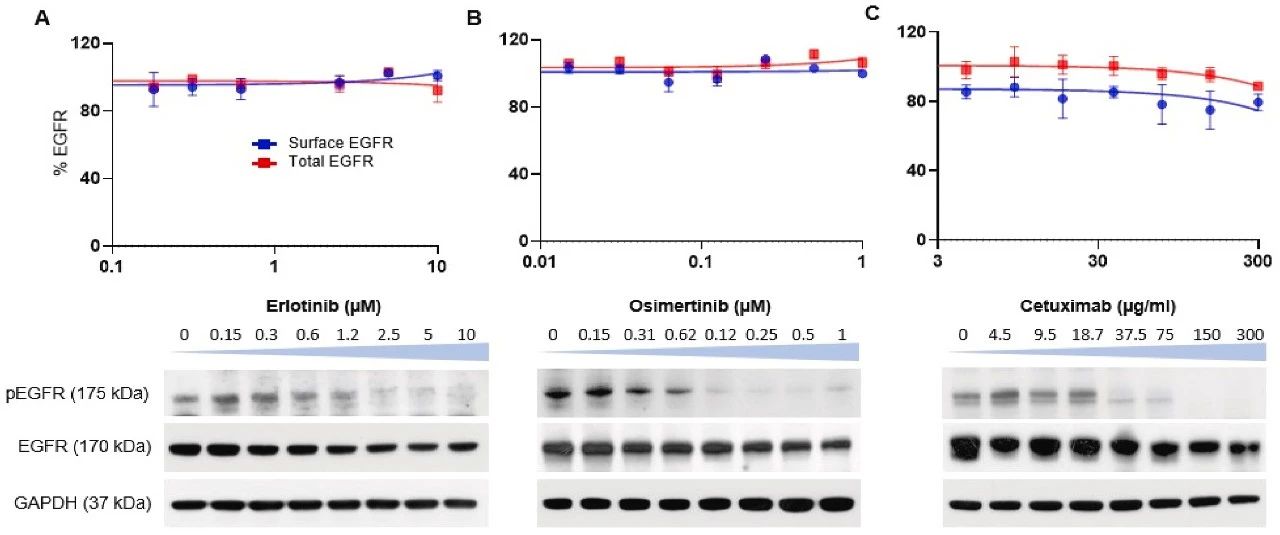
图5:厄洛替尼、奥希替尼和西妥昔单抗对生物发光的影响
EGFR 酪氨酸激酶抑制剂(厄洛替尼、奥希替尼)和西妥昔单抗处理后,EGFR 磷酸化水平在 30 分钟内被显著抑制,但 24 小时内总 EGFR 的生物发光信号无明显变化,免疫印迹也证实总 EGFR 水平未受影响,说明这些药物仅抑制激酶活性而不诱导蛋白降解。
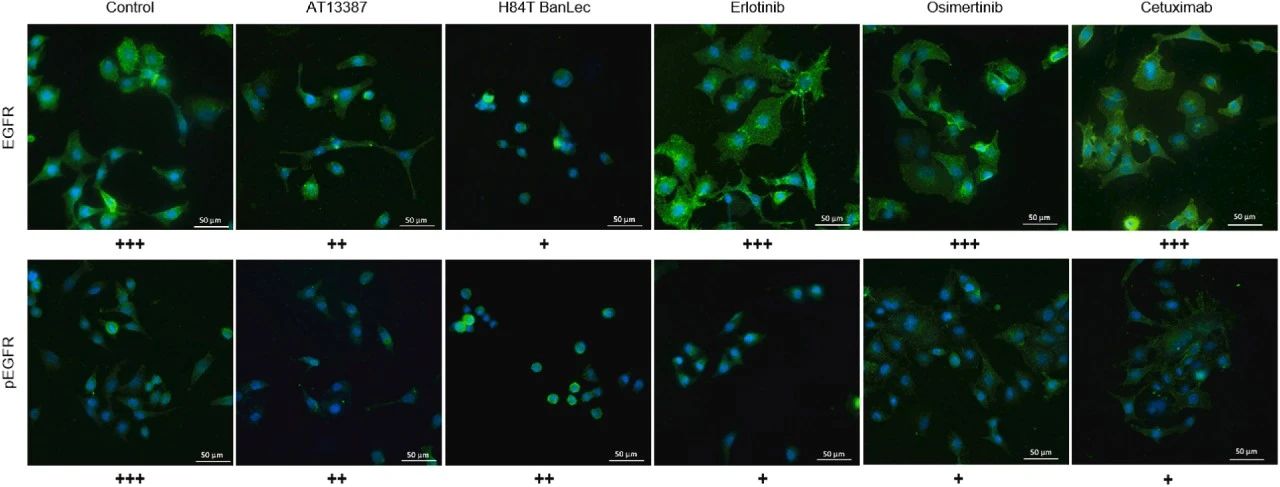
图6:免疫荧光法确认 EGFR 稳态和 EGFR 磷酸化
免疫荧光染色显示,AT13387 和 H84T BanLec 处理后 EGFR 免疫荧光强度降低,而厄洛替尼、奥希替尼和西妥昔单抗处理后 EGFR 水平无明显变化,磷酸化 EGFR 染色进一步区分了总 EGFR 与磷酸化形式的差异,验证了生物发光检测结果的准确性。
NanoLuc-EGFR 细胞系可实时定量监测活细胞中 EGFR 的蛋白动态,发现 Hsp90 抑制剂 AT13387 和基因工程香蕉凝集素 H84T BanLec 能浓度依赖性诱导 EGFR 降解,而 EGFR 酪氨酸激酶抑制剂(厄洛替尼、奥希替尼)及单克隆抗体西妥昔单抗仅抑制 EGFR 磷酸化,不改变总 EGFR 水平。该技术为筛选促进 EGFR 降解的药物提供了高效平台,也为研究蛋白降解机制和开发靶向疗法奠定了基础。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:科学家发现乙肝病毒入侵 “帮凶”!这种蛋白让肝细胞易感性提升 50%
下一篇:近红外光触发的纳米粒子破坏细胞膜,用于癌症成像和光免疫治疗