常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-06-16 09:06:23 细胞资源库平台 访问量:175
荧光素酶报告基因系统是一种基于荧光素酶催化底物氧化反应产生生物发光的检测技术,广泛应用于细胞生物学研究。其中,萤火虫荧光素酶(firefly luciferase, Fluc)因其高灵敏度、宽线性检测范围(约7~8个数量级)以及较短的半衰期(在哺乳动物细胞中约为3小时,在植物细胞中约为3.5小时)而成为最常用的报告基因。其发光信号强度在酶浓度为10⁻¹⁶ mol/L至10⁻⁸ mol/L的范围内与酶活性呈线性关系,并且在理想条件下可检测到低至10⁻²⁰ mol/L的荧光素酶活性。此外,荧光素酶报告基因系统具有非放射性、检测快速、灵敏度高(比氯霉素乙酰转移酶CAT高100倍)等优点,特别适用于高通量筛选和活细胞检测。通过将荧光素酶报告基因载体转染至宿主细胞后,可利用荧光素酶检测系统灵敏且便捷地监测基因表达水平,已成为细胞生物学研究中的重要工具。
英文标题:Imaging CAR-NK cells targeted to HER2 ovarian cancer with human sodium-iodide symporter-based positron emission tomography
中文标题:基于人钠碘同向转运体的正电子发射断层成像对 HER2 阳性卵巢癌靶向 CAR-NK 细胞的成像研究
发表期刊:《Eur. J. Nucl. Med. Mol. Imaging》
影响因子:8.6
作者单位:
1.Department of Medical Biophysics, Schulich School of Medicine and Dentistry, Western University, London, ON, Canada
2.Robarts Research Institute, Schulich School of Medicine and Dentistry, Western University, London, ON, Canada
3.Lawson Health Research Institute, London, ON, Canada
作者信息:
Nourhan Shalaby, Ying Xia, John J Kelly
卵巢癌是致死率最高的妇科恶性肿瘤,70% 患者术后易复发且对化疗耐药,亟需新型治疗策略。HER2 在约 27.6% 的卵巢癌中高表达,但其靶向抗体(如曲妥珠单抗)疗效有限。CAR-T 疗法虽在血液肿瘤中表现优异,但其自体细胞制备复杂、成本高昂,且存在细胞因子释放综合征(CRS)和神经毒性等风险。相比之下,CAR-NK 细胞作为 “现货型” 异体疗法,无移植物抗宿主病(GVHD)风险,兼具 CAR 依赖性和非依赖性杀瘤能力,早期临床显示安全性高。然而,传统影像学(如 CT、FDG-PET)难以实时追踪 CAR-NK 细胞在体内的分布和存活状态,而 PET 报告基因(如人钠碘同向转运体 NIS)可通过特异性探针实现无创动态监测,为评估细胞治疗效果提供关键技术支持。
研究通过慢病毒转导构建了 HER2 靶向 CAR-NK-92 细胞,共表达生物发光报告基因 Antares 和 PET 报告基因 NIS,以实现双模态成像追踪。体外实验中,采用不同效应靶细胞比(E:T=1:1、2:1、5:1)验证 CAR-NK 细胞对 HER2 + 卵巢癌细胞(SKOV3-ip1)的杀伤能力,通过荧光素酶生物发光成像(BLI)量化细胞存活。在动物模型中,建立 HER2 + 卵巢癌小鼠腹腔转移模型,分三组处理:PBS 对照组、naive NK 细胞组、NIS+Antares+CAR-NK 细胞组(三次腹腔注射联合 IL-2 维持)。成像分析采用 Fluc BLI 追踪肿瘤负荷,Antares BLI 监测 CAR-NK 细胞分布,并通过 NIS 特异性探针 [18F] TFB 进行 PET 成像。组织学分析通过腹腔灌洗、免疫荧光染色和 H&E 染色评估肿瘤细胞和 CAR-NK 细胞的分布及组织形态。
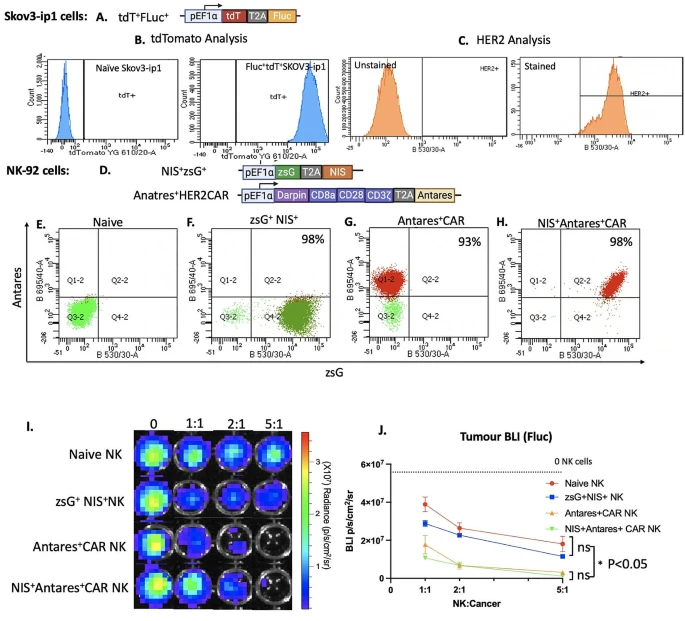
图1:CAR-NK 细胞构建与体外功能验证
该图展示了 HER2 靶向 CAR-NK-92 细胞的工程化构建流程,包括慢病毒转导共表达 CAR、Antares 和 NIS 基因,并通过流式细胞术验证 CAR 阳性率。体外细胞毒性实验显示,CAR-NK 细胞在不同 E:T 比下对 HER2 + 卵巢癌细胞的杀伤活性显著高于 naive NK 细胞,且杀伤效果呈剂量依赖性。此外,ELISA 检测显示 CAR-NK 细胞与肿瘤细胞共培养后分泌 IFN-γ 水平显著升高,表明其功能激活。
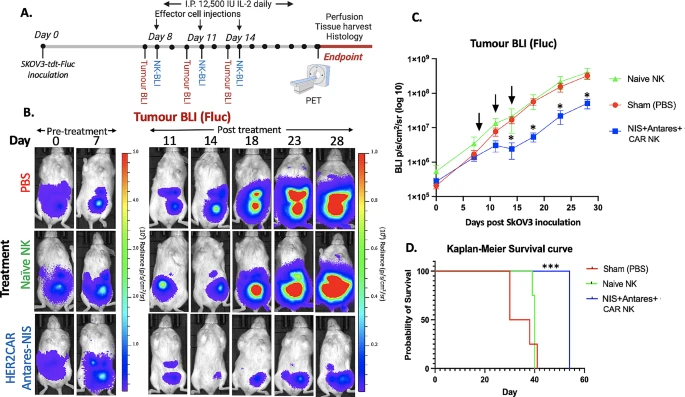
图2:体内接种和 BLI 肿瘤追踪
图 2A 为实验设计示意图,展示小鼠腹腔注射肿瘤细胞后分三组治疗及监测流程。图 2B 和 2C 通过 Fluc BLI 定量分析显示,CAR-NK 治疗组肿瘤信号显著低于对照组,且在第 14、18、23、28 天差异均具有统计学意义(p<0.05)。图 2D 的 Kaplan-Meier 生存曲线表明,CAR-NK 治疗组小鼠中位生存期显著长于 PBS 组和 naive NK 组(p<0.001),直接验证了 CAR-NK 细胞的体内抗肿瘤效果。
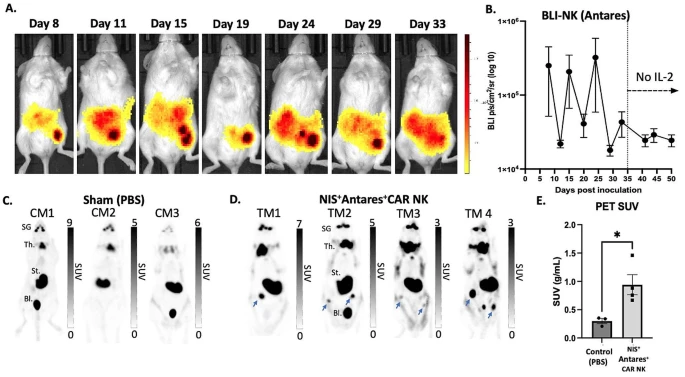
图3:NIS-PET 成像追踪 CAR-NK 细胞分布
该图显示腹腔注射 [18F] TFB 后,CAR-NK 治疗组小鼠腹腔内 PET 信号显著高于对照组,且信号强度与 Antares BLI 结果一致,表明 NIS-PET 可有效可视化 CAR-NK 细胞的体内分布。动态成像结果显示,CAR-NK 细胞在肿瘤部位持续积累,信号峰值出现在治疗后 72 小时,随后逐渐下降,提示细胞在体内的存活和迁移规律。
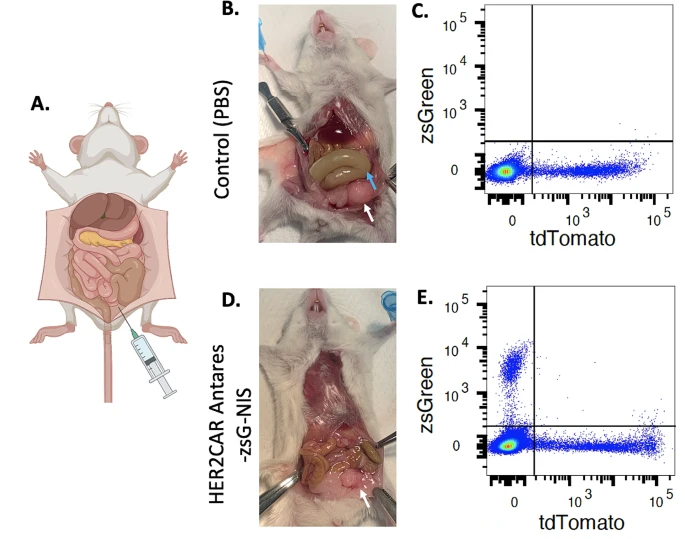
图4:组织学分析与免疫荧光染色
免疫荧光染色显示,CAR-NK 治疗组肿瘤组织中 CD56+(NK 细胞标记)和 tdTomato+(肿瘤细胞标记)信号共定位,表明 CAR-NK 细胞有效浸润肿瘤微环境。H&E 染色显示对照组肿瘤组织结构紊乱、血管增生,而 CAR-NK 治疗组肿瘤细胞凋亡增加、间质纤维化明显,进一步支持其抗肿瘤机制。腹腔灌洗液流式分析显示,CAR-NK 治疗组小鼠腹腔内肿瘤细胞数量显著减少,而 CAR-NK 细胞比例升高,验证了其直接杀伤作用。
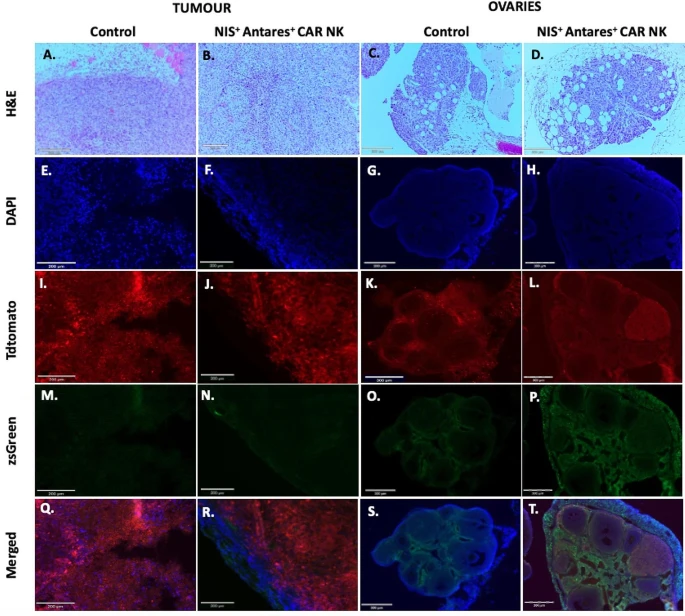
图5:肿瘤与卵巢组织学及荧光显微镜分析
通过 H&E 染色和荧光显微镜对比了 PBS 对照组与 CAR-NK 治疗组的肿瘤及卵巢组织。H&E 染色显示,对照组肿瘤细胞密集、结构紊乱(图 5A-B),而治疗组肿瘤细胞数量减少,间质纤维化明显(图 5D)。荧光显微镜下,两组肿瘤均可见 tdTomato+(肿瘤细胞标记)信号(图 5E-H),但治疗组卵巢组织周围出现显著的 zsGreen+(CAR-NK 细胞标记)信号(图 5P),提示 CAR-NK 细胞选择性聚集于卵巢肿瘤微环境,而非直接浸润主肿瘤灶(图 5N)。该结果与 PET 成像中卵巢区域的 [¹⁸F] TFB 摄取(图 3D 蓝箭头)直接对应,揭示了 CAR-NK 细胞的靶向迁移特性。此外,治疗组卵巢皮质周围的 zsGreen + 细胞(图 5P-T)表明其可能通过旁分泌效应抑制肿瘤进展,为 CAR-NK 细胞的 “旁观者效应” 提供了组织学证据。
HER2 靶向 CAR-NK 细胞显著抑制卵巢癌小鼠肿瘤生长并延长生存期,疗效优于 naive NK 细胞。双模态成像结果显示,Antares BLI 可长期追踪 CAR-NK 细胞在腹腔内的分布,信号稳定且与肿瘤部位共定位;NIS-PET 成像通过 [18F] TFB 探针实现了 CAR-NK 细胞的无创可视化,腹腔内信号显著高于对照组。人源 NIS 报告基因无免疫原性,结合 PET 成像可量化监测 CAR-NK 细胞的体内动态,为 “实时评估疗效 - 调整治疗策略” 提供了可能,展现了 CAR-NK 细胞疗法在卵巢癌治疗中的临床转化潜力。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
下一篇:T 细胞转移研究警告Thy1.1小鼠遭遇Thy1.2肿瘤竟产"杀手抗体"转移T细胞被系统清除