常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-06-17 09:07:03 细胞资源库平台 访问量:306
同源异体小鼠肿瘤模型是免疫肿瘤学(I/O)研究中不可或缺的临床前模型,但它们对免疫检查点抑制剂(ICIs)的反应有限,这可能是由于它们的固有低免疫原性。为了解决这一问题,研究人员通过将鸡卵清蛋白(OVA)这一高度免疫原性的蛋白质表达到同源异体肿瘤细胞中,开发了新的免疫原性同源异体模型。这些模型,如DC2.4-OVA和B16-OVA,显示出比它们的亲本细胞系更慢的肿瘤生长速度,这可能是由于免疫介导的排斥反应。更重要的是,这些OVA表达的模型对ICIs,特别是抗PD-1治疗,表现出更高的敏感性,这表明它们在增强T细胞介导的免疫反应方面具有潜力。此外,通过过继T细胞转移实验,研究人员验证了这些模型中存在肿瘤特异性记忆T细胞。这些结果表明,OVA工具细胞不仅增强了对ICIs的反应,而且为临床前免疫治疗评估提供了新的、具有更高免疫原性的同源异体模型,这对于I/O研究具有重要的意义。
英文标题:A caveat for T cell transfer studies: generation of cytotoxic anti-Thy1.2 antibodies in Thy1.1 congenic mice given Thy1.2+ tumors or T cells
中文标题:T 细胞转移研究的警示:Thy1.1 同基因小鼠在接受 Thy1.2 + 肿瘤或 T 细胞后产生细胞毒性抗 Thy1.2 抗体
发表期刊:《J.Leukocyte Biol》
影响因子:3.6
作者单位:
1.Departments of Ophthalmology and Immunology, University of Pittsburgh School of Medicine, Pittsburgh, Pennsylvania, USA
2.Graduate Program in Immunology, University of Pittsburgh School of Medicine, Pittsburgh, Pennsylvania, USA
3.Department of Ophthalmology, University of Pittsburgh School of Medicine, Pittsburgh, Pennsylvania, USA
作者信息:
Kyle C. McKenna, Rodolfo D. Vicetti Miguel, Kelly M. Beatty
在 T 细胞过继转移研究中,常利用 Thy1 抗原的同种异型差异追踪供体 T 细胞。本研究发现,Thy1.1 同基因 B6.PL 小鼠在接种 Thy1.2 + 肿瘤(如 E.G7-OVA 或 EL-4)或输注 Thy1.2+ T 细胞后,会产生细胞毒性抗 Thy1.2 抗体,导致转移 T 细胞系统性清除。这种抗体反应受抗原接种途径(眼前房 vs. 皮肤)和肿瘤抗原表达(如 OVA 免疫优势)的影响,提示 Thy1 异型差异在 T 细胞转移实验中可能引入误导性结果。
研究选用 Thy1.1 同基因 B6.PL 小鼠、Thy1.2 野生型 C57Bl/6 小鼠及 B 细胞缺陷 MT 小鼠,分别接种 E.G7-OVA(表达 OVA 的 EL-4 细胞)或 EL-4 肿瘤细胞于眼前房或皮肤。体外通过 OVA 肽刺激 OT-I 小鼠脾细胞诱导 OVA 特异性 CTL,经 Ficoll 分离后获得高纯度 Thy1.2+ CD8+ T 细胞;2C CTL 则通过辐照 Balb/C 脾细胞刺激 2C 小鼠脾细胞生成。采用静脉注射转移 CTL 后,通过流式细胞术监测脾、血等组织中 CTL 数量,利用⁵¹Cr 释放实验检测血清抗 Thy1.2 抗体的细胞毒性,并通过体内杀伤实验验证抗体对 Thy1.2+靶细胞的清除效应。
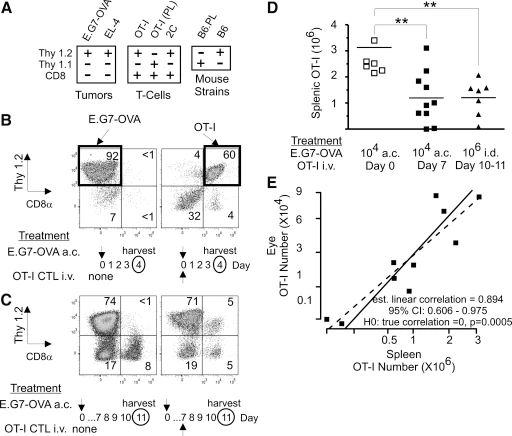
图1:Thy1.2+ CTL 在 Thy1.1 同基因小鼠中的系统性删除
B6.PL 小鼠前房(a.c.)接种 E.G7-OVA 肿瘤后,静脉转移的 Thy1.2+ OT-I CTL 在脾脏和血液中显著减少。实验显示,肿瘤接种当天转移 CTL 可抑制肿瘤生长并伴随 CTL 浸润,但肿瘤接种 7 天后再转移 CTL 时,脾脏 CTL 数量减少 1.6 倍,皮肤肿瘤组亦有 2 倍减少。流式细胞术分析表明,CTL 删除与肿瘤微环境无关,而是系统性清除,且眼内 CTL 数量与脾脏 CTL 数量呈正相关(线性相关系数 0.894),排除了 CTL 向肿瘤局部迁移的解释。
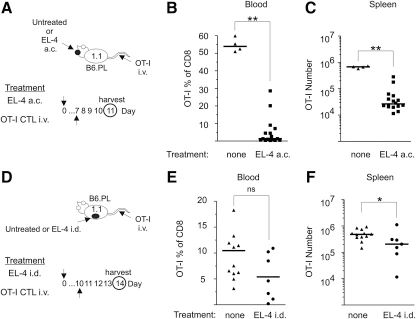
图2:肿瘤表达 OVA 并非删除转移 OT-I CTL 的必要条件
B6.PL 小鼠眼内(a.c.)或皮肤(i.d.)接种不表达 OVA 的 EL-4 肿瘤后,静脉转移 OT-I CTL。结果显示,眼内肿瘤组小鼠血液中 OT-I CTL 百分比降低 41 倍,脾脏 CTL 数量减少 26 倍;皮肤肿瘤组仅出现 2 倍的 CTL 减少。这表明 Thy1.2 + 肿瘤生长即可诱导抗 Thy1.2 免疫应答,而 OVA 抗原可能通过免疫优势抑制抗体生成。
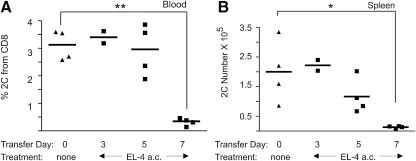
图3:肿瘤生长时间影响转移 CTL 的删除效率
B6.PL 小鼠眼内接种 EL-4 肿瘤后,分别于 3、5、7 天转移 Thy1.2+ 2C CTL。结果显示,肿瘤生长 7 天后转移的 CTL 在血液和脾脏中分别减少 10 倍和 15 倍,而 3 天或 5 天转移的 CTL 无显著删除。该结果符合适应性免疫应答的时间依赖性特征。
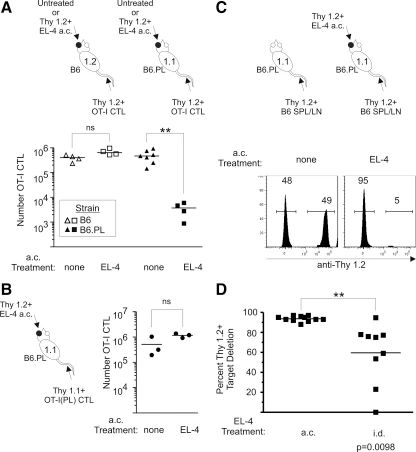
图4:抗 Thy1.2 免疫应答的特异性验证
B6.PL 小鼠(Thy1.1)眼内接种 EL-4 肿瘤后,静脉转移的 Thy1.2+ OT-I CTL 被显著删除(脾脏 CTL 减少 139 倍),而 Thy1.2 同基因 B6 小鼠中 CTL 数量无变化。体内杀伤实验显示,眼内肿瘤组对 Thy1.2 + 靶细胞的删除率达 93.6%,显著高于皮肤肿瘤组的 59.6%。
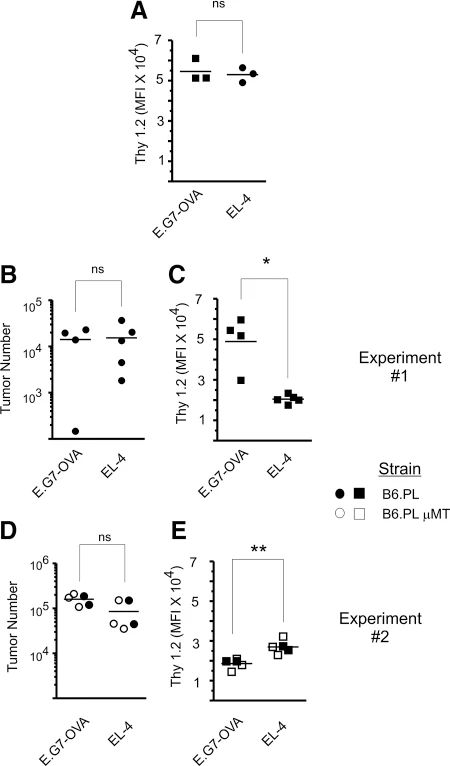
图5:E.G7-OVA 与 EL-4 肿瘤的 Thy1.2 表达及生长特性
流式细胞术显示,E.G7-OVA 与 EL-4 肿瘤在体外的 Thy1.2 表达水平一致,体内生长速度无显著差异。该结果排除了因肿瘤负荷或 Thy1.2 表达差异导致的免疫应答差异,提示 OVA 抗原可能通过竞争 B 细胞表位抑制抗 Thy1.2 抗体生成。
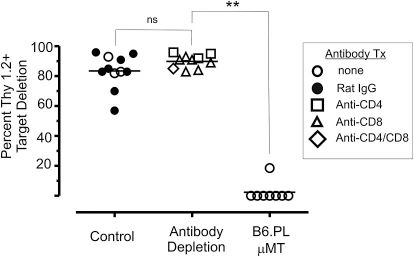
图6:B 细胞是抗 Thy1.2 抗体生成的关键细胞
B 细胞缺陷 MT 小鼠(Thy1.1 背景)眼内接种 EL-4 肿瘤后,无法删除 Thy1.2 + 靶细胞,而野生型 B6.PL 小鼠的删除率达 83.5%。耗竭 CD4 + 或 CD8+ T 细胞不影响 CTL 删除,证实抗体应答依赖 B 细胞而非 T 细胞。
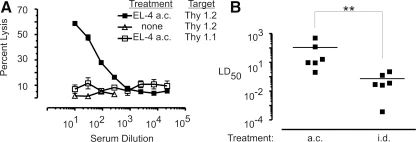
图7:眼内肿瘤诱导的抗 Thy1.2 抗体效价显著高于皮肤肿瘤
补体依赖的细胞毒性实验显示,眼内肿瘤组血清对 Thy1.2+ 靶细胞的半数溶血浓度(LD50)为皮肤肿瘤组的 92 倍。该结果提示眼前房微环境可能通过独特的抗原呈递机制增强抗体应答。
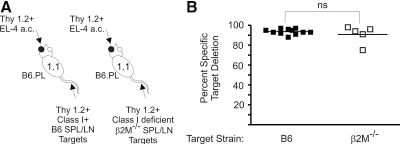
图8:抗 Thy1.2 抗体应答不依赖 MHC I 类分子
使用 MHC I 类缺陷(β2M⁻/⁻)小鼠的 Thy1.2+ 靶细胞进行体内杀伤实验,B6.PL 眼内肿瘤小鼠仍能有效删除靶细胞。这表明抗体应答不依赖 MHC I 类限制,支持抗原竞争理论。
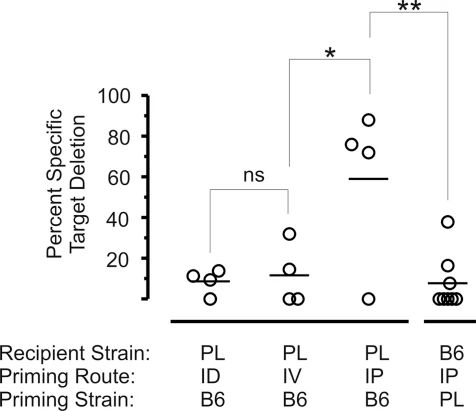
图9:naïve Thy1.2 T 细胞的接种途径影响抗体生成
腹腔(i.p.)注射 Thy1.2+ 脾细胞诱导的抗 Thy1.2 应答最强(靶细胞删除率 60%),而静脉(i.v.)或皮内(i.d.)注射的删除率接近零。该结果提示 T 细胞转移途径可能意外诱导抗 Thy1 抗体生成,影响实验结果。
本研究证实,Thy1.1 同基因小鼠在接受 Thy1.2+ 肿瘤或 T 细胞后,会产生补体依赖的细胞毒性抗 Thy1.2 抗体,导致转移 Thy1.2+ T 细胞系统性清除。抗体产生效率受抗原接种途径显著影响,眼前房接种肿瘤诱导的抗体效价比皮肤接种高 92 倍,而肿瘤表达 OVA 抗原可通过免疫优势抑制抗 Thy1.2 抗体的生成。机制研究表明,B 细胞是产生该抗体的关键细胞,且抗体应答不依赖 MHC I 类分子。鉴于此,研究建议在 T 细胞转移实验中避免单独使用 Thy1 异型差异作为标记,可改用 MHC 四聚体或构建 Thy1.1 背景的 T 细胞株,以规避抗体生成对实验结果的干扰。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:基于人钠碘同向转运体的正电子发射断层成像对 HER2 阳性卵巢癌靶向CAR-NK细胞的成像研究
下一篇:肝病治疗新突破NTCP 靶点揭秘:从病毒入侵到胆汁酸代谢的双重调控密码